大鳞副泥鳅腐皮病病原菌及其拮抗菌的分离筛选
杨乔乔,安贤惠,韩迎亚,马 臻,朱 明,2,隆小华,李联泰
( 1.淮海工学院,江苏 连云港 222005; 2.连云港龙源生物科技有限公司,江苏 连云港 222005;3.南京农业大学,江苏 南京 210095 )
泥鳅(Misgurnusanguillicaudatus),因其肉质鲜美、营养丰富而深受人们的喜爱,具有“水中人参”之美誉。连云港是全国最大的泥鳅养殖和出口基地,也是全国唯一的国家级出口泥鳅质量安全示范区。每年出口泥鳅约1×104t,产值逾4×107美元。大鳞副泥鳅(Paramisgurnusdabryanus)因其体型较大,生长快、抗逆性强、产量高等优点,成为近年新兴的养殖品种。但随着养殖面积的扩大和养殖密度的增加,病害发生也愈加频繁。其中泥鳅腐皮病是最为常见且危害较大的疾病之一。
泥鳅腐皮病传染性强、潜伏期长、发病率较高且危害大[1],其症状为鳅体局部或全身溃疡,表面分布大面积血斑,有时也会出现烂身、烂鳍、食欲不振等情况。更严重的是,病鳅死后,其内脏系统受损,大部分沉入水底,或埋于淤泥,因此不能及时处理。只有尸体被泡胀后才能浮出水面,导致死鳅腹腔内大量病菌扩散至整个池塘,从而造成更大的污染和病原传播[2]。关于泥鳅腐皮病病原的研究,仅见萧克宇等[3]报道的温和气单胞菌(Aeromonadssobria)。
对腐皮病的防控和治疗,目前主要依赖传统的化学药物(包括抗生素等),其往往使病原菌产生耐药性,影响治疗效果;药物残留也会干扰水产动物肠道益生菌的生长和繁殖;残留在水体中的消毒剂和抗生素破坏养殖水环境,导致水产品质量降低[4]。有报道显示,由于水产品药物残留导致出口受阻,给我国的水产品出口业造成巨大的经济损失[5]。利用拮抗菌来抑制病原菌的发生是一种环境友好型的病害防治方法。Kozasa[6]首次运用1株自土壤中分离的东洋芽孢杆菌(Bacillustoyoi)处理鳗鲡(Anguillajaponica),降低了由爱德华菌(Edwardsiella)引起的鳗鲡死亡率;赵淑江等[7]从南麂岛近海海洋沉积物中筛选出86株放线菌,其中有5株海洋放线菌对大黄鱼(Pseudosciaenacrocea)病原性弧菌——副溶血弧菌(Vibrioparahaemolyticus)和哈维弧菌(V.harveyi)具有很强的抑制作用;Acurcio等[8]报道了3株肠球菌(Enterococcus),其具有很强的益生菌特性,对酸性条件和胆汁有很好的耐受性,并且能够抑制李斯特氏菌(Listeia)、金黄色葡萄球菌(Staphyloccocusaureus)、大肠杆菌(Escherichiacoli)等致病菌;张欢欢等[9]自对虾养殖池筛选出1株假交替单胞菌(Pseudoalteromonassp.),对鳗弧菌(V.anguillarum)、哈维弧菌及副溶血弧菌均有较强的抑制作用;何涛等[10]以草鱼(Ctenopharyngodonidellus)病原菌维氏气单胞菌(A.veronii)为指示菌,通过滤纸片抑菌圈法筛选出1株解淀粉芽孢杆菌(B.amyloliquefaciens),对该病原菌有较好的拮抗效果。本试验拟从泥鳅池中分离泥鳅腐皮病病原菌,以此为指示菌分离筛选拮抗菌,以期为泥鳅腐皮病的防治及相关生物制剂的开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料
患病泥鳅、水样和泥样,采自连云港市赣榆区某水产养殖公司。
1.1.2 水产病原菌
温和气单胞菌、维氏气单胞菌、嗜水气单胞菌(A.hydrophila)、哈维弧菌、鳗弧菌、迟缓爱德华菌(E.tarda)(海水菌株)等为本实验室保存菌株。
1.1.3 主要试剂
Tryptone、Yeast Extract(Oxoid LTD),革兰氏染色液、细菌生化微量鉴定管(杭州微生物试剂有限公司),PCR所用试剂[宝生物工程(大连)有限公司],超氧化物歧化酶(SOD)测试盒、酸性磷酸酶(ACP)测试盒(南京建成生物工程研究所)。引物合成及测序由生工生物工程(上海)股份有限公司完成。
1.1.4 LB培养基
胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,琼脂20 g/L(液体培养基中不加),pH 7.4~7.6,121 ℃灭菌30 min。
1.1.5 主要仪器
PCR仪(5332,德国Eppendorf公司),凝胶成像系统(OGGE,Bio-Rad公司),紫外可见分光光度计(T6新世纪,北京普析通用仪器有限公司)。
1.2 方法
1.2.1 泥鳅腐皮病病原菌的分离
先用70%酒精棉球擦拭病灶部位表面,用无菌小刀切取病鳅约黄豆大小的病灶组织,用无菌剪刀剪碎,放入提前准备好的3 mL LB液体培养基中,28 ℃恒温摇床培养2 h,然后用无菌生理盐水10-1~10-6梯度稀释,将10-4、10-5和10-6三个梯度分别涂布于LB培养基上,28 ℃培养24 h后观察,将明显可见差异的单菌落挑出,通过三区划线接种到LB培养基上,并进行连续多次三区划线,直至得到纯培养物[11]。
1.2.2 病原菌的筛选及回归感染
将1.2.1分离的纯培养物分别接种至LB液体培养基,28 ℃培养24 h后,采用分光光度法测定600 nm吸光度(OD600),根据平板菌落计数结果计算各菌株的培养液密度[11]。
为提高感染率,用手术刀轻轻划伤健康泥鳅表皮组织(注意不要损伤肌肉组织),并迅速放入菌体密度为6×108cfu/mL的菌液中,浸泡15 min后,转入未添加任何药物的养殖水(3 kg/盒)中饲养[12]。观察发病情况,筛选可感染腐皮病的病原菌株。
为进一步确认病原菌株,从试验中被感染的泥鳅病灶处,按照1.2.1方法再次分离病原菌并回归感染健康泥鳅。每个菌株接种1组,每组设3个平行,每平行10尾泥鳅,以无菌LB培养基替代菌液为对照组。每个平行分别单独计时,保证每个平行的泥鳅感染时间一致。
自人工感染并发病的泥鳅病灶处,再次进行细菌分离,按照1.2.1的方法进行。通过菌落形态和显微镜观察,鉴定人工感染后分离的菌株与人工感染使用的菌株是否相同。
1.2.3 腐皮病拮抗菌的分离
采集连云港市赣榆区某水产养殖公司泥鳅养殖池水样和底泥,用无菌生理盐水按不同梯度稀释,然后涂布到LB培养基上,28 ℃培养24 h后,根据菌落颜色、形态、大小、边缘整齐度及透明度等特征的不同,用接种环挑取单菌落进行划线分离,直至得到纯培养物。分别挑取单菌落于LB液体培养基中,测定OD600,根据平板菌落计数结果计算各菌株的培养液密度,作为待测菌液。
1.2.4 拮抗菌的初筛和复筛
采用滤纸片抑菌圈法进行初筛[13]。接种病原菌于LB液体培养基中,28 ℃培养16 h。取10 μL培养液加入培养皿中,倒入冷却至约40 ℃的LB固体培养基(约20 mL),轻轻摇晃混匀。将直径为6 mm的无菌滤纸片置于培养皿中,再将20 μL待测菌液滴加于滤纸片上,28 ℃培养24 h后观察测定抑菌圈大小。将出现抑菌圈的菌株再次复筛,筛选出抑菌圈较大而且稳定出现的菌株进行后续试验(抑菌圈直径用平均值±标准差表示)。
1.2.5 拮抗菌X8的传代稳定性
按1.2.4方法进行操作。初代菌为分离纯化保存的菌株。将初代菌重新三区划线,挑取单菌落于LB液体培养基中,为二代菌。以此类推。以初代抑菌圈直径为100%,接种9代,分别做抑菌圈试验,观察并测量抑菌圈直径,试验重复3次。
1.2.6 病原菌和拮抗菌的菌株鉴定
1.2.6.1 形态特征观察
群体形态观察和个体形态观察如革兰氏染色、芽孢染色、荚膜染色、穿刺试验、细胞大小测定等均参照文献[14]进行。
1.2.6.2 生理生化试验
酪蛋白水解、明胶水解、淀粉水解和油脂水解等大分子水解试验参照文献[14]进行。微量生化管鉴定试验按杭州微生物试剂有限公司《细菌微量生化反应管说明书》操作和观察记载。
1.2.6.3 16S rRNA基因序列分析及系统发育树构建
本试验采用菌落PCR,从病原菌三区划线平板上挑取单菌落,加入1 mL的无菌水,混匀后煮沸5 min,5000 r/min离心3 min,取上清液作为PCR反应的模板。扩增引物为细菌16S rRNA基因序列通用引物27F和1492R。反应体系:50 U Taq酶0.5 μL,10×Buffer(含Mg2+)2.5 μL,10 mmol/L dNTP 2.5 μL,100 μmol/L引物各0.5 μL,模板1 μL,加ddH2O至25 μL。反应程序:预变性95 ℃ 5 min;变性95 ℃ 30 s,复性55 ℃ 30 s,延伸72 ℃ 90 s,变性—复性—延伸30个循环;再延伸72 ℃ 5 min。PCR产物送生工生物工程(上海)股份有限公司测序,在EZ.BioCloud网站查找模式菌株序列并下载,在Mega 6.06软件中比对序列并构建系统发育树。
1.2.7 拮抗菌X8对不同温度的适应性
以0.5%的接种量接种至LB液体培养基中,分别置于20、25、30、35、40 ℃摇床中,180 r/min培养36 h。分别取20 μL发酵液,滴加于无菌滤纸片上,再将滤纸片置于混有病原菌的LB培养基上,28 ℃培养24 h,观察测定抑菌圈大小。试验重复3次。
1.2.8 拮抗菌X8对不同盐度的适应性
以0.5%的接种量分别接种至盐度为0、10、20、30、40、50的LB液体培养基中,28 ℃培养24 h。按照1.2.7的方法进行操作。试验重复3次。
1.2.9 拮抗菌X8对泥鳅生理指标的影响
1.2.9.1 体长和体质量增加量的测定
将泥鳅分为试验组和对照组两组,每组设置3个平行,每个平行15尾泥鳅,平均体长(13.2±0.3) cm,体质量(10.1±0.2) g,置于直径20 cm、高10 cm的饲养盒中,每盒保持1 L的水量。每隔2 d换水1次。水温为(23±1) ℃。每日称取泥鳅体质量,按体质量的2%进行投食,早晚各1次。拮抗菌X8以0.5%的接种量接种至LB液体培养基中,30 ℃培养36 h,制成菌液,进行平板菌落计数,得到菌液密度。试验组加入1 mL菌液,使得水体中拮抗菌的密度达到105cfu/mL数量级。对照组加入1 mL无菌LB液体培养基。换水后,试验组和对照组重新添加菌液和无菌LB液体培养基。观察期为28 d,观察每组泥鳅的生长状况,测量各组总体长和总体质量(15尾合计),计算观察期内,总体长和总体质量的增加值,分析试验组和对照组的差异情况。
1.2.9.2 超氧化物歧化酶和酸性磷酸酶活性的测定
28 d观察期结束后,将各组泥鳅断尾取血,离心后取血清,-20 ℃保存。超氧化物歧化酶和酸性磷酸酶活性的测定均按照测试盒说明书进行。
采用SPSS 17.0软件对数据进行单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著。
1.2.10 拮抗菌X8对不同水产病原菌的拮抗作用
活化本实验室保存的几株水产致病性菌株:维氏气单胞菌、温和气单胞菌、嗜水气单胞菌、迟缓爱德华菌、哈维弧菌、鳗弧菌。采用滤纸片抑菌圈法(无菌LB液体培养基为对照),按照1.2.4进行操作。观察并测量抑菌圈大小。试验重复3次。
2 结果与分析
2.1 病原菌的分离
自患病泥鳅体表病灶处采样,共分离出25个纯培养物。编号分别是D1-1,D1-2-1,D1-2-2,…,D5-7,…,D7。
2.2 病原菌的筛选和回归感染
2.2.1 病原菌的筛选
将上述分离到的25个纯培养物,按方法1.2.2感染健康泥鳅,其中只有编号为D5-7的菌株可诱发泥鳅出现腐皮、烂身等典型的腐皮病症状,因此初步确定D5-7为病原菌株。
2.2.2 回归感染
为进一步证明菌株D5-7为泥鳅腐皮病的病原菌,再次自菌株D5-7引起发病的病灶部位取样,按1.2.2的方法进行分离和感染,同样出现了与自然患病相同的腐皮病特征(图1)。人工感染试验后,取发病泥鳅的病灶组织进行分离,确实分离到与D5-7形态特性一致的菌株,表明菌株D5-7为泥鳅腐皮病的病原菌。

图1 感染腐皮病的泥鳅
2.3 拮抗菌的分离
自泥鳅养殖池水和底泥采集的样品经过稀释涂布、三区划线,共分离出11株菌株,编号分别为L11、L12、L13、L14、L15、L17、L18、L19、L20、H25、X8。
2.4 拮抗菌的筛选
2.4.1 拮抗菌的初筛和复筛
按1.2.4方法进行操作,结果见图2a,菌株L11、X8、L18、H25出现抑菌圈,直径分别为(11.2±0.11) mm、(14.2±0.10) mm、(11.9±0.10) mm、(9.9±0.20) mm。将出现抑菌圈的菌株进行复筛,筛选出抑菌圈较大且稳定出现的菌株X8进行后续试验(图2b)。
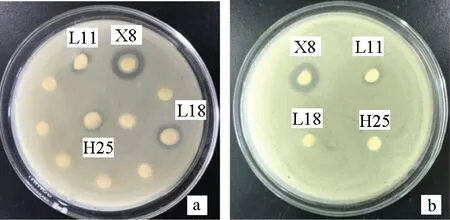
图2 拮抗菌的初筛(a)和拮抗菌的复筛(b)
2.4.2 拮抗菌的传代稳定性
按1.2.4方法进行操作。以初代抑菌圈直径为100%,接种9代,抑菌圈直径分别为初代的105%、109%、106%、96%、95%、94%、107%、111%、110%,证明X8的抑菌活性能够稳定传代。
2.5 病原菌和拮抗菌的菌株鉴定
2.5.1 形态特征观察
在LB平板上将病原菌D5-7三区划线,28 ℃培养24 h后观察。菌株D5-7菌落呈淡黄色,圆形,中央鼓起,边缘整齐,光滑,半透明或接近不透明;革兰氏染色后菌体呈红色(图3),可以判断菌株D5-7为革兰氏阴性细菌。显微观察其大小为(1.43±0.19) μm×(0.7±0.08) μm;无芽孢,无荚膜。穿刺试验结果表明,菌株D5-7无运动性。
在LB平板上将拮抗菌X8三区划线,28 ℃培养24 h后观察。菌株X8菌落呈淡黄色,多边形,边缘不整齐,表面干燥不平滑,不透明;革兰氏染色呈紫色(图4),可以判断菌株X8为革兰氏阳性细菌。显微观察其大小为(2.99±0.28) μm×(1.17±0.17) μm;有芽孢,无荚膜。穿刺试验结果表明菌株X8无运动性。

图3 菌株D5-7的菌落形态(a)和革兰氏染色结果(b)
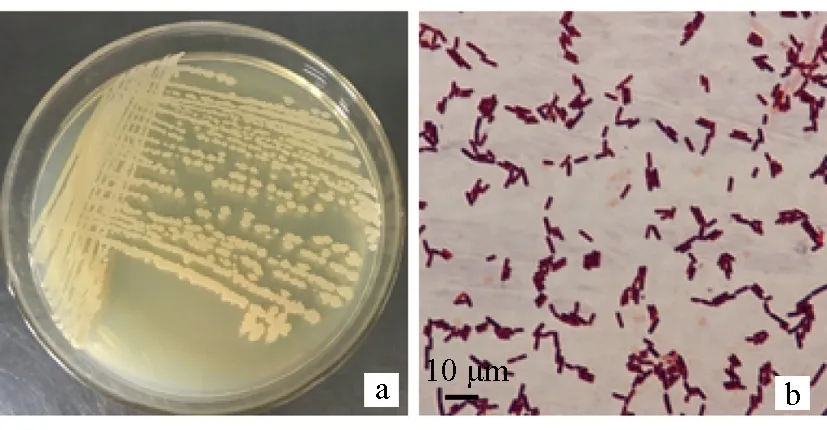
图4 菌株X8的菌落形态(a)和革兰氏染色结果(b)
2.5.2 生理生化试验
2.5.2.1 大分子水解试验
以短小芽孢杆菌(B.pumilus)E14[15]为对照进行观察,结果显示,病原菌D5-7具有降解酪蛋白、明胶等蛋白质的能力,但不能降解淀粉和油脂(图5)。拮抗菌X8具有水解淀粉和明胶的能力,不能水解酪蛋白、油脂(图6)。

图5 病原菌D5-7的蛋白水解试验
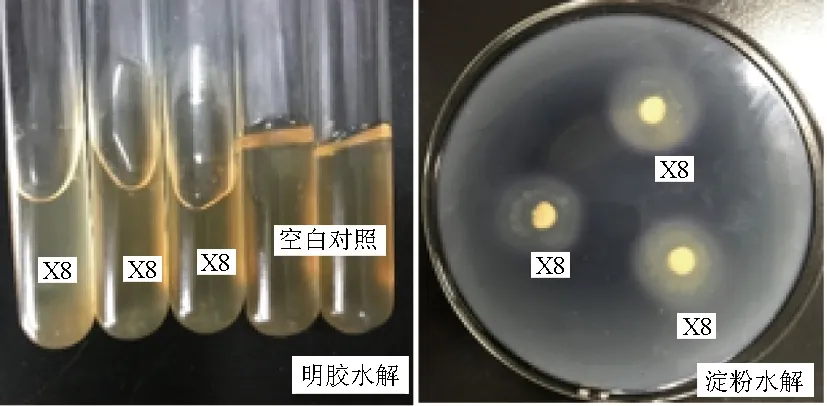
图6 拮抗菌X8的淀粉和明胶水解试验
2.5.2.2 菌株D5-7和菌株X8的生理生化反应
菌株D5-7和菌株X8的生理生化反应见表1和表2。菌株D5-7能够利用葡萄糖、蔗糖、甘露糖、阿拉伯糖等,不能利用丙二酸盐、鼠李糖、阿拉伯醇、蜜二糖等。菌株X8能够利用纤维二糖、葡萄糖、氰化钾、丙二酸盐等,不能利用果糖、乳糖、半乳糖、甘露醇等。
2.5.3 16S rRNA序列分析及系统发育树构建
扩增菌株D5-7和X8的16S rRNA基因,16S rRNA基因片段大小约为1500 bp。将PCR产物送生工生物工程(上海)股份有限公司测序。
利用EZ.BioCloud网站查找模式菌株序列并下载,用Mega 6.06软件采用临接法(重复数为1000,步长值取百分比)分别构建菌株D5-7和X8的系统发育进化树(图7、图8)。
由图7可知,病原菌D5-7与杀鲑气单胞菌杀鲑亚种(Aeromonadssalmonicidassp.salmonicida) ATCC 33658遗传距离最近,同源性为98%。综合菌落和细胞形态观察、生理生化试验及16S rRNA基因序列分析,将病原菌D5-7鉴定为气单胞菌属杀鲑气单胞菌杀鲑亚种。
由图8可知,拮抗菌X8与解淀粉芽孢杆菌(B.amyloliquefaciens)D15遗传距离最近,同源性为98%。综合菌落和细胞形态观察、生理生化试验及16S rRNA基因序列分析,将拮抗菌X8鉴定为解淀粉芽孢杆菌。

表1 病原菌D5-7微量生化管反应结果

表2 拮抗菌X8微量生化管反应结果

图7 基于16S rRNA基因序列构建的菌株D5-7(LC312129)的系统发育树
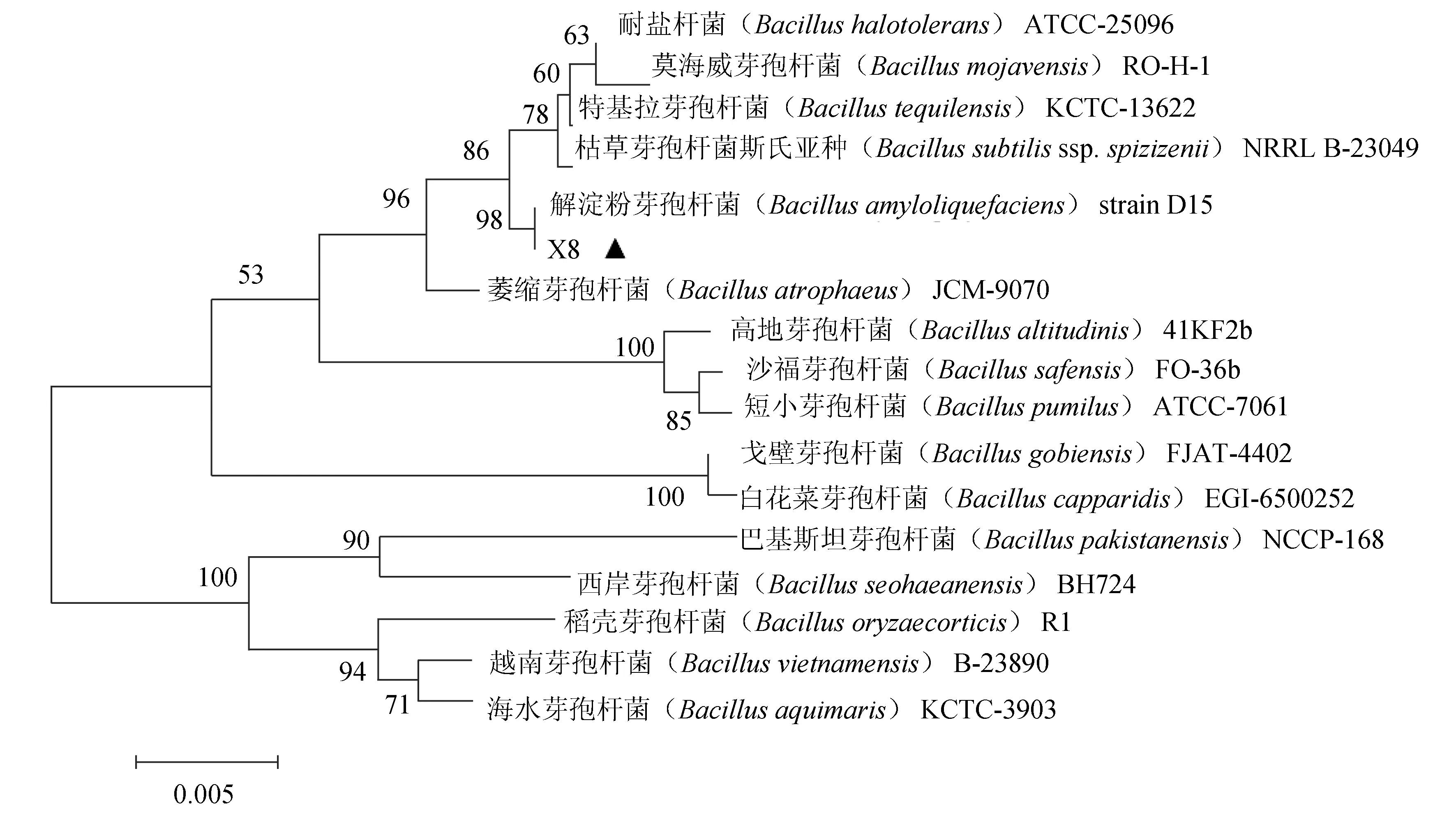
图8 基于16S rRNA基因序列构建的菌株X8(MH128163)的系统发育树
2.6 解淀粉芽孢杆菌X8对不同温度的适应性
解淀粉芽孢杆菌X8在20~40 ℃之间具有抑菌活性(图9)。在30 ℃时,抑菌活性达到最高,抑菌圈直径达(16.6±0.35) mm。

图9 不同温度对解淀粉芽孢杆菌X8拮抗活性的影响柱形图上方不同小写字母表示差异显著(P<0.05).下同.
2.7 解淀粉芽孢杆菌X8对不同盐度的适应性
解淀粉芽孢杆菌X8在盐度0~50之间具有抑菌活性(图10)。在盐度为0时,抑菌活性最高,抑菌圈直径达(21.7±0.18) mm。随着盐度的上升抑菌活性逐渐降低,在盐度为50时,抑菌活性最低,抑菌圈直径仅为(10.1±0.37) mm。说明解淀粉芽孢杆菌X8在盐度0~50内具有较好的适应性。
2.8 解淀粉芽孢杆菌X8对泥鳅生理指标的影响
观察期间,试验组与对照组泥鳅全部存活(表3)。体长(cm)和体质量(g)为试验前后增加的数值。试验组泥鳅的体长和体质量的增加值明显大于对照组,差异达到极显著水平(P<0.01),推测原因,可能是解淀粉芽孢杆菌X8抑制了水体中病原菌的生长,改善了生长环境,促进了泥鳅的健康生长。

图10 不同盐度对解淀粉芽孢杆菌X8拮抗活性的影响
超氧化物歧化酶和酸性磷酸酶是鱼类重要的两个免疫指标。试验组与对照组泥鳅血清中超氧化物歧化酶活性有所差别,但未达显著水平(P>0.05)。试验组泥鳅血清中的酸性磷酸酶活性极显著高于对照组(P<0.01)。酸性磷酸酶作为体内巨噬细胞溶酶体的标志酶,在体内直接参与磷酸基团的转移和代谢,主要存在于各脏器、血细胞和骨髓中[16]。本试验中试验组酸性磷酸酶的增高,说明解淀粉芽孢杆菌X8可提高泥鳅的免疫力。
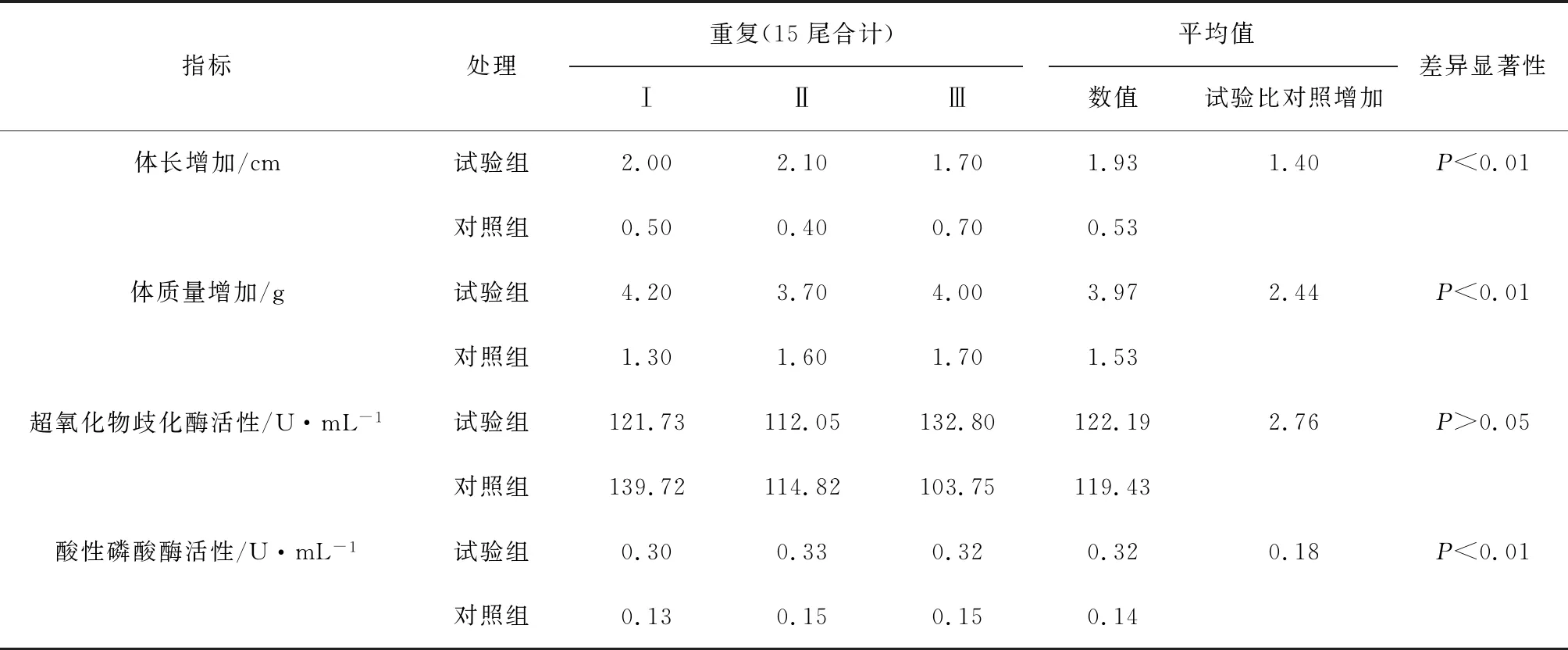
表3 解淀粉芽孢杆菌X8对泥鳅生理指标的影响
2.9 解淀粉芽孢杆菌X8的拮抗谱
解淀粉芽孢杆菌X8对维氏气单胞菌、温和气单胞菌、嗜水气单胞菌、杀鲑气单胞菌、迟缓爱德华菌、哈维弧菌、鳗弧菌有拮抗性(图11),抑菌圈直径分别达(14.7±0.10) mm、(16.8±0.15) mm、(11.3±0.20) mm、(15.9±0.15) mm、(8.2±0.05) mm、(11.8±0.10) mm、(8.2±0.08) mm。
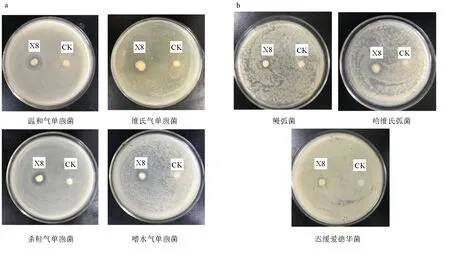
图11 解淀粉芽孢杆菌X8对不同病原菌的抑制作用a.气单胞菌,b.海水菌. CK为对照.
3 讨 论
3.1 腐皮病病原菌的研究
诱发腐皮病的细菌性病原有嗜水气单胞菌、温和气单胞菌、维氏气单胞菌和点状产气单胞菌点状亚种(A.punctatassp.punctata)等[3,17-18]。泥鳅腐皮病传染性强、潜伏期长、发病率较高且危害大,给养殖业带来巨大的经济损失[19-20]。目前,关于泥鳅腐皮病病原菌,仅见萧克宇等[3]报道的温和气单胞菌。本研究分离的杀鲑气单胞菌也可诱发泥鳅腐皮病,目前尚未见报道。
杀鲑气单胞菌属气单胞菌科、气单胞菌属,是一种引起鲑科鱼类发生疖疮病即腐皮病的典型细菌性病原[21]。1894年,Emmerich等[22]首次自患病溪鳟(Salvelinusfontinalis)中分离出该菌。其广泛分布于淡水河流、湖泊、池塘等多种水环境,除美国南部地区以外,世界各地均有发现。近年来,被杀鲑气单胞菌感染的水产动物有半滑舌鳎(Cynoglossussemilaevis)[23]、异育银鲫(Carassiusauratusgibelio)[24]、大西洋鲑(Salmosalar)[25]、细鳞鱼(Brachymystaxlenok)[26]、大菱鲆(Scophthalmusmaximus)[27]、仿刺参(Apostichopusjaponicus)[28]、石鲽(Kareiusbicoloratus)[29]等,临床症状表现为食欲减退,伴有出血性红点,严重者体表形成脓肿或溃疡。本试验患病泥鳅除了上述病症外,还出现鳞片脱落和脏器外露等症状。杀鲑气单胞菌感染泥鳅的研究,扩大了对杀鲑气单胞菌可感染水生生物种类的认知范围。
3.2 腐皮病的诱发因素
诱发泥鳅腐皮病的主要因素有两种:一是划伤,二是温度。当泥鳅养殖池淤泥过多、池塘水质不良、施用未经充分发酵的粪肥,或在捕捞、运输过程中操作不慎引起鳅体受伤,导致泥鳅体表黏膜脱落或损伤,即可引起病原菌大量滋生。病原菌自泥鳅的受伤皮肤入侵,感染发病[18,30]。另外泥鳅腐皮病也为季节性发作病害,据初步观察,江苏连云港养殖泥鳅的发病时间通常为初春和秋末(即4—5月和9—10月),此时养殖池水温通常为22~27 ℃,当气温高于30 ℃时,病情自然减弱直至消失。由此推测,大鳞副泥鳅腐皮病的发生与温度密切相关,鳗鲡[31]的研究也有类似的情况。本试验筛选出的拮抗菌X8的适应温度为20~40 ℃,在生产上有一定的应用价值。
3.3 拮抗菌X8为一种多功能菌株
近年来,以拮抗菌为代表的生物防治方法,具有环境友好、绿色安全等特点,已受到越来越多的关注,不仅可以有效防治病害发生,还有助于改善水质,减少环境污染[32]。目前,国内外应用拮抗菌防治水产病害的报道较多,用来防治杀鲑气单胞菌的研究也有报道[33-34],但使用拮抗菌防治泥鳅腐皮病的研究尚未见报道。笔者以杀鲑气单胞菌D5-7为指示菌,自大鳞副泥鳅养殖池水样中筛选并鉴定出1株拮抗菌——解淀粉芽孢杆菌X8,其抑菌圈直径达(14.2±0.10) mm。该菌株的获得,进一步丰富了防治水产病害的拮抗菌资源。
有研究表明,解淀粉芽孢杆菌是重要的生防细菌,抑菌活性非常广泛[35-36]。张雪等[37]研究表明,牛瘤胃源解淀粉芽孢杆菌对大肠杆菌、副溶血弧菌、藤黄八叠球菌(Sarcinalutea)和产气杆菌(E.aerogenes)等细菌以及黑曲霉(Aspergillusniger)、黑根霉(Rhizopusnigricans)等霉菌均具有抑制作用。孙梅等[38]筛选出的解淀粉芽孢杆菌JSSW-LA,对多种水产病原菌如嗜水气单胞菌、维氏气单胞菌、温和气单胞菌、豚鼠气单胞菌(A.caviae)均具有一定的抑制作用,其中对温和气单胞菌和豚鼠气单胞菌的抑制效果显著。本研究分离的拮抗菌解淀粉芽孢杆菌X8不仅对引起腐皮病的杀鲑气单胞菌具有较强的抑制作用,对其他水产病原菌如维氏气单胞菌、嗜水气单胞菌、温和气单胞菌、迟缓爱德华菌、哈维弧菌、鳗弧菌等也有一定的拮抗作用。哈维弧菌、迟缓爱德华菌、鳗弧菌感染一般发生在盐度为10~30的海水环境[39],解淀粉芽孢杆菌X8在盐度40以下均对其有一定的抑菌活性。这与田良[40]的研究结果一致。另外,解淀粉芽孢杆菌被认为是一种安全性较高的菌种,有望开发为水产养殖专用微生物制剂[41]。
解淀粉芽孢杆菌X8不仅对上述水产病害具有抑制作用,而且对泥鳅生长具有良好的促进作用。本试验结果表明,试验组比对照组体长增加1.40 cm,体质量增加2.44 g,酸性磷酸酶提高0.18 U/mL,三者均达到差异极显著水平(P<0.01)。因此该菌株在生产养殖中具有广阔的应用前景。

