养殖密度对吉富罗非鱼幼鱼生长、免疫功能的影响
左 腾,黄 凯,汪 婷,刘 婷,宿志健,孙琳琳,莫飞杰,陈显友
( 广西大学 动物科学技术学院,广西 南宁 530004 )
高密度养殖已成为一种提高生产力和经济效益的有效方式[1],同时会增大养殖鱼类对空间和饵料的竞争,也伴随着大量排泄物的产生,从而对水产养殖鱼体生长和养殖水体环境产生影响。一方面,高密度养殖作为一种慢性应激,会对养殖鱼体的生长、肌肉营养组成、免疫能力、血液学指标以及基因表达产生影响[2-4];另一方面,养殖密度与水环境因子之间是相互联系和制约的关系[5],高密度养殖会产生较多的粪便,使养殖水体中的氨氮、亚硝酸盐氮、硝态氮、磷酸盐含量增高,增大细菌种群数及其生产力,从而产生大量营养负荷的养殖环境,最终抑制鱼类生长[6-8]。因此,探索合理的养殖密度,在保障最大的生态效益的同时,获得最高的经济效益,是目前整个水产养殖行业所关注的焦点。
吉富罗非鱼(OreochromisniloticusGIFT)为遗传性状改良后的尼罗罗非鱼[9]。目前,国内外关于养殖密度对吉富罗非鱼肌肉脂肪酸含量、抗氧化能力、脂类代谢相关酶mRNA水平等指标的影响已有研究[5,10]。为此,笔者开展了养殖密度对吉富罗非鱼幼鱼生长、免疫功能、肌肉营养成分和生理生化指标影响的研究,旨在为吉富罗非鱼高产、安全、健康的集约化养殖提供科学依据。
1 材料与方法
1.1 试验材料
试验鱼于2015年6月购自广西水产研究院当年春季同一批次孵化的吉富罗非鱼鱼苗,养殖试验在广西大学水产养殖试验教学基地的水泥池中进行。试验前挑选健康无病、规格一致的罗非鱼,暂养于5.0 m×1.0 m×1.0 m的水泥池中,投喂试验饲料驯养。试验饲料采购于南宁市海宝路水产饲料有限公司,粗蛋白为33.4%、粗脂肪为6.3%、粗纤维为6.9%、粗灰分为11.2%。暂养2周后挑选规格一致的罗非鱼[初始体质量(1.05±0.12) g、初始体长(3.97±0.05) cm]随机分配至1.7 m×1.0 m×0.6 m的水泥池中。根据文献[11]以及基地试验基本条件,试验共设置6个养殖密度梯度(45、54、63、72、81尾/m3和90尾/m3),每组设3个平行组。在90 d养殖过程中,日投喂2次(8:00,16:00),前45 d每次投喂量为鱼体质量的4%,随残饵量逐渐增大,后45 d每次投喂量改为鱼体质量的3%,每次投喂20 min后打捞残饵,并记录残饵量。每日8:00吸污并换水1/3。饲养期间水温27~29 ℃,pH 8.0~8.2, 持续无间断增氧,溶解氧3.0~5.0 mg/L。
1.2 样品采集、测定
试验开始前和结束后分别称量并记录初始体质量、终末体质量、初始体长和终末体长,计算体长增长率、体质量增加率、特定生长率和肥满度。试验结束后统计每组试验鱼死亡数以及投喂的饲料量,计算存活率和饲料系数。养殖试验结束24 h后,各组随机捕捞15尾试验鱼,尾部静脉采集血液于医用真空采血管保存,部分用于血液学分析,其余血液4 ℃、3000 r/min离心10 min,取上清液于-80 ℃保存,用7600-120型全自动生化分析仪测定血液指标;将采血后的鱼体解剖并分离肝脏、脾脏和肌肉,计算肝脏系数和脾脏系数,并用105 ℃恒温烘干湿质量法测定肌肉水分(GB/T 9695.15—2008),用凯氏定氮法测定肌肉粗蛋白(GB/T 5511—2008),用索氏抽提法测定肌肉粗脂肪(GB/T 14772—2008),用马福炉550 ℃灼烧恒定质量法测定肌肉粗灰分(GB/T 6438—2007)。
1.3 分析统计
试验数据采用平均值±标准差表示,用SPSS 20.0统计软件中单因子方差分析和Duncan多重比较对试验结果差异显著性进行分析,并用Origin 9.0软件作图,P<0.05表示差异显著。
特定生长率/%·d=(lnmt-lnm0)/t×100%
肥满度=mt/Lt3×100
存活率/%=(n0-n1)/n0×100%
饲料系数=m/(mt-m0)
体长增长率/%=(Lt-L0)/L0×100%
体质量增加率/%=(mt-m0)/m0×100%
肝脏系数/%=ml/mt×100%
脾脏系数/%=ms/mt×100%
白球比=Ca/Cg
式中,m0为试验鱼初始体质量(g),mt为试验鱼终末体质量(g),ml为试验鱼终末肝脏质量(g),ms为试验鱼终末脾脏质量(g),t为试验时间(d),Lt为试验鱼终末体长,L0为试验鱼初始体长,n0为试验开始时试验鱼总数,n1为试验鱼死亡数,m为试验饲料摄入量(g),Ca为血液中白蛋白质量浓度(g/L);Cg为血液中球蛋白质量浓度(g/L)。
2 结果与分析
2.1 养殖密度对吉富罗非鱼幼鱼生长性能的影响
在90 d的养殖试验后,各组间饲料系数和肥满度无显著差异(P>0.05),吉富罗非鱼终末体质量和终末体长随养殖密度增大而显著降低(P<0.05)(表1)。随着养殖密度的增加,吉富罗非鱼幼鱼体质量增加率、体长增长率、特定生长率以及存活率呈降低趋势,各组差异显著(P<0.05)(图1)。其中45尾/m3和54尾/m3试验组,体质量增加率和特定生长率差异不显著(P>0.05),但显著高于90尾/m3试验组(P<0.05);体质量增加率,45尾/m3试验组显著高于其他各组(P<0.05),90尾/m3试验组最低(P<0.05),但54尾/m3和63尾/m3试验组差异不显著(P>0.05); 45尾/m3、54尾/m3和63尾/m3试验组体长增长率无显著差异(P>0.05),但显著高于90 尾/m3试验组(P<0.05);存活率随养殖密度增加显著降低(P<0.05),其中45尾/m3、54尾/m3和63尾/m3试验组间无显著差异(P>0.05),但最低组(90尾/m3)与81尾/m3试验组差异不显著(P>0.05)。
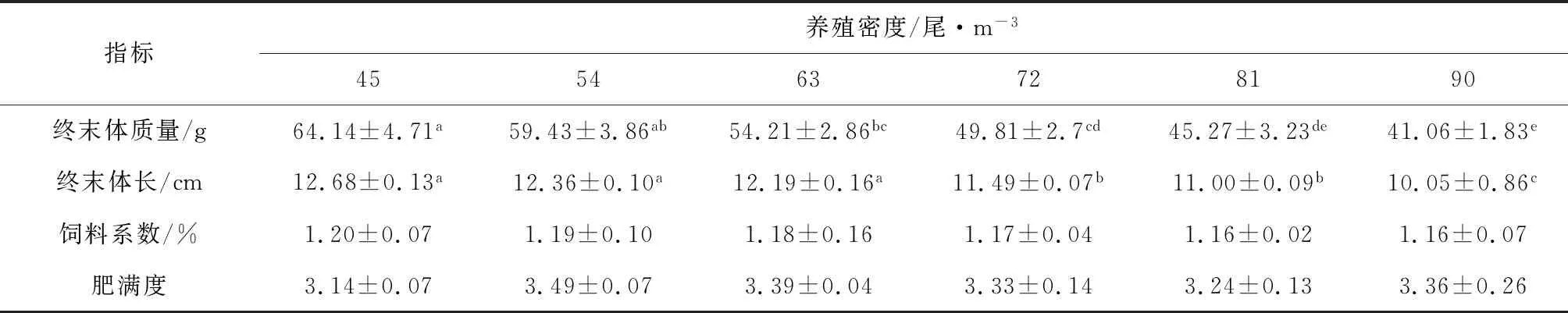
表1 养殖密度对罗非鱼生长指标的影响
注:表格中同行相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),下同.
2.2 养殖密度对吉富罗非鱼幼鱼体成分的影响
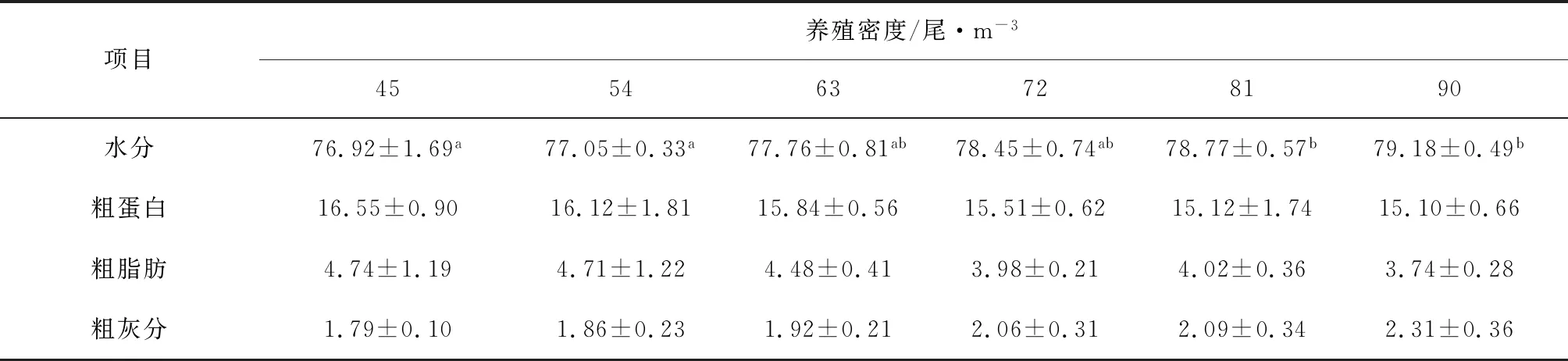
各密度组吉富罗非鱼幼鱼肌肉水分含量存在差异,随着养殖密度的增大呈上升趋势(P<0.05),其中90尾/m3试验组最高,但63尾/m3、72尾/m3、81尾/m3试验组和90尾/m3试验间无显著差异(P>0.05);随着养殖密度增大,肌肉粗蛋白、粗脂肪和粗灰分无显著差异(P>0.05),但90尾/m3试验组蛋白和脂肪含量最低以及灰分含量最高(表2)。
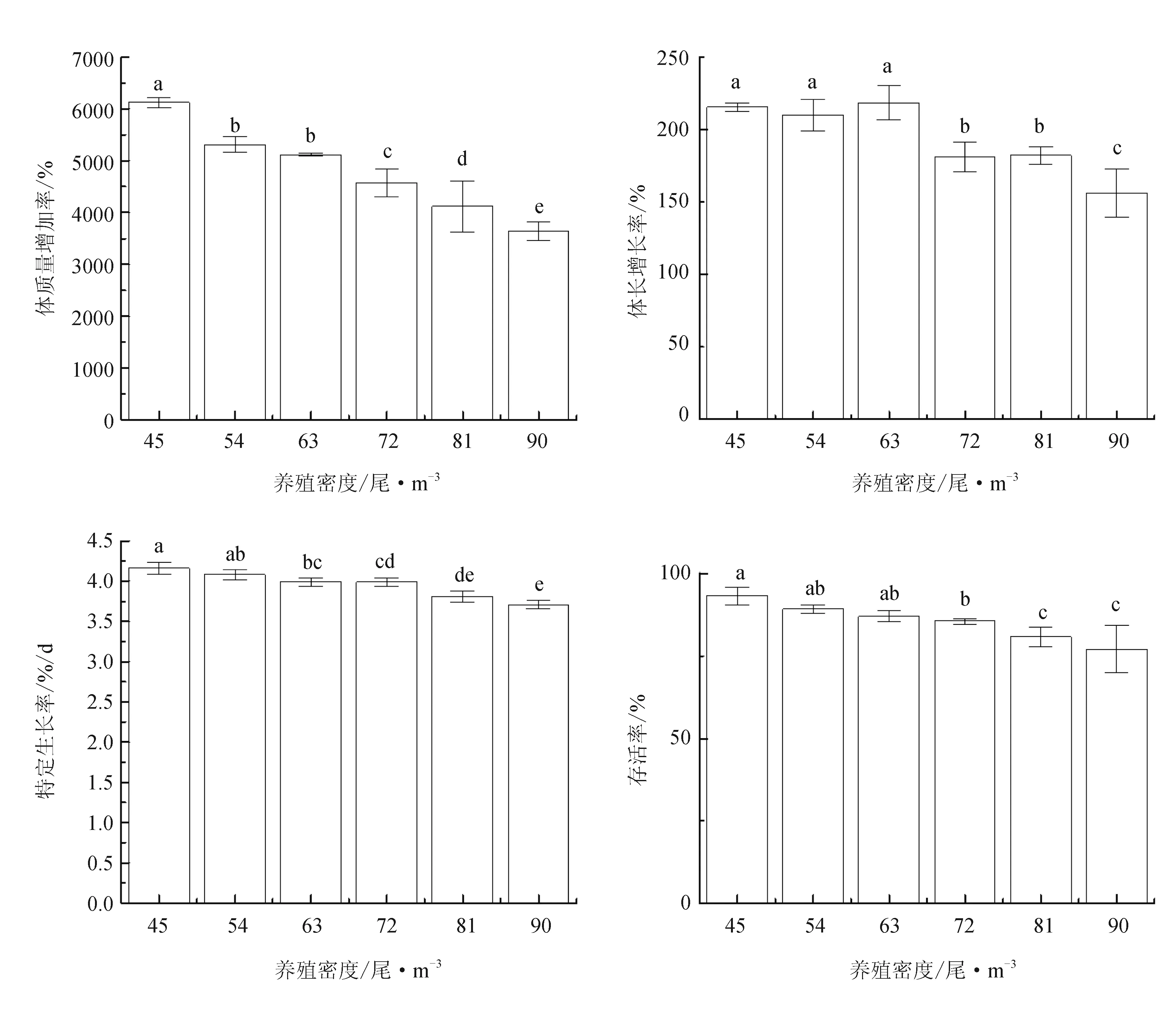
图1 不同养殖密度对罗非鱼幼鱼生长指标的影响相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05).下同.
%
2.3 养殖密度对吉富罗非鱼幼鱼免疫指标的影响
吉富罗非鱼幼鱼肝脏系数和脾脏系数随着养殖密度的增大呈下降趋势,但差异不显著(P>0.05);90尾/m3试验组白球比最低(P<0.05),其中45尾/m3、54尾/m3和63尾/m3试验组间差异不显著(P>0.05)(表3)。血液中红细胞数、白细胞数以及淋巴细胞数随养殖密度增大而增多(P<0.05)(图2)。其中45尾/m3、54尾/m3和63尾/m3试验组红细胞数无显著差异(P>0.05),90尾/m3试验组红细胞数和白细胞数显著高于其他各组(P<0.05);养殖密度大于54尾/m3时,淋巴细胞数显著增多(P<0.05),但72尾/m3、81尾/m3试验组和90尾/m3试验组差异不显著(P>0.05)。白蛋白和球蛋白随养殖密度增大呈下降趋势(P<0.05),其中45尾/m3试验组含量最高,45尾/m3和54尾/m3试验组吉富罗非鱼白蛋白含量差异不显著(P>0.05)(图3)。
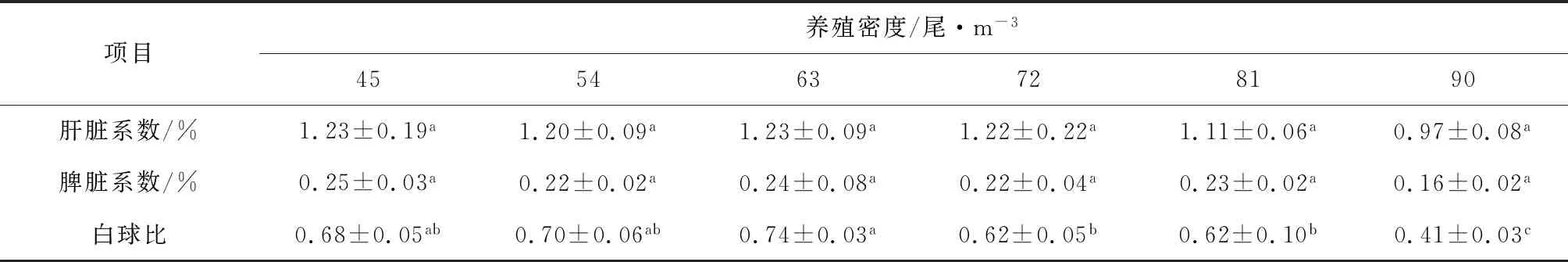
表3 养殖密度对罗非鱼幼鱼肝脏系数、脾脏系数以及白球比的影响

图2 养殖密度对罗非鱼幼鱼血液免疫细胞数的影响
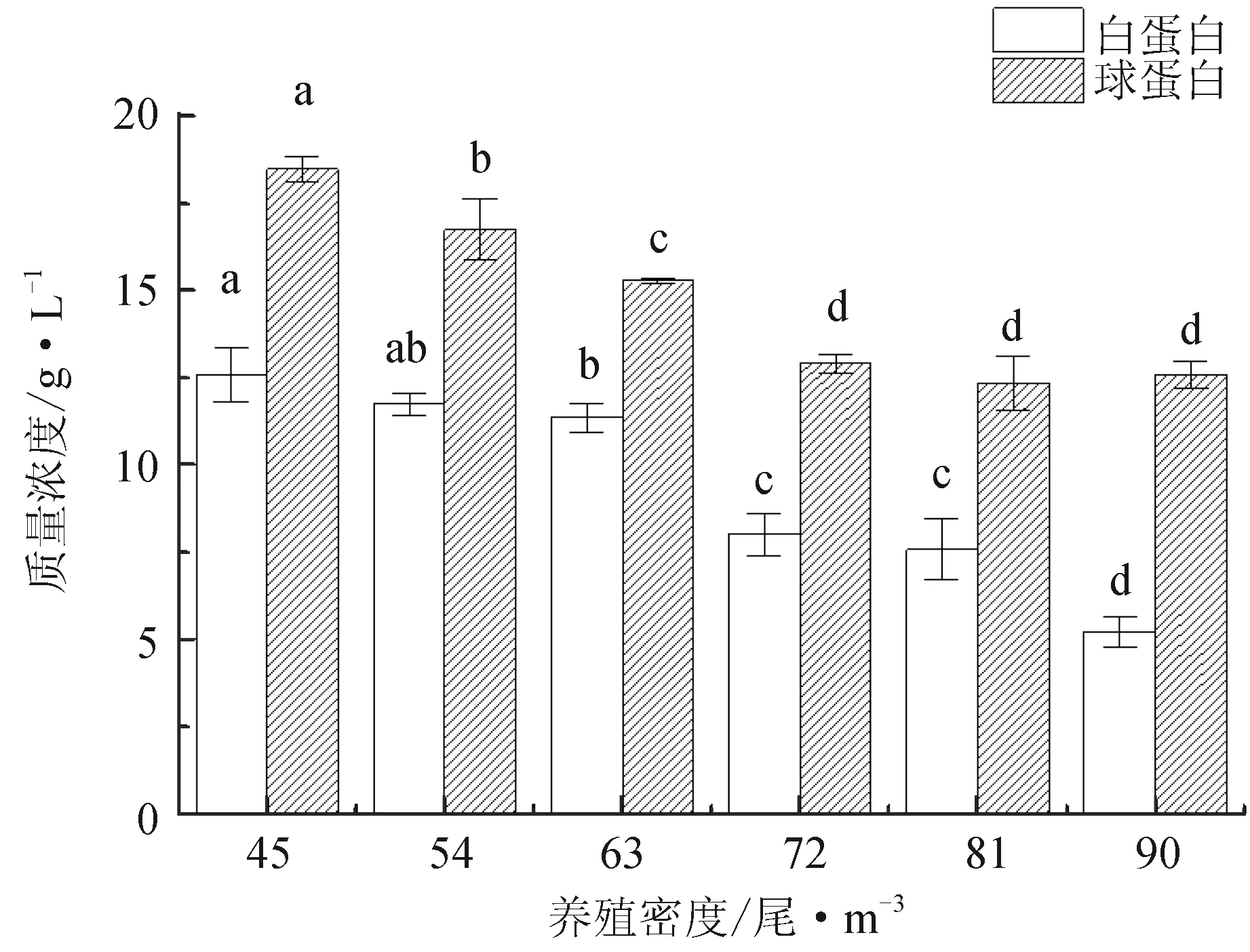
图3 养殖密度对血液白蛋白和球蛋白质量浓度的影响
2.4 养殖密度对吉富罗非鱼幼鱼血液生理生化指标的影响
吉富罗非鱼幼鱼总蛋白质量浓度随着养殖密度增大而降低,45尾/m3、54尾/m3试验组无显著差异(P>0.05),但显著高于其他各组(P<0.05)。随养殖密度的增大,吉富罗非鱼幼鱼血红蛋白质量浓度呈上升趋势,90尾/m3试验组显著高于各试验组(P<0.05)(表4)。谷丙转氨酶含量随罗非鱼养殖密度变化显著(P<0.05),90尾/m3试验组显著高于其他各组(P<0.05)。45尾/m3、54尾/m3和63尾/m3试验组碱性磷酸酶活性差异不显著(P>0.05),均显著高于其他试验组(P<0.05),整体呈降低趋势。本试验中,血液谷草转氨酶、尿素氮、血糖和游离三碘甲状腺原氨酸变化不显著(P>0.05)。90尾/m3试验组血液游离甲状腺素浓度最低(P<0.05),其他各试验组无显著差异(P>0.05)。
3 讨 论
3.1 养殖密度对吉富罗非鱼幼鱼生长性能的影响
有研究表明,高密度养殖会提高总产量,但是会限制养殖鱼类生长,降低个体的平均质量[12],在高密度条件下,养殖鱼类的生长速率较低密度呈负增长[6]。对施氏鲟(Acipenserschrenckii)[3]、黑边双锯鱼(Amphiprionpercula)[13]和舌齿鲈(Dicentrarchuslabrax)[6]的研究结果也证明高养殖密度不利于鱼类生长。也有学者研究发现,大西洋鲟(A.oxyrinchus)[14]和革胡子鲇(Clariasgariepinus)[15]终末体质量和特定生长率随养殖密度的增加而显著上升(P<0.05)。但Celikkale等[16]对俄罗斯鲟(A.gueldenstaedtii)的研究结果表明,其生长几乎不受养殖密度的影响。笔者认为,当养殖密度较低时,适当提高密度对鱼类生长有一定的促进作用, 但超过临界养殖密度则不利于养殖鱼类的生长[17]。在本研究中,吉富罗非鱼幼鱼终末体长和终末体质量与养殖密度呈负相关,体长增长率、体质量增加率、存活率以及特定生长率均随养殖密度的增大而显著降低(P<0.05),其原因可能是在较低密度下“集群互利性”促进其生长[18],高密度下鱼类对养殖空间以及营养产生的竞争加剧,使“生理、环境和行为福利”降低而导致鱼类生长受到抑制。
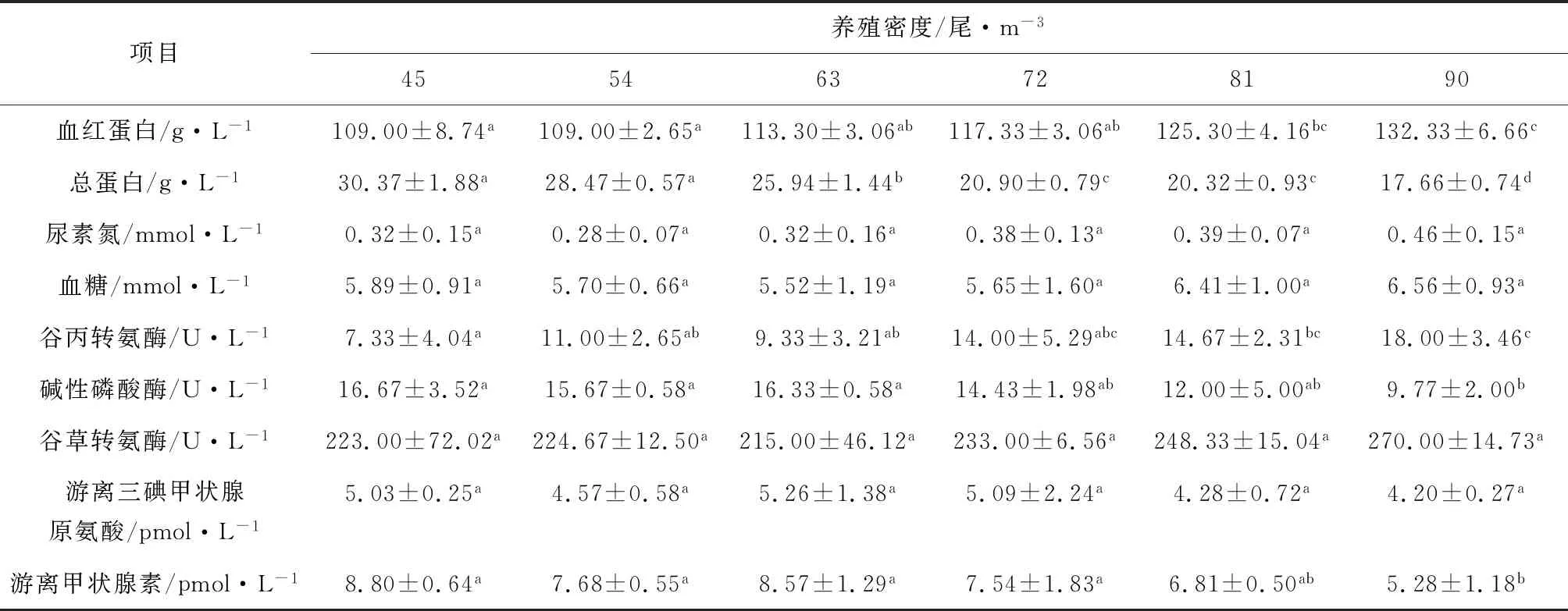
表4 养殖密度对罗非鱼血液生化指标的影响
3.2 养殖密度对吉富罗非鱼幼鱼体成分的影响

3.3 养殖密度对吉富罗非鱼幼鱼免疫功能的影响
肝脏和脾脏分别是白蛋白和免疫球蛋白主要产生器官,是鱼类重要免疫器官。免疫器官指数反映了免疫器官发育程度,一般来说免疫器官发育越完善,指数越大,机体免疫能力越强[25]。曹阳等[26]对俄罗斯鲟的研究发现,肝脏系数随养殖密度呈负相关,低密度组(0.8 kg/m3)和中密度组(1.6 kg/m3)免疫性能较高密度组(3.2 kg/m3)更优。对施氏鲟[19]和虹鳟[27]的研究也发现,肝脏系数和脾脏系数与养殖密度呈反比。本试验中,肝脏系数和脾脏系数随养殖密度的增大而降低(P>0.05);血液中白蛋白和球蛋白含量较低密度组(45尾/m3)显著降低(P<0.05)。所以,高密度养殖可能会对罗非鱼肝脏、脾脏的发育以及免疫能力有一定的影响。
血液中包含许多免疫因子,其中红细胞、白细胞、淋巴细胞、白蛋白以及球蛋白是鱼类细胞免疫和体液免疫的重要组成部分。Aketch等[1]研究发现,高密度养殖可使尼罗罗非鱼红细胞数升高。舌齿鲈[28-29]和杂交鳢(Channamaculata×C.argus)[30]的研究结果表明,红细胞数随养殖密度增大而显著增多(P<0.05)。本试验中,90尾/m3试验组红细胞数显著高于其他各组(P<0.05);白细胞数随养殖密度增大而增多,90尾/m3试验组最高(P<0.05);养殖密度大于54尾/m3时淋巴细胞数显著上升(P<0.05)。这可能是鱼体在受到外界胁迫后,激活机体免疫防御体系,通过维持机体平衡来克服胁迫的保护效应。结合肝脏系数、脾脏系数、白蛋白和球蛋白随养殖密度的变化情况可知,在持续的高密度胁迫下,鱼体免疫机能可能受到抑制,从而使免疫能力降低[31]。
3.4 养殖密度对吉富罗非鱼幼鱼血液生理生化指标的影响
血液指标是评价动物健康状态的重要指标,会因养殖鱼种类、饲料原料以及养殖环境的不同而异。本试验表明,随养殖密度增大,吉富罗非鱼幼鱼血红细胞数和血红蛋白呈上升趋势,这与舌齿鲈[29]、杂交鳢[30]和尼罗罗非鱼[1]的研究结果相似。试验采用连续增氧、定期换水的养殖模式,排除了养殖水环境对鱼体的影响,在养殖过程中发现高密度组(81尾/m3和90尾/m3)溶解氧含量较低,这可能是高密度胁迫下鱼体耗氧率增大[17],从而增加了红细胞分化和血红蛋白表达,增强血液总携氧能力。但也有学者认为,低密度养殖会引起鱼类葡萄糖转运蛋白基因上调,增强血红蛋白在细胞间的运动,但高养殖密度下鱼类需要更多的能量来应对胁迫,从而导致血红蛋白减少[10]。
血清总蛋白是临床上分析肝脏、肾脏疾病以及营养状况的重要指标,尿素氮是蛋白质代谢的终末产物,血液中尿素氮含量在一定程度上反映了动物蛋白质代谢状况,也是蛋白质沉积的重要指标。本研究发现,血清总蛋白随养殖密度增大而显著下降,尿素氮含量随养殖密度增大而上升。这可能是鱼体在高密度养殖下会产生较高能耗,使血清蛋白分解代谢增强[19,23]。本试验中90尾/m3试验组肌肉蛋白含量最低,这与血清总蛋白和尿素氮指标吻合,进一步说明了高密度养殖不利于吉富罗非鱼蛋白质的沉积。Aketch等[1]对尼罗罗非鱼的研究发现,血糖随养殖密度增大呈上升趋势,在虹鳟[27]和金头鲷(Sparusauratus)[32]的研究中也得到证明。但Qiang等[10]发现,罗非鱼在高密度组得到最低的血糖水平。也有研究表明,高密度对某些鱼类的血糖几乎没有影响[33]。本研究结果表明,养殖密度对血糖无显著影响,结合血液总蛋白和尿素氮的变化规律,分析原因可能为,高密度胁迫会促进血清总蛋白分解和脂肪代谢,加强糖异生作用,以维持高密度下机体的能耗[2,19,21,23-24]。
血液转氨酶是临床上诊断肝脏功能的重要指标,谷丙转氨酶主要存在于肝细胞浆中,谷草转氨酶主要存在于线粒体中,前者在肝细胞损伤时会首先进入血液,当肝细胞严重损伤、危及线粒体时,后者也会进入血液。对黄姑鱼(Nibeaalbiflora)的研究发现[2],4.84 kg/m3和5.81 kg/m3两组试验鱼谷丙转氨酶显著高于其他组(P<0.05),5.81 kg/m3组谷草转氨酶活性最高(P<0.05)。本试验中,吉富罗非鱼幼鱼血液中谷丙转氨酶活性随养殖密度增大而显著上升(P<0.05),谷草转氨酶呈上升趋势,但各组间差异不显著,90尾/m3试验组酶活性最高。碱性磷酸酶参与水生动物钙化和膜转运。研究发现,成骨细胞活性增加、胆汁淤积或慢性病都会引起血液中碱性磷酸酶的降低[10]。Rebl等[34]认为,在高密度养殖下虹鳟肝脏细胞受到胁迫,会导致mTOR和PI3K/AKT信号通路受损。本试验中,吉富罗非鱼幼鱼白球比和碱性磷酸酶活力随着养殖密度增大呈下降趋势,45~81尾/m3组差异不显著,90尾/m3试验组显著低于其他各组,这说明90尾/m3组试验鱼在高密度胁迫下肝脏细胞可能受到损伤。

4 结 论
综上所述,吉富罗非鱼体质量在1~60 g阶段时,养殖密度为45尾/m3,对鱼体生长和免疫功能不会造成损害。养殖密度达到或高于54尾/m3时,鱼体生长发育和免疫功能会受到抑制。

