《化学反应原理》教学中模型建立的实践与思考
施丹
摘 要:培养学生核心素养是高中化学课程教学的核心,课程教学必须充分引导学生综合知识实现从原理理解到实验观测的内化过程。以《弱电解质的电离平衡》为例,通过构建教学模型,数据研究“变化与平衡”,帮助学生理解教学内容从定性的变大、变小,到定量分析,区别正向进行与平衡正向移动,从发展学生变化和平衡的视角看问题,既有微粒变化分析,也有物质浓度大小计算,实现宏观辨识与微观探析的结合。
关键词:高中化学;教学模型;弱电解质;电离平衡
高考是我国主要的高等教育选拔学生的方式。化学作为选考科目,需要学生以更为有效的方式开展课程学习,理解学习要点。通过对近几年的高考题7选3《化学》试题研究,发现在我们化学教学中,原理的教学尤为重要。其中一个重要规律就是图像(数据)—规律(原理)—符号、描述、图像或数据表征。因此,应突出平衡体系中的“常数”特征,而不是它的定性特征(逆、动、等、定、变)。从定性的变大、变小,到定量的分析,这个过程的设计帮助学生建立数据研究“变化与平衡”,区别正向进行与平衡正向移动,发展学生从变化和平衡的视角看问题,既有微粒变化分析,也有物质浓度大小计算,宏观辨识与微观探析相结合。《化学反应原理》主要在高二时完成教学任务,在教学中能够用发展的眼光,注重学生长远发展,建立模型认知的方法,更能起到事半功倍的效果。笔者以一节公开课为例,通过《弱电解质的电离平衡》,发掘在《化学反应原理》教学中进行模型建立的思考。
上课实录
1.备课前的思考
《弱电解质的电离平衡》本单元共有三课时,学生之前已经学过《强电解质和弱电解质》,上一个专题也已经学习了《化学平衡》,因此已经有了足够的理论基础和实验基础。本节课为该单元的第二课时,如何让学生能够从化学平衡知识顺利地迁移到电离平衡的知识,构建一个认识弱电解质特点的模型,是本节课需要解决的关键。通过本节课的学习,希望增强学生解决问题的思维能力,将所学的理论知识进行内化,转化成解决问题的思维能力,并为后续的学习埋下伏笔。
采用的教学方法:本节课通过让学生自主学习,证据推理,从定性到定量的知识迁移,合作学习,实验操作等方式主动获取知识,建立认识弱电解质特点的一般模型,通过设计系列问题,构建好学生的思维模型,形成化学观念,并进行知识迁移。即以学科逻辑理性为内在线索完成教学目标。
评价标准:通过学习之后,给予学生新信息和新问题,学生如果能够用所学模型去分析和解决问题,那么就达成了教学目标。
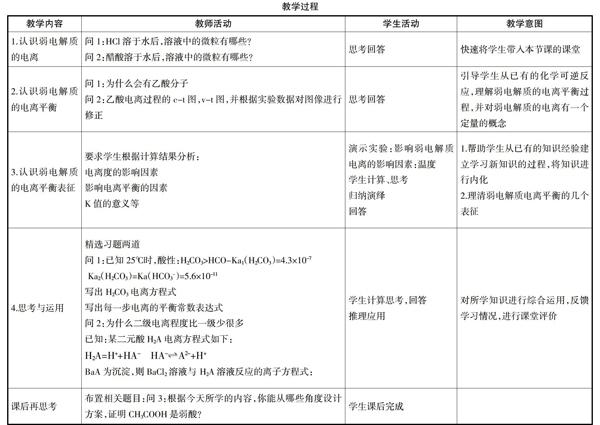
教学过程:(见下表)
2.课堂内容重难点的突破
(1)理清弱电解质的电离
因为在讲强弱电解质时还未学习《化学平衡》,教师基本通过实验手段,如:测试相同浓度下的盐酸和乙酸与活泼金属反应速率(通过宏观观察气球变化的大小)然后给出结论即在水溶液中部分电离的化合物为弱电解质。对于学生而言,当时根本不理解“部分电离”这个真正含义,会误认为,有些弱电解质分子发生电离而有些并未发生电离,一旦这种观念根深蒂固,不利于学生继续理解电离平衡,无法解决选考中的新信息题,更无法谈及思维能力的培养。
本节课采用的解决方法:问学生少量乙酸溶解在水中有哪些微粒?学生会回答其中有乙酸分子,追问学生,为什么会有乙酸分子?是否是未与水分子反应呢?学生会在脑海中进行思考。教师再进一步引导,将弱电解质的电离分为“离子化和分子化”两个角度进行讲解,且这两個反应是同时同条件发生的,就让学生自己得出结论,原来我们平时写的弱电解质的电离方程式用可逆符号来表示的真正含义。
(2)准确画出弱电解质微粒浓度随时间变化的趋势图
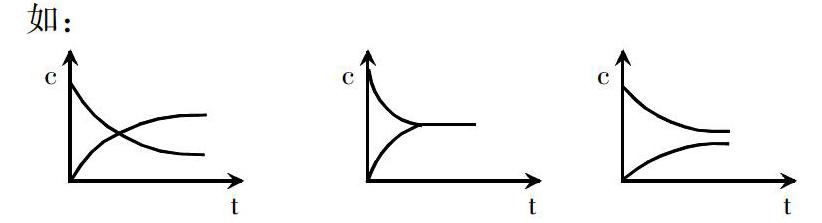
当乙酸分子加入水中,电离开始的瞬点,乙酸分子浓度最大,乙酸根离子浓度为零,随着电离和结合的进行,乙酸分子不断减少,乙酸根离子浓度不断增加,一段时间后,各微粒的浓度不断发生变化即达到平衡状态。由于学生已学过《化学平衡》,其反应过程中生成物和反应物浓度随时间的变化图一般为,浓度交叉后生成物浓度大于反应物浓度,《化学反应原理》书本P47页图2-16。所以,学生在画弱电解质的电离平衡时,常会误认为弱电解质乙酸分子和乙酸根离子浓度随时间的变化图也是这样,这样就会将学生思维定势,不利于学生逻辑思维的培养,更无法谈及化学核心素养,知道却无法在实际运用中表达准确。
本节课采用的解决方法:先只要求学生画出微粒浓度与时间变化的趋势图,对学生认为的三种趋势不简单地用对错来评价,认为趋势都是没有错的。
而是在后续教学的推进中,让学生从自己的数据分析中,反思发现之前自己的趋势图的问题。数据分析主要为《化学反应原理》P65页交流与讨论提供的实验数据,进行电离度的计算。计算出1.00mol/L的乙酸的电离度为0.421%,0.10mol/L的乙酸的电离度为1.34%,横向比较数据,发现乙酸浓度越稀电离程度越小,0.10mol/L的乙酸的电离度为1.34%,因此一般性浓度的乙酸电离后,乙酸根离子浓度远远小于乙酸分子,不用教师继续解释,学生不难发现,原来无法确定的那张图,就很快能确定出来了。教学的最高境界应该是让学生自己去发现问题,并把这个问题运用所学的知识解释清楚。
(3)通过系列问题引导学生主动进行思考,自己形成认识模型
在学习电离平衡的表征时,首先要求学生根据课本已经提供的数据进行计算,得出计算结果后教师设计一系列的问题,问题包括:
从计算结果发现:(1)电离度的大小?(2)表中电离度有何规律?(3)结合化学平衡移动,探讨影响电离平衡的因素?(4)从计算结果看,K与弱电解质的浓度是否有关?(5)K值的影响因素有哪些?(6)K值的意义是什么?问题的设计不仅关注的是学习本身的内容,而且重视学生认知发展规律,让学生跳一跳就可以摘到果子。抓住学生的最近发展区,激发学生主动思考,构建弱电解质的特点的模型。问题设计的一般思路包括:认识知识内容→引导问题→设置问题的作用,构成了认知框架和问题序列。
(4)利用科学数据和实验演示为证据,鼓励学生根据数据得出原理规律
化学概念的学习是比较抽象的、微观的,学生在已有的经验里无法找到模型,这就需要教师在教学过程中帮助学生通过宏观现象和科学数据来建立从微粒及微粒的相互作用角度分析弱电解质的概念,最终形成弱电解质特点的一般思路和方法。本节课在探究弱电解质电离的影响因素时就采用了实验法。
3.本节课存在的问题
(1)对于弱电解质的电离过程缺少实验设计
本节课教师原设计是希望同学对弱电解质的电离建立“离子化”和“分子化”的两个过程。但是设计时,只凭学生以往的经验进行思考,学生课堂上思维再思考和建立过程并不够,并非学生都能掌握这个抽象的理论过程。若在这个环节能设计实验,通过实验,让学生自己总结出方法得出结论,这样不仅培养了学生的实验能力,更重要的是帮助学生逐步形成认识的思路和方法。通过宏观实验的设计,学生自然会从微观视角去探究化学的魅力就在于能让学生自己去发现问题,并且尝试去解决问题,如果能够把问题解决了,那不但掌握了新知识,关键是建立了学习的方法,也就是建立了化学观念,形成问题模型。不仅授人以鱼,更是授人以渔。这不就是学生的最大收获吗?
(2)这节课缺少解决生活实际问题的载体
化学来源于生活,学习化学知识的目的是解决生活中的问题,所以该节课最好能够设计某个生活中的化学实际问题,根据实际问题来提出化学问题,通过实验手段掌握化学的知识点,学会了化学知识,建立了解决问题的模型,最终将化学问题解决了,整节课就显得比较完整了。
教與学是互相动态的结合,学生发展才是教学的意义所在,因此,教学更应该打开学生思维的天窗。教学设计与实践过程,仅仅为证明CH3COOH是弱电解质,HCl是强电解质,而人为的“作假”,以期待测定中出现“预想的效果”,便于自己的教学过程顺利流畅地进行,看似和谐的课堂,学生缺少智慧的碰撞,更缺少真实问题的解决,仍然是典型的“传授+记忆”。从定性的变大、变小,到定量的分析,这个过程的设计帮助学生建立数据研究“变化与平衡”,区别正向进行与平衡正向移动,发展学生用变化和平衡的视角看问题,既有微粒变化分析,也有物质浓度大小计算,实现宏观辨识与微观探析的结合。
参考文献:
[1]吴星.对高中化学核心素养的认识[J].高中化学,2017(5):3-7.
[2]杨梓生.对高中化学学科核心素养的认识[J].中学化学教学参考,2016(8):1-2.
[3]俞赛红.高中化学学科核心素养的学习与理解[J].数理化解题研究,2017(4):83.
[4]程遇玲.浅谈高中化学学科核心素养的培养[J].中学化学教学参考,2017(13):18-20.

