角膜前基质针刺术治疗角膜上皮细胞功能障碍的临床疗效
胡 欢,谢华桃,韩玲玲,李 进,夏向军,张明昌
0引言
角膜上皮病变在眼科门诊工作中较为常见,许多学者已经对其进行了深入的研究。随着对角膜上皮病变的分型不断细化,我国眼科学者孙旭光教授提出角膜上皮细胞功能障碍(corneal epithelial cells dysfunction,CED)的概念,即在角膜缘细胞功能正常的前提下,角膜上皮细胞再生、连接、黏附及移行功能异常[1]。主要发病原因为眼部手术、全身代谢性疾病、角膜营养不良、角膜变性等[2]。目前不少眼科医生对此类疾病的认识不够,易将各种上皮疾病的概念相互混淆,或者笼统地诊断为表层角膜炎、点状角膜炎、病毒性角膜炎,因此CED误诊、误治的情况常有发生,致使部分患者错过最佳治疗时机或者治疗不当,导致病情加重、迁延不愈,形成角膜基质炎、角膜溃疡,重者导致角膜穿孔甚至失明。
目前,治疗CED的药物主要包括自体血清和糖皮质激素类滴眼液,并辅以配戴绷带型高含水量高透氧性软性角膜接触镜。轻、中度CED给予药物治疗后,可以取得良好的效果[3]。药物治疗效果不佳的患者需考虑采用手术治疗,而角膜前基质穿刺术(anterior stromal puncture,ASP)是目前治疗CED的有效手段,由McLean等[4]于1986年率先报道,其可以通过微针穿刺直接作用于病变角膜上皮,加强角膜上皮细胞与前基质层的附着,以稳定角膜上皮细胞的功能。本研究通过对ASP治疗CED前后的各项观察指标及眼表功能结果进行收集、整理及分析,探讨ASP对药物治疗效果不佳的CED的临床疗效,以期为临床治疗各种类型CED提供参考。
1对象和方法
1.1对象回顾性病例研究。选取2015-09/12于华中科技大学同济医学院附属协和医院眼科住院行ASP治疗的CED患者16例16眼,年龄10~84(平均50.43±22.03)岁,其中男10例,女6例;右侧9眼,左侧7眼;眼前段手术后CED 5眼,外伤后复发性角膜上皮糜烂5眼,角膜神经营养不良性CED 3眼,药物毒性CED 1眼,干眼相关性CED 2眼。纳入标准:(1)符合CED诊断标准;(2)诊断为中度及以上程度的CED;(3)经药物和配戴绷带镜规范治疗至少2wk,病情未见明显好转。排除角膜病变位于瞳孔区,伴有其它类型角膜病,或者不愿接受ASP治疗者。本研究符合《赫尔辛基宣言》的原则,并且在数据分析和研究之前取得了医院伦理委员会的批准。所有患者术前均签署手术知情同意书。
1.1.1 CED诊断标准CED诊断标准:眼表不适症状明显,眼痛、畏光、流泪、睁眼困难等症状反复发作。裂隙灯检查示部分角膜上皮缺损,但角膜缘上皮光滑完整,病变区可合并上皮微囊、基底膜皱褶。病程长、症状重者也可合并上皮基底膜局限性增厚,角膜荧光染色见病变区角膜上皮呈点状、线状、小片状甚至弥漫性荧光着染,角膜内皮细胞数量及形态正常[5-6]。
1.1.2 CED分级标准根据角膜荧光着染形态及面积大小进行CED分级,直径<1mm的片状着染为轻度,直径为1~2mm的片状荧光着染为中度,直径>2mm的片状荧光着染以及弥漫性荧光着染为重度。
1.2方法
1.2.1治疗方法所有患者均先接受非手术治疗,给予100%自体血清、1g/L玻璃酸钠滴眼液、左氧氟沙星滴眼液,均为4次/d,睡前涂重组牛碱性成纤维细胞生长因子眼用凝胶,并配戴纯视软性绷带型角膜接触镜。治疗持续2wk,未达到治疗有效标准(即眼部刺激症状有效缓解或消失;角膜上皮完整光滑,荧光染色阴性[7])者实施ASP治疗。本组患者非手术治疗后均未达到治疗有效标准,故均进行ASP术治疗。ASP手术方法:患眼局部麻醉后,用刮匙刮除病变区角膜上皮及其周边疏松附着的角膜上皮,并于基底膜表面轻轻骚刮;用胰岛素针头于病变区角膜上皮外缘1mm的前基质层进行致密的浅点状前基质层针刺,深度约1/3厚度,针刺间距0.5mm。术毕将绷带型角膜接触镜置于术眼角膜表面,涂重组牛碱性成纤维细胞生长因子眼用凝胶并包扎患眼。ASP术后第1d开始给予100%自体血清滴术眼,前3d为每小时1次,之后改为8次/d,第2wk 4次/d,2wk后改用1g/L玻璃酸钠眼液滴术眼 4次/d,连用1mo后停药;给予1g/L氟米龙滴眼,第1wk 4次/d,每周递减1次,连用1mo后停药,夜间给予重组牛碱性成纤维细胞生长因子眼用凝胶涂患眼。
1.2.2观察指标所有患者均于术前、术后1、3mo进行裸眼视力、眼表疾病指数评分(ocular surface disease index,OSDI)[8-9]检查,并采用眼前节光学相干断层扫描(OCT)测量病变区角膜上皮厚度和全角膜厚度,角膜共聚焦显微镜测量病变部位上皮下树突状细胞密度、角膜内皮细胞密度及上皮下神经丛密度。其中裸眼视力转换为最小分辨角对数(LogMAR)视力进行统计分析;上皮下神经丛密度的计算采用胡亮等[10]报道的方法,即使用共聚焦显微镜采集所有可见上皮下神经纤维束后,从每次扫描的图片中挑选出基底层上皮下神经丛最丰富且清晰的图片进行神经形态参数的统计后取平均值,使用Image J软件的Neuron J插件对所选取的图像进行分析(图1)。所有检查均由同一医师完成。
2结果
2.1手术前后裸眼视力术前、术后1、3mo本组患者裸眼视力(LogMAR)分别为0.48±0.37、0.23±0.22、0.21±0.21,差异有统计学意义(F=4.648,P=0.015),术后1mo裸眼视力较术前显著改善,差异有统计学意义(P<0.05),但术后1、3mo裸眼视力差异无统计学意义(P=0.846)。
2.2手术前后OSDI评分术前、术后1、3mo本组患者OSDI评分分别为36.81±4.99、7.06±5.87、7.00±5.78分,差异有统计学意义(F=558.15,P<0.001)。术后1mo OSDI评分与术前相比,差异有统计学意义(P<0.001),但术后1、3mo OSDI评分差异无统计学意义(P=0.935)。
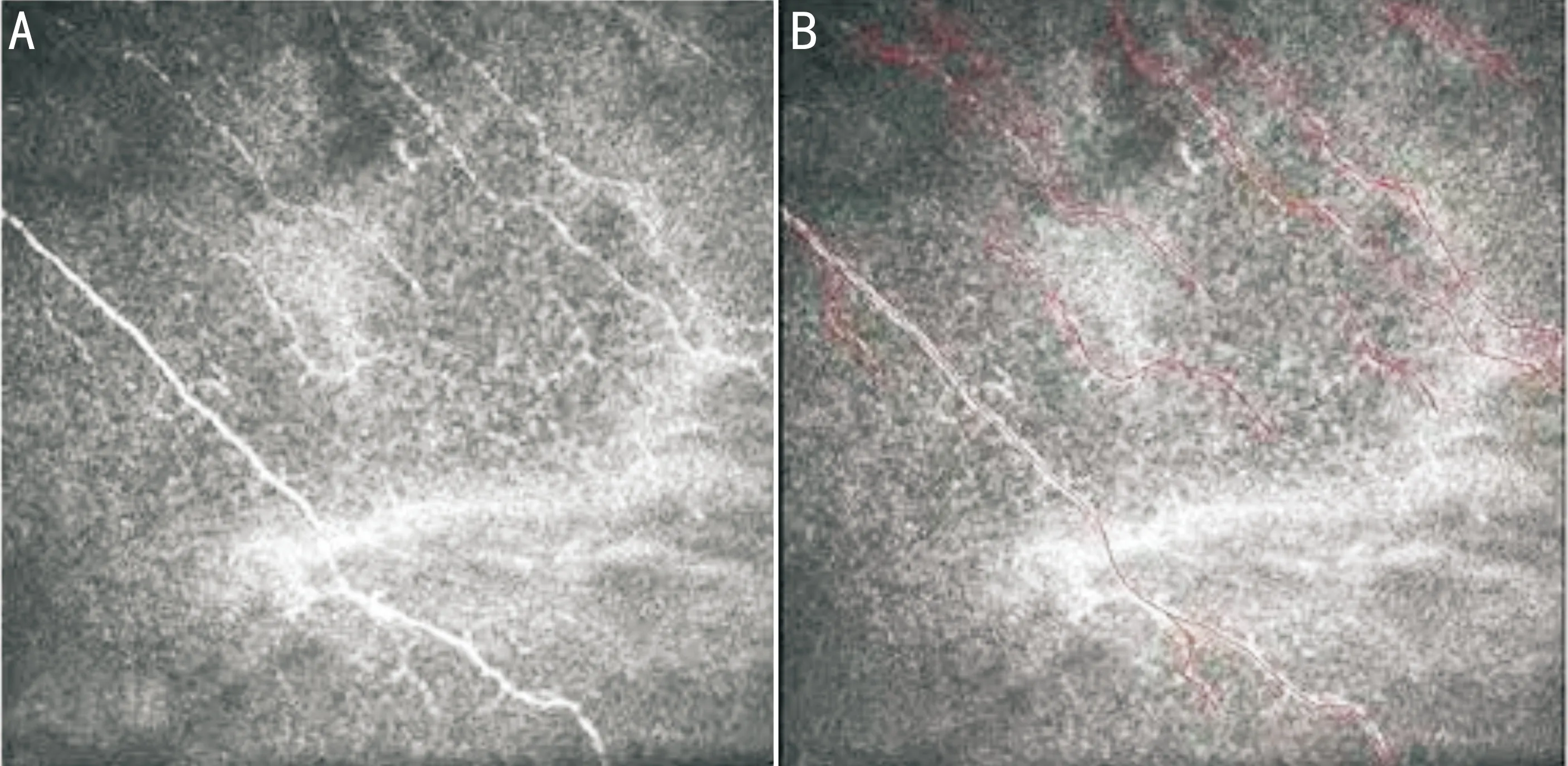
图1某患者治疗1mo后共聚焦显微镜显示的上皮下神经生长情况(×800)A:Image J软件处理前;B:Image J软件处理后。

图2手术前后角膜荧光染色情况患者陈某,男,35岁,因指甲划伤右眼造成角膜上皮糜烂反复发作5次,伴有畏光、流泪,睁眼困难。术前检查:视力OD 0.5、OS 0.5,右眼球结膜充血++,角膜上皮不规则大片缺损,角膜弥漫性荧光着染。ASP术后1、3mo角膜透明,未见荧光着染。A:术前;B:术后1mo;C:术后3mo。
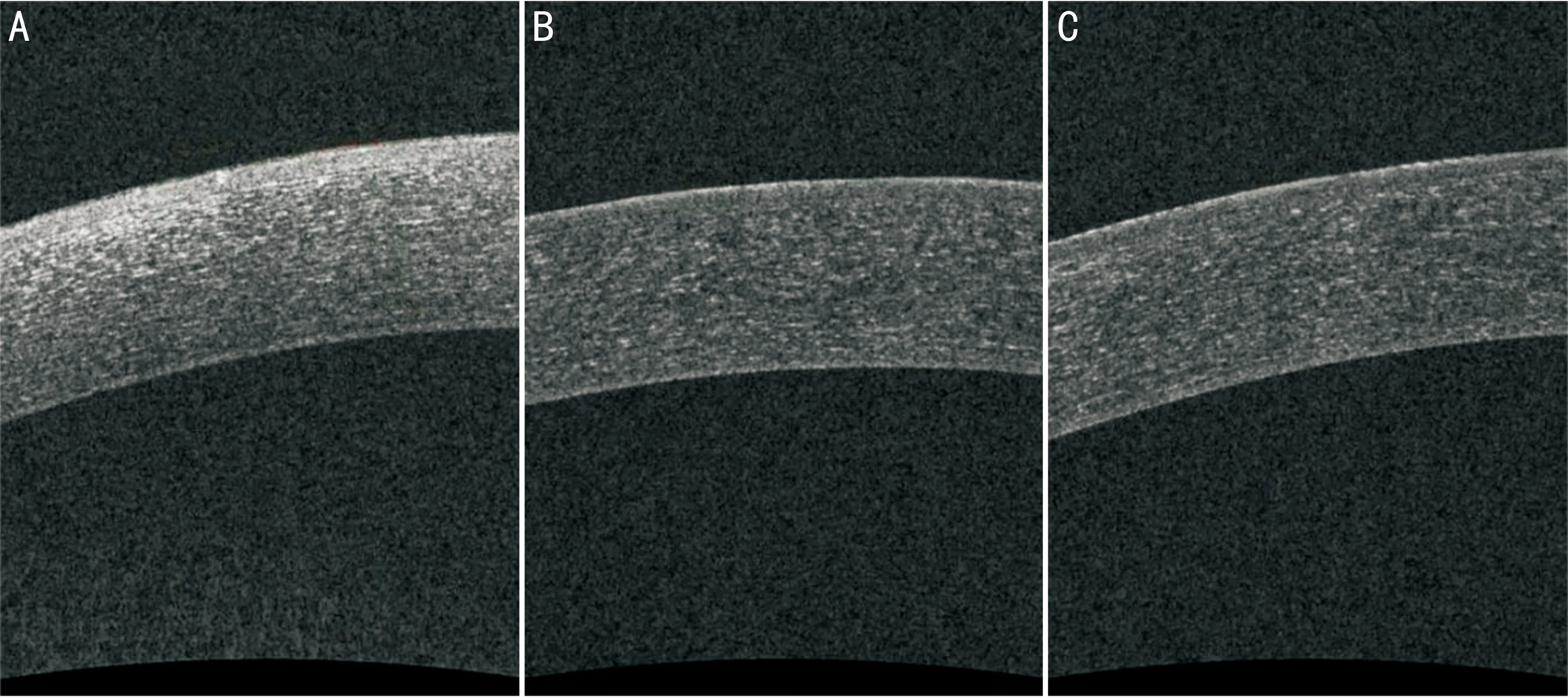
图3手术前后眼前节OCT检查情况患者刘某,男,53岁,右眼打击后异物感,红痛、视力下降等不适2mo余。术前检查:视力OD 0.6、OS 0.8,右眼球结膜充血++,右眼瞳孔区偏下方见上皮小片状缺失,荧光染色见片状荧光着染。ASP术前角膜上皮厚度95μm,全角膜厚度580μm;术后1mo分别为65、533μm;术后3mo分别为65、527μm。A:术前;B:术后1mo;C:术后3mo。
2.3手术前后角膜荧光染色情况治疗后3mo,本组患者角膜荧光染色均为阴性。手术前后角膜荧光染色情况见图2。
2.4手术前后角膜厚度术前、术后1、3mo本组患者角膜上皮厚度分别为79.19±10.75、59.75±5.72、59.44±5.88μm,差异有统计学意义(F=33.617,P<0.001);全角膜厚度分别为591.38±34.41、545.81±27.57、545.44±27.62μm,差异有统计学意义(F=12.372,P<0.001)。术后1mo本组患者角膜上皮厚度和全角膜厚度与术前相比,差异均有统计学意义(P<0.001),但术后1、3mo角膜上皮厚度和全角膜厚度差异均无统计学意义(P=0.884、0.912)。手术前后眼前节OCT检查结果见图3。
2.5手术前后角膜上皮下树突状细胞密度术前、术后1、3mo本组患者角膜上皮下树突状细胞密度分别为85.00±45.10、22.50±13.38、1.00±2.73个/mm2,差异有统计学意义(F=41.476,P<0.001)。术后1mo角膜上皮下树突状细胞密度与术前相比,差异有统计学意义(P<0.001),且术后1、3mo角膜上皮下树突状细胞密度差异有统计学意义(P=0.036)。
2.6手术前后角膜内皮细胞密度术前、术后1、3mo本组患者角膜内皮细胞密度分别为2865.81±271.46、2866.31±268.87、2869.38±270.70个/mm2,差异无统计学意义(F=0.001,P=0.999)。手术前后角膜共聚焦显微镜检查角膜内皮细胞情况见图4。
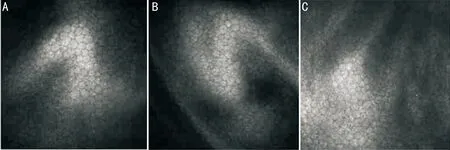
图4手术前后角膜共聚焦显微镜检查角膜内皮细胞情况(×800)患者刘某,男,27岁,双眼反复干涩、异物感2mo余。术前检查:视力OD 1.0、OS 1.0,双眼瞳孔周围角膜上皮粗糙,荧光染色见双眼瞳孔周围散在点状着染。ASP术前后角膜内皮细胞密度、形态均正常,未见明显差异。A:术前;B:术后1mo;C:术后3mo。
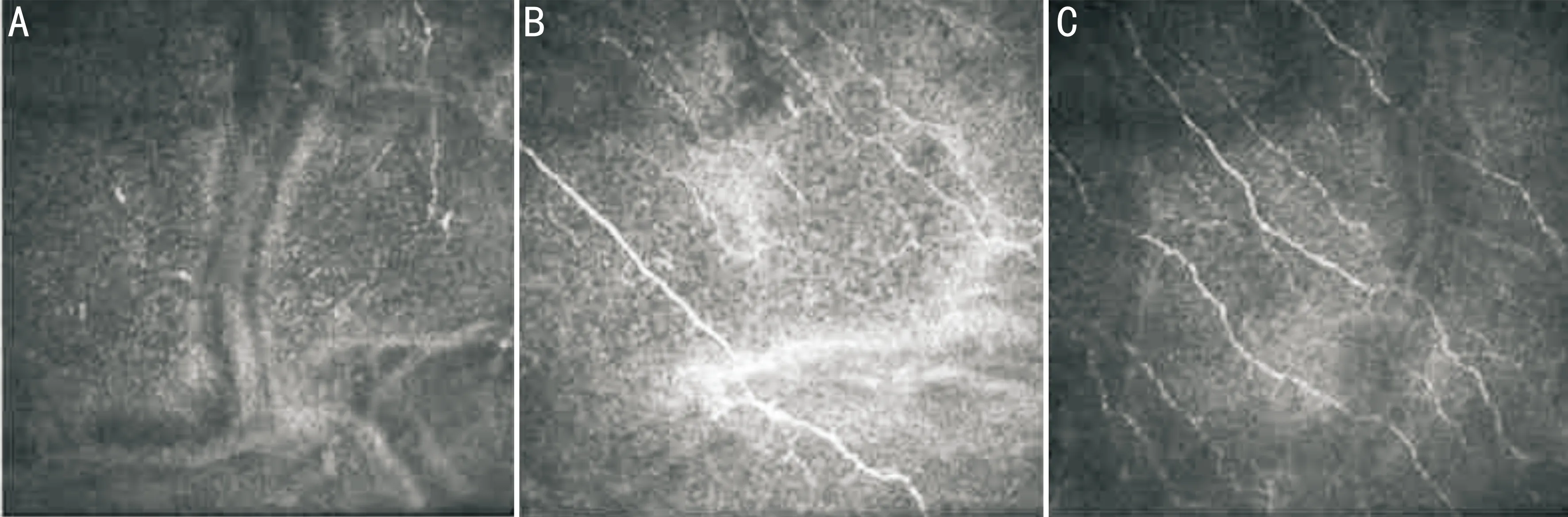
图5手术前后角膜共聚焦显微镜检查角膜上皮下神经丛情况(图4同一患者,×800)A:术前角膜上皮下神经极为稀少,局部断裂不完整;B:术后1mo角膜上皮下神经明显可见,较术前数量明显增加,但仍有部分神经不规则,局部有离断;C:术后3mo角膜上皮下神经数量较术后1mo有所增加,密度正常,走形规则,未见明显中断和直角弯折。
2.7手术前后角膜上皮下神经丛密度术前、术后1、3mo本组患者角膜上皮下神经丛密度分别为58.37±27.03、151.63±7.78、181.25±7.25mm/mm2,差异有统计学意义(F=233.991,P<0.001)。术后1mo角膜上皮下神经丛密度与术前相比,差异有统计学意义(P<0.001),且术后1、3mo角膜上皮下神经丛密度差异有统计学意义(P<0.001)。手术前后角膜共聚焦显微镜检查角膜上皮下神经丛情况见图5。
3讨论
正常情况下,角膜上皮的完整修复需要具备3个条件即上皮细胞再生、移动、黏附,依靠的是上皮细胞之间的紧密连接以及上皮细胞与基底膜之间的半桥粒结构[11]。曲景灏等[12]研究证实,缺损面积较大的角膜上皮修复需要基底细胞与角膜缘干细胞共同完成,若基底膜受到破坏,胶原蛋白酶产生增加,角膜正常代谢产生新的功能完整的上皮细胞将无法黏附于基底膜上,细胞之间的紧密连接功能亦不能恢复,可能导致CED的发生,从而延迟角膜上皮修复,甚至引起加速溃疡形成,导致伤口不愈合。对于CED的治疗,首先考虑配戴角膜绷带镜、激素类滴眼液以及自体血清等保守手段[13-15]。而本次研究中所纳入的患者均是由于上述治疗效果不佳,故选择手术治疗。
ASP能够刺激基底膜,增加基底膜与再生上皮的黏附能力。对人类角膜的免疫组化研究显示,上皮基底膜和前弹力层黏附不牢的主要因素是上皮基底膜外基质蛋白的缺失[16]。通过ASP能够增加上皮基底膜外蛋白质的表达,加速上皮下纤维化的形成,促进上皮再黏附,从而加速病变角膜上皮的修复。有研究表明,在兔角膜溃疡模型中,通过针刺治疗,角膜组织中的胶原酶生成明显减少,可抑制异常基底膜生长,刺激新的健康的基底膜再生,同时加强细胞之间以及细胞与基底膜之间的紧密连接,促进角膜上皮的修复[17]。Das等[18]指出,ASP相较于其它术式,优势主要在于使用简便的设备便可以实施,引起角膜瘢痕和屈光度改变的风险较小,而且患者在术中的不适度低。本研究中,16例患者非手术治疗效果不佳,而在ASP术后1mo时,裸眼视力、OSDI、角膜上皮厚度及全角膜厚度均较术前明显好转,特别是角膜荧光染色检查均为阴性,这就可以说明ASP在治疗CED中发挥了重要的作用。
本研究中,我们还使用角膜共聚焦显微镜观察了相关的预后指标,如树突状细胞数量。正常情况下,树突状细胞存在于角巩缘,是目前已知的最强的抗原提呈细胞,能有效活化T细胞[19]。而角膜上皮层是抵抗病原微生物入侵角膜的第一道屏障,角膜上皮细胞受损时,极易导致感染性炎性细胞的增殖与活化[11]。CED发生时,树突状细胞清除有害的病原微生物、产物及有害抗原物质,并直接或间接激活T细胞,数量会明显增加。本组患者术后1mo复查共聚焦显微镜,角膜上皮下树突状细胞密度明显下降,但仍高于正常水平,这就提示ASP及术后用药的治疗是有效的,但仍有炎症存在;术后3mo复查,树突状细胞密度较术后1mo继续下降,提示此时炎症被进一步控制。共聚焦显微镜对于活体观察树突状细胞数量,评估术后炎症的转归有重要作用,在主观症状消失和一些基础检查结果正常时,也应嘱患者按时随访。
共聚焦显微镜的另一重要功能是可以观察角膜上皮下神经丛密度以及分布情况[20]。角膜丰富的神经分布对于维持敏感的角膜知觉和眼表微环境的稳态都有非常重要的意义。上皮下神经丛的修复会经历一个比较漫长的过程,有研究显示,角膜屈光术后6mo中央区仍无神经分布[21]。CED同样会导致上皮下神经丛密度降低,结构发生异常改变[22]。本组患者术后1mo行角膜荧光染色检查已呈阴性,但共聚焦显微镜检查显示仍有神经分布不规则及离断,到术后3mo时上皮下神经丛密度才基本接近正常。提示CED术后复查时,传统的角膜荧光染色检查即使呈阴性,也应通过共聚焦显微镜评估术后上皮下神经丛的恢复情况。
此外,我们还检查了角膜内皮细胞密度情况。单纯的CED不会引起角膜内皮层的改变。ASP术前后本组患者角膜内皮细胞密度未呈现明显差异,说明由于手术治疗及时,未影响到角膜内皮细胞的功能。Nishida等[23]对白内障术后并发CED的患者41例进行了随访,结果显示CED治疗前后,角膜内皮细胞密度无明显变化,这与我们的研究结果是一致的。近年来,白内障手术后诱发大泡性角膜病变的风险已经受到眼科医生的重视,随着内皮移植手术的广泛开展,角膜内皮疾病也可以得到有效的治疗。但在我们本次研究的病例中,有5眼是在眼前段手术后诱发的CED,这就提示在白内障术后除了角膜内皮细胞以外,角膜上皮细胞结构的完整与功能的稳定也是很重要的[24]。
综上所述,ASP可以有效治疗CED及其诱发的炎症,并且可修复其导致的上皮下神经丛缺损。但值得注意的是,ASP会形成角膜瘢痕,治疗必须要避开瞳孔区,以防止瘢痕严重影响视觉质量。同时在术前检查及术后随访时,应重视角膜共聚焦显微镜的使用,作为新型、无创、精确的眼前节检查设备,其在CED以及其它角膜病的疗效评价中有着非常重要的作用,下一步研究应该致力于完善共聚焦显微镜的检查指标在CED发病及转归中的分级标准。

