高强度间歇训练对老龄大鼠骨骼肌减少症及某些氧化应激、脂肪细胞因子和炎症因子的影响
孙磊 李方晖
南京师范大学体育科学学院(南京210023)
人体是由肌肉、骨骼、脂肪和水等构成,构成人体的各种成分会随年龄的变化而改变,肌肉含量呈现增龄性减少,脂肪含量明显增加[1]。老年人的肌肉萎缩、力量和耐力下降称之骨骼肌减少症(sarcopenia)[2]。骨骼肌减少症会增加老年人摔倒和骨折的风险[3]。第4次国民体质监测结果显示,我国人口肌肉力量和骨骼肌含量从成年到老年的下降速率呈现增大趋势[4,5]。因此,及时采取有效的手段预防骨骼肌减少症的发生,对于提高老年人的生存质量具有重要的现实意义[5]。
老年人体脂百分比(尤其内脏脂肪)增加导致的炎症因子分泌量升高是骨骼肌减少症的重要诱因[6,7]。超敏C-反应蛋白(high sensitivity-C reactive protein,hs-CRP)和白细胞介素-6(interleukin-6,IL-6)升高与老年人肌力下降、肌肉丢失等有关[8]。氧化应激导致的低度慢性炎症水平(low-grade chronic inflammation)与骨骼肌减少症发生也密切相关[9]。衰老相关的氧化应激能诱导炎症因子的基因表达,如hs-CRP、IL-6 和肿瘤坏死因子-α分泌增加,引起低度慢性炎症水平[9]。作为重要的脂肪细胞因子,机体瘦素和脂联素水平改变也与骨骼肌减少症发生有关。瘦素可通过作用于中枢系统调节饮食行为和能量消耗、促进胰岛素样生长因子-1蛋白表达来刺激骨骼肌蛋白质合成[7],促进脂肪分解和降低体内脂肪沉积[10]。人体横断面研究证实,血浆脂联素含量增加可作为独立因子预测老龄摔倒和残疾风险增加[11]、老年人肌肉力量和耐力降低[11,12]。动物实验研究进一步发现,血浆脂联素升高会导致骨骼肌功能下降、线粒体代谢功能紊乱、氧化应激和骨骼肌蛋白质降解[13]。
高强度间歇训练(high-intensity interval training,HIIT)以其耗时短、强度大、恢复快的特点,受到运动员和健身爱好者的青睐[14,15]。HIIT 对于提高健康人群有氧适能、改善心血管病和2 型糖尿病患者的心肺耐力优于持续性耐力训练[16]。Bell 等[17]研究发现,力量训练和HIIT 刺激老年人肌纤维蛋白质合成的效果相似,但HIIT 对肌浆网内蛋白质合成的刺激作用强于抗阻训练。Seldeen等[18]研究也发现,HIIT使得老龄大鼠抓力、耐力、步速分别增加了10.9%、32.6%和107%。人体研究证实,HIIT 促进老年人骨骼肌线粒体生物合成和蛋白合成通路相关蛋白的表达,同时也上调骨骼肌DNA甲基化水平[19]。总之,HIIT 能更有效地延缓老年人骨骼肌减少症、增强骨骼肌力量和机体心肺耐力[13,17,19-21]。HIIT能缓解2型糖尿病[22]和慢性肾病[23]患者慢性低度炎症和氧化应激水平,并调控脂肪因子分泌[24]。然而,HIIT 是否缓解衰老进程中机体的氧化应激和慢性低度炎症水平?HIIT是否改善衰老相关的脂肪因子分泌失调?这些问题尚不清楚。
基于此,本研究以8月龄成年大鼠和18月龄增龄大鼠为研究对象,研究8 个月HIIT 干预对老龄大鼠体成分、抓力、耐力和骨骼肌氧化应激、血浆中hs-CRP、IL-6/10、脂联素和瘦素分泌的影响,为HIIT 延缓骨骼肌减少症的发生提供理论依据。
1 材料和方法
1.1 实验动物及分组
选用广东省医学动物实验中心提供的清洁级雌性8月龄(Sprague Dawley,SD)大鼠48只[动物许可证号: SCXK(粤)2013-0002]。所有大鼠自由饮食,动物房保持自然照明;动物饲养室保持23 ± 1.5℃温度,相对湿度45% ± 15%。随机选取12 只大鼠,适应性喂养2周后随即进行体成分、耐力和抓力测试,测试静息48 h后再禁食12 h宰杀,将此作为成年对照组。剩下36只大鼠进行常规饲养10 个月。于18月龄时进行适应性跑台1 周,之后随机分为三组:老龄安静组、老龄中等强度持续性训练(moderate-intensity continuous training,MICT)组和老龄HIIT 组,每组各12 只;但实验过程中老龄安静组2 只大鼠(眼睛感染),老龄MICT 组4只大鼠(2只死于运动无关的原因、2只爪子外伤感染)和HIIT组6只大鼠(2只无法坚持训练、2只爪子和2只尾部感染)被排除;采用广州飞迪生物科技有限公司动物实验跑台(型号FD000043)进行训练,训练周期为8个月;老龄MICT 组和老龄HIIT 组大鼠在末次训练后48 h 与老龄安静组大鼠共同完成体成分、抓力和耐力测试;耐力测试静息48 h后,禁食12 h并宰杀。
1.2 运动方案
文献报道,18月龄SD大鼠正处于骨骼肌减少症的前期(pre-sarcopenic),26月龄SD大鼠处于骨骼肌减少症阶段,18月龄至26月龄大鼠骨骼肌含量和功能呈现快速丢失阶段,8月龄成年大鼠的骨骼肌结构功能正处于最佳状态[25]。因此,本研究选择8月龄大鼠作为成年对照组,在第18月龄进行8 个月HIIT 和MICT 干预,重点观察HIIT是否可延缓骨骼肌减少症的发生。
1周适应性训练后,采用呼气分析运动试验对HIIT组6 只大鼠进行最大吸氧量(maximal oxygen uptake,VO2max)的测定,进而确定跑步速度[26]。正式训练的运动方案参考Criswell 等[27]训练强度和运动时间略作改动。MICT 组以速度17 m/min(运动强度75%~80%VO2max)运动;HIIT起始速度先以15 m/min(运动强度约为45%~55%VO2max)运动,时间为4 min,之后跑步速度增至25 m/min(运动强度为85%~95%VO2max),运动1 min,依次交替进行9 个循环,总时间均为45 min,1 次/天,5 天/周,训练8 个月,周六和周日休息,跑台坡度为0°。正式训练的前和后分别以10 m/min 速度(运动强度约为30%~40% VO2max)、时间为1 min进行热身和放松运动。老龄安静组不进行训练,但将该组大鼠放置跑步机旁。
1.3 取材及指标测定
上述三组大鼠均按照4 ml/kg 剂量的10%水合氯醛麻醉,用一次性注射器取腹主动脉血,然后将注射器中血液样本注射于肝素钠抗凝5 ml EP 试管中,先常温静置30 min,最后在4℃环境下静置1 h,紧接着进行15 min离心,转速在3500 r/min。离心之后,抽离血浆,转移至-80℃低温冰箱冻存。同时,快速分离两侧股四头肌、腓肠肌、趾长伸肌和比目鱼肌并称重,以每只大鼠不同骨骼肌质量比上其体重得到对应的骨骼肌衰减指数(sarcopenia index)[18]。
1.3.1 体成分
在畜禽日粮中添加解淀粉芽孢杆菌,可以减少畜禽粪便中氮、磷化合物等的排放,减少粪污对养殖环境的污染。在日粮中添加解淀粉芽孢杆菌可以显著降低鸡粪中硫化氢含量[23];添加解淀粉芽孢杆菌T6可以降低肉鸡5.3%~41.9%磷排放,7.1%~30%钙排放[38];添加解淀粉芽孢杆菌KB3可以显著降低肉鸡排泄物中有害气体含量[23]。
分别在实验起始和实验结束采用双能X射线对大鼠进行体成分测量。测试前腹腔注射10%水合氯醛(3 ml/kg)麻醉大鼠,将大鼠呈俯卧姿势放置在XR-36NORLAND型双能X线吸收平台上,在小动物模式下扫描大鼠的体成分,观察的指标包括瘦体重、瘦体重百分比(瘦体重%)、脂肪重量、体脂百分比(体脂%)和瘦体重/脂肪比值。
1.3.2 耐力和抓力测定
大鼠耐力测试参考Li 等[14]采用改良斜板测试(inclined plane test)方法。具体步骤:在大鼠尾部悬挂350 g 重物,将其头上尾下置于倾斜60 度、距离地面50 cm 高的铁丝网(网眼规格1 cm × 1 cm)上,铁丝网下方放置泡沫垫以防大鼠摔伤,如果测试时间少于10 s,则休息5 min 后重新测试,最终记录大鼠在铁丝网上停留时间(handing time),再以参数与体重(body weight,BW)的比值(min/g)×100评价大鼠肌耐力。
抓力(grip strength)测试仿照Grip Strength Meter(Bioseb,France)使用拉力计和铁丝网自制仪器,将仪器放置于光滑平面上,拉力计端保持固定,将大鼠放于铁丝网上,沿铁丝网的纵轴方向轻轻牵拉大鼠尾部,致其四个爪子抓紧铁丝网,缓慢增加牵拉力度,直至拉力超过大鼠的抓力,大鼠被拉离铁丝网。测试过程中,拉力计自动记录最大抓力值,重复测量3 次,取最大值。再以该参数与BW比值(N/g)×100评价抓力[14]。
1.3.3 血浆氧化应激、炎症因子、脂联素及瘦素浓度的测定
血浆丙二醛(malondialdehyde,MDA)含量和超氧化物歧化酶2(superoxide dismutase 2,SOD2)活性用比色法测定,单位分别为: nmol/ml 和U/ml。血浆中瘦素、脂联素、IL-6、IL-10、hs-CRP、4-羟基壬烯醛(4-hydroxy-2-nonenal,4-HNE)和8-羟基脱氧鸟苷(8-hydroxy-deoxyguanosine,8-OHdG)浓度采用酶联免疫吸附试验(ELISA)进行测定,单位均为: ng/l。上述试剂盒购自南京建成生物工程研究所,操作过程严格按照试剂盒说明操作,每个指标测3次,取均值。
1.4 统计方法
实验数据用SPSS17.0数据软件包处理。用独立样本t检验分别分析老龄安静组与成年对照组,用单因素方差分析老龄安静组、老龄MICT组和老龄HIIT组所有测试指标。结果以均数± 标准差(± s)表示。P<0.05表示差异具有统计学意义。采用Pearson相关分析计算各个变量的相关系数r值。
2 结果
2.1 各组大鼠体成分和骨骼肌指数变化
表1显示,与成年对照组相比,老龄安静组大鼠的体重、体脂重量、体脂/瘦体重比值、体脂%均显著增加(P<0.01),瘦体重显著增加(P<0.05),而瘦体重%显著降低(P<0.01);老龄安静组大鼠比目鱼肌指数(P<0.05)、股四头肌指数均显著减少(P<0.05)。
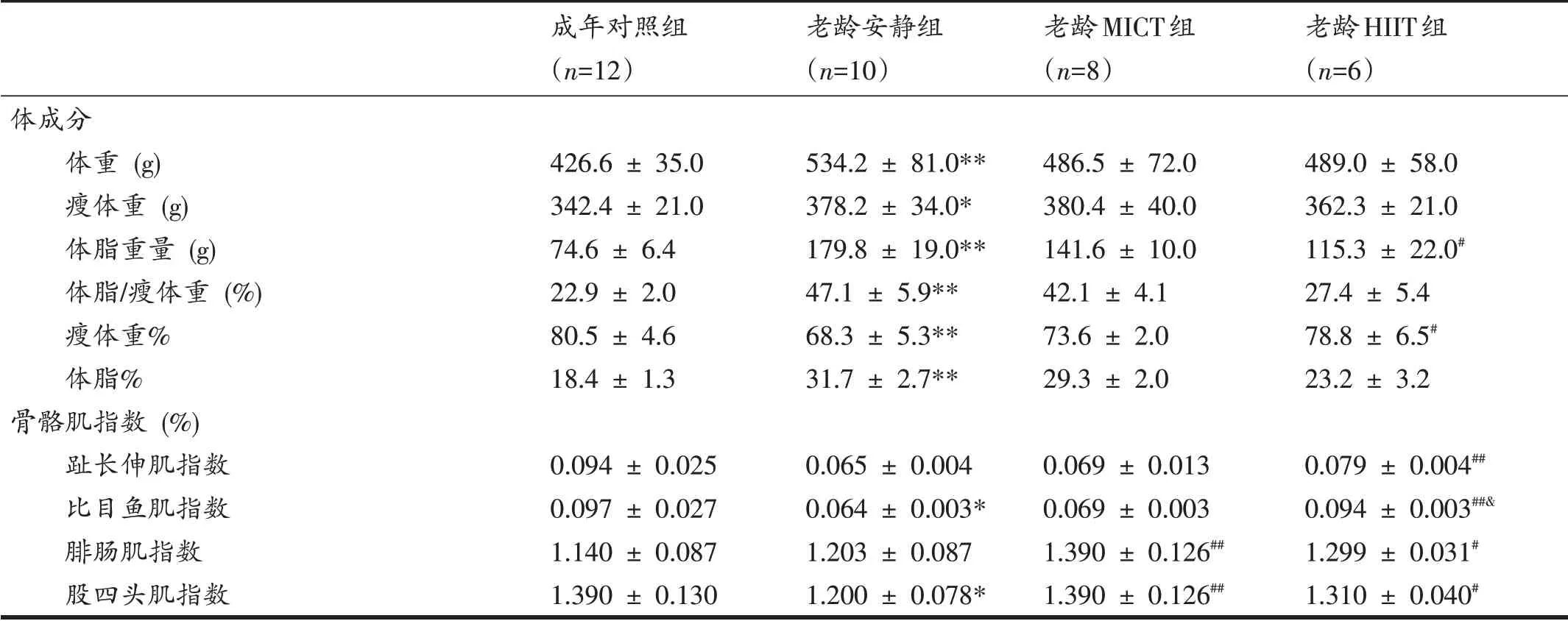
表1 各组大鼠体成分和骨骼肌指数
2.2 各组大鼠骨骼肌抓力和耐力变化
表2显示,与成年对照组相比,老龄安静组大鼠耐力和抓力显著降低(P<0.01)。8个月运动干预后,与老龄安静组大鼠相比,老龄MICT 组大鼠耐力显著增加(P<0.05),老龄HIIT 组大鼠耐力和抓力显著增加(P<0.01)。与老龄MICT 组相比,老龄HIIT 组抓力显著增加(P<0.01)。

表2 各组大鼠的抓力和耐力成绩
2.3 各组大鼠血浆氧化应激参数变化
表3显示了大鼠血浆和骨骼肌氧化应激指标的变化。与成年对照组相比,老龄组大鼠血浆MDA、8-OHdG和4-HNE显著增加(P<0.05)。8个月干预后,与老龄安静组相比,老龄MICT组大鼠血浆8-OHdG和4-HNE 显著降低(P<0.01);老龄HIIT 组大鼠血浆MDA(P<0.05)、8-OHdG(P<0.01)和4-HNE(P<0.05)也显著降低;与老龄MICT组相比,老龄HIIT组大鼠血浆MDA明显降低(P<0.01)。
与老龄安静组相比,老龄MICT组和老龄HIIT组大鼠骨骼肌SOD2活性均显著增加(P<0.01);与老龄安静组相比,老龄MICT 组和老龄HIIT 组大鼠骨骼肌4-HNE 显著降低(P<0.05);老龄MICT 组和老龄HIIT 组大鼠骨骼肌8-OHdG 低于老龄安静组(P<0.01);此外,老龄HIIT组骨骼肌MDA(P<0.01)和8-OHdG(P<0.05)低于老龄MICT组。
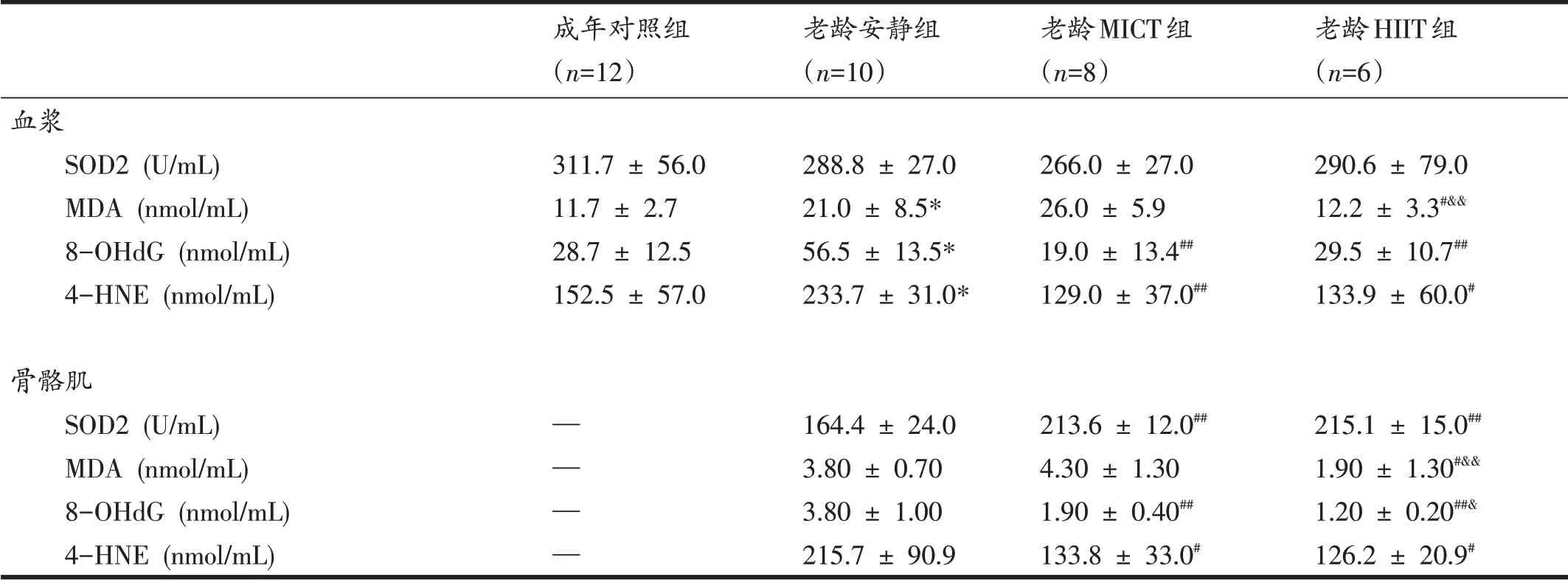
表3 各组大鼠血浆氧化应激相关指标
2.4 各组大鼠血浆炎症因子含量
表3显示,与成年对照组相比,老龄安静组大鼠血浆hs-CRP显著增加(P<0.05);8个月运动干预后,与老龄安静组相比,老龄HIIT 组大鼠血浆中hs-CRP 和IL-6/IL-10 比值显著降低,血浆IL-10 水平显著增加(P<0.05);与老龄MICT组大鼠相比,老龄HIIT组大鼠血浆中hs-CRP 和IL-6/IL-10 比值显著降低,血浆IL-10 水平显著增加(P<0.05)。
2.5 各组大鼠血浆瘦素和脂联素分泌量
表5显示,与成年对照组相比,老龄安静组大鼠血浆脂联素显著增加(P<0.05)。8个月运动干预后,与老龄安静组相比,老龄MICT(P<0.01)和老龄HIIT 组(P<0.05)大鼠血浆脂联素显著增加;老龄HIIT组大鼠血浆瘦素水平显著增加(P<0.05);与老龄MICT 组相比,老龄HIIT组大鼠血浆脂联素水平显著增加(P<0.01)。
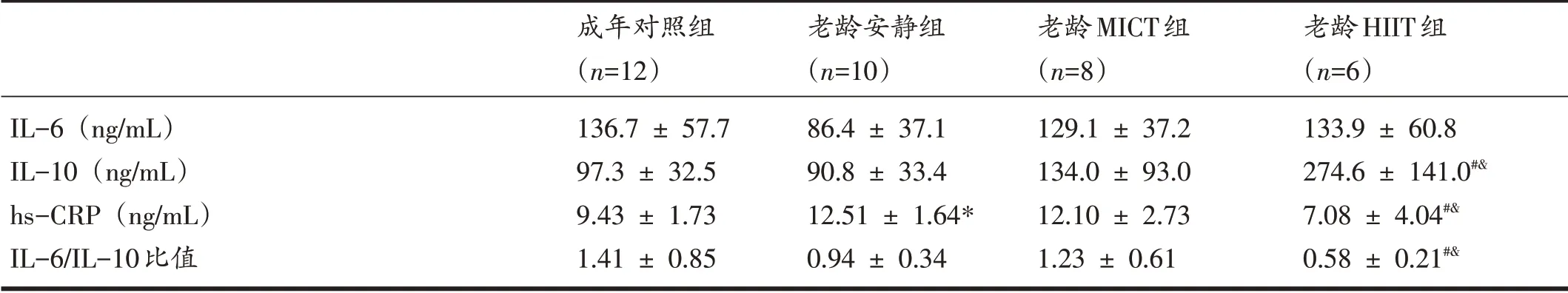
表4 各组大鼠血浆炎症因子变化

表5 各组大鼠血浆中瘦素、脂联素
2.6 相关分析
表6 显示,体脂重量与体脂%呈正相关(r=0.96,P<0.01),与瘦体重%呈负相关(r=-0.96,P<0.01);抓力与瘦体重呈正相关(r=0.61,P<0.01),但与体脂重量(r=-0.61,P<0.01)和体脂%(r=-0.48,P<0.05)呈负相关;耐力成绩与血浆8-OHdG 呈负相关(r=-0.72,P<0.01);血浆hs-CRP 与体脂%(r=0.55,P<0.05)、MDA(r=0.58,P<0.05)和4-HNE(r=0.66,P<0.01)呈正相关;血浆瘦素和体脂%呈负相关(r=-0.58,P<0.05)。
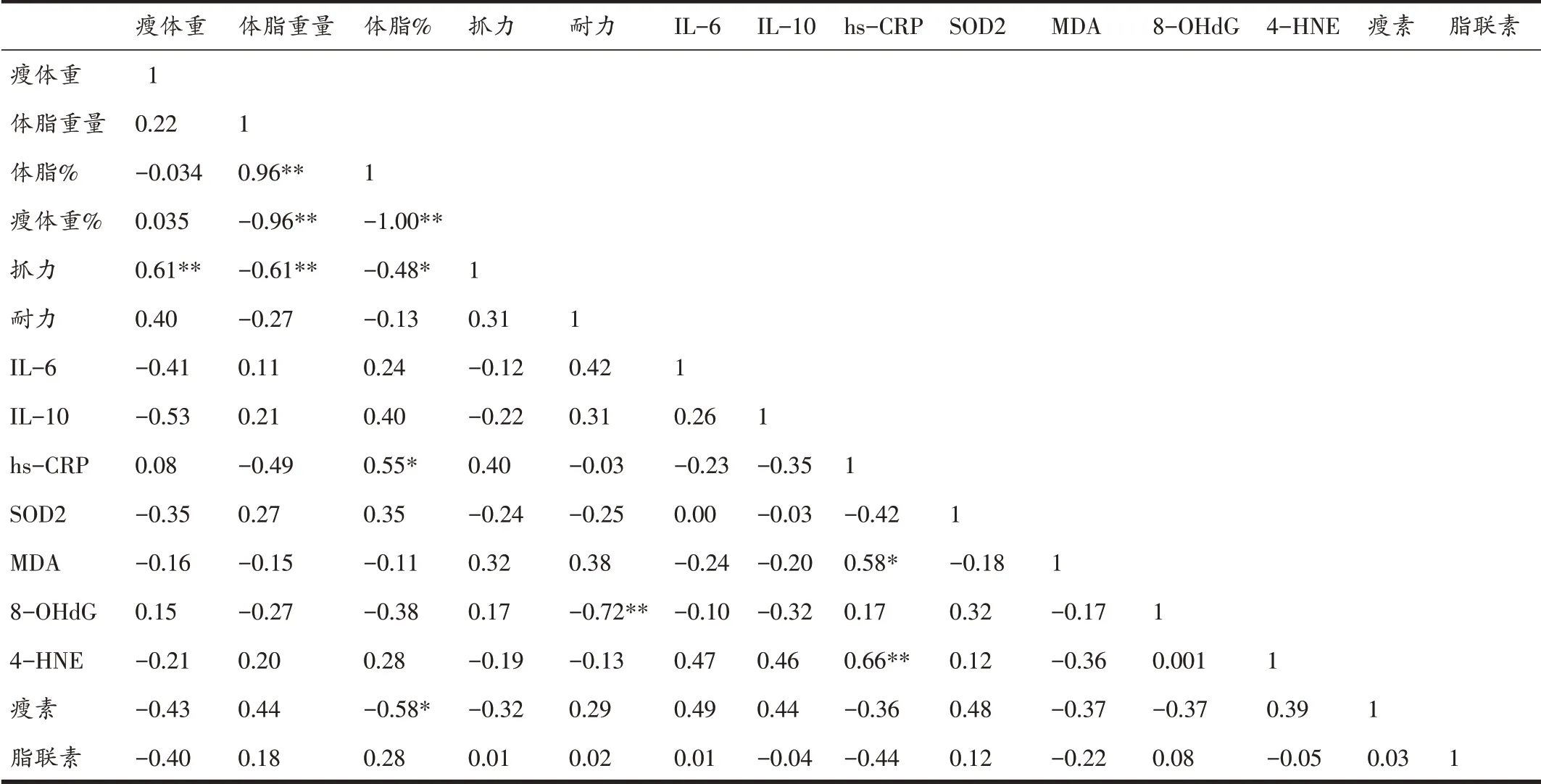
表6 各个参数的Pearson相关系数r值
3 讨论
衰老进程中脂肪含量的增加与老年人骨骼肌减少症和运动表现降低有关[1]。本文采用双能X 线吸收测量8 个月HIIT 干预对老龄大鼠体成分的影响。表1 显示,8 个月HIIT 能使增龄大鼠脂肪重量降低,瘦体重%明显增加。说明,HIIT 干预能抑制增龄过程中瘦体重向脂肪组织的转化;同时,老龄HIIT 组大鼠的腓肠肌、股四头肌指数、比目鱼肌指数以及趾长伸肌指数均高于老龄安静组。提示,HIIT 抑制老龄大鼠脂肪堆积的同时,防止衰老导致骨骼肌的丢失。鉴于骨骼肌指数可表征骨骼肌衰减指数(sarcopenia index)[18],骨骼肌衰减指数的降低与骨骼肌耐力和肌力降低有关[28]。因此,本研究采用抓力和斜板测试分别测试大鼠抓力和耐力[14],结果显示,老龄HIIT组大鼠耐力及抓力均高于老龄安静组。这与Seldeen 等[18]研究结果一致,16 周HIIT 能使老龄大鼠抓力、耐力、步速分别增加10.9%、32.6%和107%。人体研究同样证实,6 周HIIT 干预使老年人的内脏脂肪和脂肪百分比明显降低,有氧适能和无氧能力显著增强[21]。Bell 等[17]比较了HIIT 与抗阻训练及持续性有氧训练对老年人骨骼肌蛋白质合成的影响,其结果表明,HIIT对于增强老年人肌力和骨骼肌蛋白质合成率的效果最佳,尤其对于骨骼肌肌浆网内蛋白质合成速率的提升效果强于抗阻训练[17]。近年研究进一步证实,HIIT 兼具增强老年人骨骼肌线粒体氧化功能和骨骼肌蛋白质合成的作用[19]。本研究也发现,尽管老龄MICT 组大鼠耐力和骨骼肌指数显著增加,但抓力和体成分的变化无统计学差异。提示,与MICT 相比,HIIT 能更有效地减少老龄大鼠的脂肪堆积,增加骨骼肌抓力,从而延缓骨骼肌减少症发生。
衰老自由基学说认为,衰老进程中机体呈现出的抗氧化能力减弱和氧化能力增强会引起脂质、蛋白质和DNA 氧化损伤,导致多种组织和系统功能失调,机体整体水平表现出衰老状态[29]。业已证实,氧化应激在骨骼肌减少症、骨骼肌收缩机能失调、线粒体代谢失调和肌细胞凋亡等过程中发挥了重要作用[29]。因此,本研究通过测定各组大鼠血浆SOD2、MDA、4-HNE 和8-OHdG 水平来评价体内氧化应激状态。作为机体预防性的抗氧化系统重要成员,SOD2通过清除活性氧保护细胞免受氧化损伤,而体内SOD2活性下降将导致脂质、蛋白质和DNA 氧化损伤升高[29]。血浆MDA 和4-HNE水平常被作为脂质氧化损伤标记物[26]。MDA是体内脂质过氧化的终产物,而4-HNE是脂质过氧化形成MDA 过程中的中间产物。与MDA 相比,4-HNE 具有较高的活性,可与蛋白质分子和DNA 交联,导致蛋白质功能障碍和DNA 突变;8-OHdG 是活性氧直接与DNA 反应而导致DNA 链断裂和碱基异常修饰形成的DNA损伤产物,是目前公认的评价DNA氧化损伤敏感的生物标志[30]。本研究结果显示,与成年对照大鼠相比,老龄安静组大鼠血浆4-HNE、MDA 和8-OHdG 水平增加,提示老龄大鼠机体的氧化-抗氧化稳态失衡导致细胞内的脂质过氧化和DNA 氧化损伤,这与前人的研究结果一致[30]。本研究进一步发现,老龄MICT组和HIIT组大鼠骨骼肌SOD2活性高于老龄安静组,而老龄HIIT组血浆MDA和骨骼肌MDA、4-HNE和8-OHdG含量低于老龄MICT 组,提示尽管长期MICT 和HIIT 均能降低老龄大鼠骨骼肌氧化应激水平,但HIIT 对抑制老龄大鼠骨骼肌脂质氧化和DNA 氧化损伤效果优于单纯的MICT。本研究结果也显示,大鼠耐力与血浆8-OHdG呈负相关(r=-0.72),说明老龄大鼠DNA的氧化损伤增加与其耐力水平衰减有关,而降低衰老导致的氧化应激水平可提高机体有氧耐力[31]。
衰老相关氧化应激和异位脂肪堆积可加速多种组织炎症因子的分泌,如hs-CRP、IL-6、肿瘤坏死因子-α等,炎症因子分泌增加又促进衰老骨骼肌蛋白水解和肌细胞凋亡[32]。hs-CRP是机体由于创伤或炎症造成各种组织损伤时肝脏合成并释放进入血浆的急性相蛋白,是一种高度灵敏的炎性标志物。IL-6 是炎症起始阶段的一个重要的炎症调控因子,能促进包括hs-CRP等急性相蛋白合成和释放。作为抗炎因子,IL-10可抑制IL-6 和hs-CRP 的分泌来发挥其抗炎效应,故IL-6/IL-10 比值可作为评价机体慢性低度炎症的重要参数[33]。本研究发现,尽管老龄大鼠血浆IL-6 水平并未显著增加,但hs-CRP 明显高于成年大鼠,说明老龄大鼠呈现慢性系统性炎症状态。这与前人的研究结果类似[34]。运动所具有的抗炎作用是其有效防治骨骼肌减少症的重要机制。尽管本研究发现HIIT并未影响老龄大鼠血浆IL-6分泌,但hs-CRP浓度显著降低及IL-10浓度和IL-6/IL-10比值显著提高,而老龄MICT组大鼠炎症水平无显著性变化,提示,与传统MICT相比,HIIT能更好地缓解衰老相关的慢性低度炎症。国外横断面研究表明,健康老年人血浆中hs-CRP 水平升高,且与内脏脂肪含量、糖脂代谢紊乱风险[35]和血浆氧化应激水平呈正相关[36]。本研究结果也显示,血浆中hs-CRP 含量与体脂%、血浆4-HNE和MDA水平均呈正相关。上述结果提示,HIIT可能通过降低老龄大鼠血浆hs-CRP分泌和IL-6/IL-10 比值来抑制慢性低度系统炎症,该过程可能与脂肪含量的降低和氧化应激的缓解有关。
脂肪组织作为体内重要的内分泌器官,可通过分泌多种脂肪细胞因子来调控骨骼肌和肝脏的胰岛素敏感度、糖脂代谢、免疫及炎症反应。老年人脂肪细胞因子分泌功能失调与各种组织细胞的衰老密切相关[37]。作为脂肪细胞分泌的重要的多肽类激素,瘦素具有向神经中枢传递机体营养状况和脂肪堆积信息的功能,进而通过抑制脂肪合成、增加葡萄糖摄取、促进脂肪分解和氧化来降低体内脂肪的沉积[10]。Hsu等[38]发现,有氧运动可以增加老龄大鼠血浆瘦素含量和瘦体重百分比。本研究表明,8 个月HIIT 组干预后大鼠血浆瘦素含量显著高于老龄安静组,且血浆瘦素含量与体脂%呈负相关(r=-0.58),提示,HIIT 可能通过促进老龄大鼠瘦素分泌来降低体内脂肪的沉积。然而,瘦素是否通过抑制老龄大鼠脂肪合成、促进脂肪酸的氧化分解来降低脂肪含量仍需进一步研究。
脂联素是脂肪分泌最丰富的内源性生物活性多肽。作为一种胰岛素增敏激素,脂联素能够经血液循环作用于多种组织的脂联素特异性受体,从而增强相应细胞的胰岛素信号通路敏感性,在2型糖尿病、肥胖症等代谢性疾病中发挥积极作用[26]。然而,基于老年人的横断面研究显示,血浆脂联素增加与老年人摔倒和残疾风险升高[39]、骨骼肌减少症患者的肌肉力量和耐力降低[12,39]有关。本研究结果也显示,老龄大鼠血浆脂联素显著高于成年大鼠,这也得到了动物实验证实[12]。文献表明,血浆脂联素与健康老年人肌纤维横断面积呈负相关[40]。肌细胞细胞膜上的脂联素特异性受体1/2表达减少导致机体脂联素功能性抵抗,后者使得血浆脂联素含量增高,进而导致骨骼肌收缩功能下降、肌细胞线粒体代谢功能紊乱、氧化应激和骨骼肌萎缩[13]。本研究结果显示,8 个月HIIT 和MICT 均能降低老龄大鼠血浆脂联素含量。Martinez等[41]研究也证实,HIIT 能抑制肥胖大鼠皮下脂肪组织脂联素的分泌,从而降低血浆脂联素含量;同时,HIIT也促进骨骼肌脂联素受体基因表达和改善骨骼肌脂联素抵抗,进而改善肥胖大鼠的骨骼肌代谢功能和收缩机能。本研究中HIIT和MICT 是否能增强老龄大鼠骨骼肌脂联素/特异性受体的信号通路还有待进一步研究。尽管血浆瘦素、脂联素和炎症因子与骨骼肌减少症的发生有关[8,9,11],但本研究中血浆瘦素、脂联素、IL-6 和IL-10 是由脂肪、骨骼肌还是由其它组织所分泌尚不清楚[12]。总之,上述细胞因子分泌的组织特异性特征有待进一步研究揭示。
4 结论
高强度间歇运动显著改善增龄大鼠体成分和增加骨骼肌指数;高强度间歇运动可能通过促进瘦素分泌来改善增龄大鼠的体成分;高强度间歇运动降低增龄大鼠慢性系统性炎症和机体氧化应激水平。

