趋化因子CXCL13通过诱导星形胶质细胞活化参与骨癌痛的发生
卜慧莲,郭海明,焦鹏飞,徐富兴,樊肖冲
(1.郑州大学第一附属医院疼痛科,河南 郑州 450052;2.郑州大学第一附属医院麻醉科,河南 郑州 450052)
骨癌痛是由肿瘤发生骨转移引起的剧烈慢性疼痛,也是临床上的一个难治性问题,容易发生骨转移的恶性肿瘤有乳腺癌、肺癌、前列腺癌等。骨癌痛的发生机制尚不完全明确,主要包括外周敏化和中枢敏化。趋化因子在骨癌痛中枢敏化中发挥着重要作用,本课题组的前期研究结果显示,骨癌痛大鼠脊髓内趋化因子C-X-C配体13(chemokine C-X-C motif ligand 13, CXCL13)的表达明显升高,鞘内注射CXCL13重组蛋白使其外源性表达升高,可导致大鼠痛阈的快速下降,提示其具有致痛作用,而鞘内注射小干扰核糖核酸(small interference ribonucleic acid, siRNA)特异性抑制脊髓内趋化因子C-X-C受体5(chemokine C-X-C motif receptor 5, CXCR5)的表达,可对抗骨癌痛的发生过程[1],CXCR5主要表达于星形胶质细胞[2],我们推测CXCL13可能通过干预星形胶质细胞活化参与骨癌痛的发生,本研究拟通过动物实验和细胞实验2个层面,观察CXCL13对星形胶质细胞活化的影响,并探讨其在骨癌痛发生中的作用。
1 材料与方法
1.1 实验材料雌性SD成年大鼠及SD大鼠乳鼠均购自郑州大学实验动物中心;胎牛血清、DMEM高糖培养基购自美国Gibco公司;CXCL13重组蛋白购自美国Peprotech公司;CXCR5 siRNA和对照RNA购自上海吉凯基因有限公司;星形胶质细胞抑制剂-氟代柠檬酸购自美国Sigma公司;星形胶质细胞标志物兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体和Cy3-标记羊抗兔二抗购自美国Millipore公司;Transwell细胞迁移试剂盒购自美国BD公司;EdU细胞增殖试剂盒购自美国GeneCopoeia公司。
1.2 实验方法
1.2.1 骨癌痛 大鼠痛阈测定将大鼠分为骨癌痛组、假手术组和正常对照组,参照既往实验方法[3],将大鼠Walker256乳腺癌细胞注射至SD大鼠右侧胫骨骨髓腔内,假手术组仅注射生理盐水,在建模后1、3、7、14和21 d采用Von-frey丝测机械痛,分别采用1、2、4、6、8、10和15gVon-Frey丝垂直刺激大鼠右侧足底,当大鼠出现突然撤爪、舔爪等表现时即为疼痛阳性反应,记录出现阳性反应的最低克数,重复3次,取最低值为机械缩爪阈值(paw withdrawl threshold,PWT)。
1.2.2 星形胶质细胞活化 对骨癌痛大鼠痛阈影响的测定建立大鼠骨癌痛模型,将大鼠分为生理盐水组、氟代柠檬酸组、CXCL13重组蛋白组和氟代柠檬酸-CXCL13重组蛋白组,自建模后1 d开始分别鞘内注射生理盐水10 μL、氟代柠檬酸1nmol和(或)CXCL13重组蛋白20 ng,在建模后1、3、7、14和21 d的给药后1 h后测定并记录PWT值。
1.2.3 测定CXCR5 siRNA 对骨癌痛大鼠脊髓内星形胶质细胞活化的影响将大鼠分为假手术组、骨癌痛组、CXCR5 siRNA组和对照RNA组,分别给大鼠鞘内注射CXCR5 siRNA(2×106IU)和对照RNA(2×106IU),在病毒注射后7 d建立骨癌痛模型,在建模后14 d处死大鼠,多聚甲醛固定后取脊髓腰膨大,切片30 μm厚度,破膜后孵兔抗GFAP一抗,4 ℃过夜,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤后孵Cy3标记的羊抗兔二抗,室温孵育2 h,PBS洗涤后封片,采用德国Leica正置荧光显微镜拍照,观察各组星形胶质细胞活化状态。
1.2.4 原代星形胶质细胞分离和培养 将出生24 h内的SD大鼠乳鼠消毒后取大脑皮层,用质量分数0.25%胰蛋白酶消化10 min,使组织消化为细胞后,接种到多聚赖氨酸包被的25 cm2培养瓶中,在37 ℃细胞培养箱中使用含体积分数10%胎牛血清的DMEM培养基培养,24 h后全量换液,此后每隔3 d半量换液1次,细胞培养10~14 d左右,可见细胞长满瓶底,并出现分层现象,底层细胞充分铺展,接触紧密,多为扁平,具有多个突起的大细胞(星形胶质细胞),而上层细胞多为类圆形,遮光性强,边缘有毛刺样突起(以小胶质细胞为主),手摇培养瓶3~5 min,使附着于星形胶质细胞表面的细胞脱落下来,弃去培养基,即可去除小胶质细胞及其他杂细胞。
1.2.5 Transwell细胞迁移实验 将星形胶质细胞分为生理盐水组、CXCL13重组蛋白10 ng·mL-1组、CXCL13重组蛋白20 ng·mL-1组、CXCL13重组蛋白50 ng·mL-1组,当培养的星形胶质细胞长到约90%时,弃去培养基后洗涤2次。胰酶消化后加入少量含血清的培养基终止消化,离心5 min。采用移液枪轻轻吹打培养皿底部细胞,将吹打下的细胞收集离心,弃去上清后重悬细胞并计数,然后稀释至5×106·mL-1,取0.1 mL细胞悬液,分别加入Transwell上室,在Traswell下室加入0.6 mL培养基(分别含生理盐水,10、20和50 ng·mL-1CXCL13重组蛋白),在培养箱中37 ℃条件下迁移24 h。将Transwell小室膜上下的细胞用PBS洗涤3次,每次5 min。采用质量分数4%多聚甲醛固定15 min。PBS洗涤3次。将小室上层细胞采用医用棉签轻轻擦拭,留下小室下层细胞HE染色,染色后光学显微镜下观察计数,计算相对于生理盐水组增殖率。
1.2.6 EdU细胞增殖实验 将星形胶质细胞分为CXCL13重组蛋白10 ng·mL-1组、CXCL13重组蛋白20 ng·mL-1组、CXCL13重组蛋白50 ng·mL-1组,参照EdU细胞增殖试剂盒说明,将细胞以4×104个/孔的密度接种于铺有多聚赖氨酸包被玻片的24孔板中,于37 ℃培养箱生长黏附5 h,用PBS洗涤后,分别加入生理盐水,10、20和50 ng·mL-1CXCL13重组蛋白,于37 ℃培养箱内培养24 h,然后在含有10 μmol·L-1EdU培养基中孵育2 h,随后用PBS洗涤,用质量分数4%多聚甲醛固定30 min,加入50 μL 2 g·L-1甘氨酸中和多聚甲醛,PBS洗涤,破膜后加入100 μL染色反应液,避光室温孵育30 min,弃去染色反应液,加入100 μL渗透液,PBS洗涤,丢弃渗透液,加入100 μL甲醇加强5 min,PBS洗涤,加入Hoschst反应液,避光孵育30 min,PBS洗涤,荧光显微镜观察拍照,计算细胞增殖率。
2 结果
2.1 各组大鼠PWT变化自建模后3 d开始,与假手术组和正常对照组比较,骨癌痛组大鼠PWT值开始逐渐下降(P<0.05),提示骨癌痛的发生。见图1。
2.2 抑制星形胶质细胞对大鼠痛阈及CXCL13诱导的痛觉过敏的影响建模后1、3和7 d,与生理盐水组比较,CXCL13重组蛋白组大鼠的痛阈明显下降(P<0.05),而在14 d和21 d,2组间痛阈差异无统计学意义(P>0.05),提示CXCL13具有诱导痛觉敏化作用,可以加快骨癌痛的发生。在建模后3d开始,生理盐水组和氟代柠檬酸-CXCL13重组蛋白组大鼠痛阈开始下降(P<0.05);在建模后7、14和21 d,氟代柠檬酸-CXCL13重组蛋白组痛阈下降幅度小于生理盐水组(P<0.05);而氟代柠檬酸组大鼠的痛阈在各时间点无明显变化(P>0.05)。这提示氟代柠檬酸干预可预防骨癌痛的发生,并对抗CXCL13重组蛋白的致痛作用。见图2。
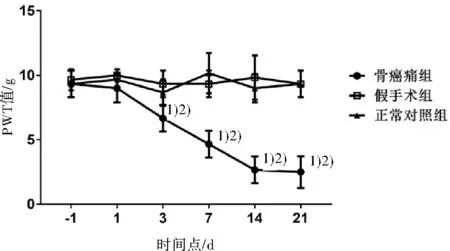
图1 建模后各组大鼠PWT值的变化
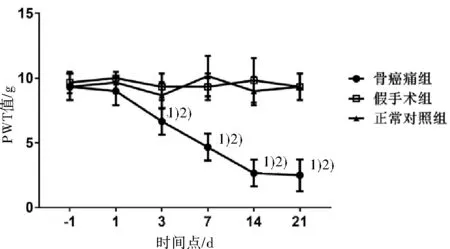
图2 鞘内注射氟代柠檬酸和(或)CXCL13重组蛋白对骨癌痛大鼠痛阈的影响
与生理盐水组相比较,1)P<0.05;与CXCL13重组蛋白组相比较,2)P<0.05
2.3 CXCR5 siRNA对骨癌痛大鼠脊髓内星形胶质细胞活化的影响预先给大鼠鞘内注射CXCR5 siRNA减少其表达后,在建模后14 d脊髓内采用免疫荧光检测GFAP表达情况。结果显示骨癌痛组和对照RNA组大鼠脊髓内星形胶质细胞明显活化,表现为数量增加,胞体肥大,突触增粗等,而假手术组和siRNA组大鼠星形胶质细胞活化明显较少,表现为细胞数量减少,胞体较小,突触较细等。见图3。
2.4 CXCL13重组蛋白对原代星形胶质细胞迁移和增殖的影响通过Transwell实验观察不同浓度CXCL13重组蛋白对原代星形胶质细胞迁移的影响,并采用EdU方法检测CXCL13重组蛋白对原代星形胶质细胞增殖的影响,结果发现,与生理盐水组比较,10、20和50 ng·mL-1CXCL13重组蛋白均可以使星形胶质细胞迁移的数量增加,且呈递增趋势,说明CXCL13可刺激星形胶质细胞的迁移(图4)。与生理盐水组比较,10、20和50 ng·mL-1CXCL13重组蛋白均可增加星形胶质细胞增殖率,而20和50 ng·mL-1干预的星形胶质细胞的增殖率大于10 ng·mL-1,说明CXCL13可诱导星形胶质细胞的增殖,且具有一定的剂量依赖性(图5)。
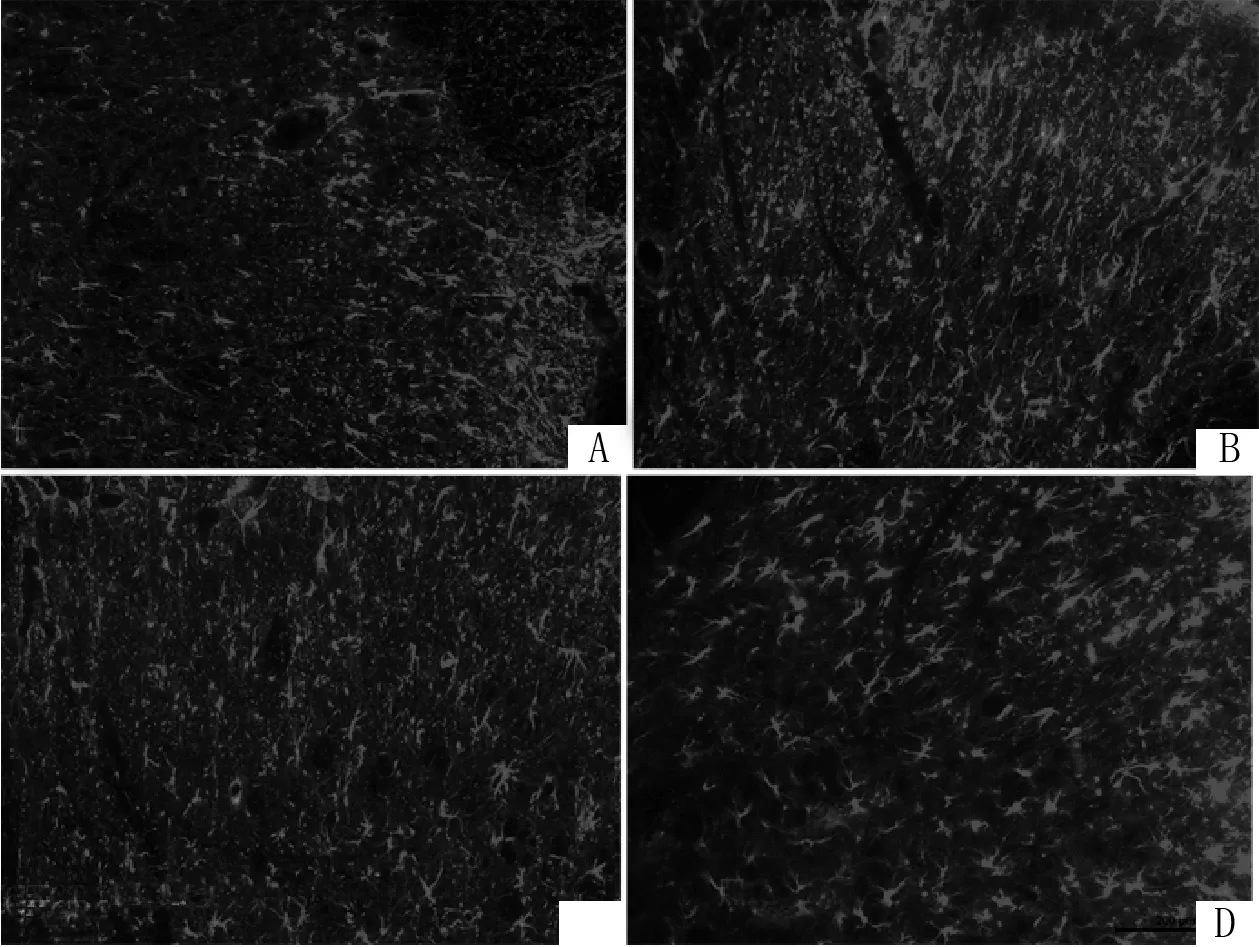
图3 各组大鼠脊髓内星形胶质细胞活化状态
假手术组(A)和siRNA组(C)大鼠星形胶质细胞活化明显较少,表现为细胞数量减少,胞体较小,突触较细;骨癌痛组(B)和对照RNA组(D)大鼠脊髓内星形胶质细胞明显活化,表现为数量增加,胞体肥大,突触增粗等

图4 各组原代星形胶质细胞的迁移情况
A:生理盐水组;B:CXCL13重组蛋白10 ng·mL-1组;C:CXCL13重组蛋白20 ng·mL-1组;D:CXCL13重组蛋白50 ng·mL-1组
3 讨论
骨转移是晚期恶性肿瘤患者常见的合并症,通常会影响正常骨骼功能,从而使患者日常活动受限,此外,肿瘤骨转移常引起剧烈疼痛,严重影响晚期肿瘤患者生活质量。骨癌痛是由神经病理、炎性机制、坏死等多因素综合导致的[4],其发生机制比较复杂,包括外周敏化和中枢敏化,外周敏化机制包括肿瘤的高代谢生长和对周围组织的破坏,可使局部形成酸性微环境,可直接刺激伤害性感受器产生疼痛信号,此外,局部微环境的改变可导致骨内成骨/破骨的平衡失调,使溶骨细胞活性增强,分泌一系列炎性因子,进而激活痛觉感受器,产生疼痛信号[5]。其中枢机制包括多方面改变,比如骨转移癌时,内源性阿片系统发生了改变,不同大小背根节神经元中μ阿片受体数目明显减少,可使阿片类药物镇痛作用减弱和阿片类药物需要量增加;脊髓星形胶质细胞活化;谷氨酸、P物质和兴奋性氨基酸等神经递质的释放;脊髓内广动力范围神经元的敏化;离子通道的功能改变;脊髓内兴奋性突触重塑;包括趋化因子在内的促炎性细胞因子的表达和释放等[6-8],这些细胞和分子层面的改变可使脊髓疼痛传入通路易化,从而发生中枢敏化。
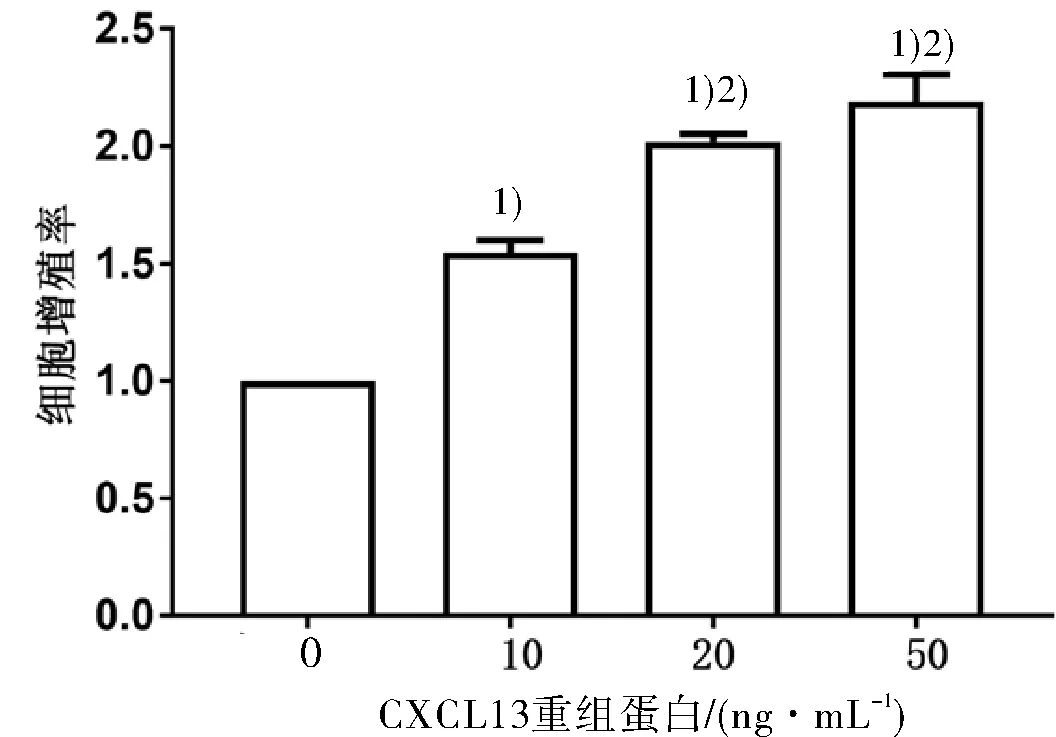
图5 各组原代星形胶质细胞增殖率
与生理盐水组比较,1)P<0.05;与CXCL13重组蛋白10 ng·mL-1组比较,2)P<0.05
趋化因子是一类相对分子质量约10 000的小分子细胞因子,其主要功能是介导免疫功能,可诱导正常的白细胞迁移,也可参与炎性反应。在病理情况下,趋化因子还可参与炎性疾病的发生过程[9];调节胚胎发育、创伤修复、慢性炎症和恶性肿瘤的生长过程中的血管发生;参与肿瘤转移和增殖过程[10];此外,某些趋化因子(如CXCL8)还可对阿尔兹海默病引起的神经病变具有保护作用[11]。近几年的研究发现,趋化因子在骨癌痛的发生过程也发挥着重要作用,比如CX3CL1、CXCL10、CXCL13、CCL2和CCL5等趋化因子,通过作用于脊髓内小胶质细胞、星形胶质细胞或神经元表面的趋化因子受体,直接参与骨癌痛的发生过程,趋化因子介导疼痛的过程非常迅速,在动物实验中,给予趋化因子重组蛋白可在几分钟内使动物的痛阈明显下降[3, 12-14],本研究中CXCL13重组蛋白可在建模后1 d使骨癌痛大鼠的痛阈下降,加快骨癌痛的形成,说明趋化因子本身就是一个致痛分子。
在骨癌痛模型中,脊髓内星形胶质细胞可发生形态和分子学活化改变,其具体形态包括胞体肥大、突触增粗和细胞数量增多,其分子层面改变包括IL-1、IL-6和TNF-α等分子的释放,趋化因子通过结合星形胶质细胞表面的受体,进而启动细胞内的活化信号通路,释放炎性因子,作用于神经元,从而促使骨癌痛的形成[15-16]。在本研究中,通过干预CXCL13-CXCR5通路,可对星形胶质细胞的活化、增殖和迁移产生直接作用,说明CXCL13参与骨癌痛的发生可能通过星形胶质细胞活化来完成,但其具体的下游机制仍需进一步研究。综上所述,趋化因子CXCL13通过激活星形胶质细胞活化参与骨癌痛的发生过程,本研究为骨癌痛的镇痛治疗提供了一个新的治疗靶点。

