地诺单抗对骨巨细胞瘤局部血流和肿瘤学预后的影响
杨勇昆 徐海荣 黄真 张文 丁宜 牛晓辉
骨巨细胞瘤是具有局部侵袭性的原发良性骨肿瘤,约占全部原发良性骨肿瘤的20%[1-2]。骨巨细胞瘤中的多核巨细胞与破骨细胞在形态和促进骨吸收的功能方面相似[3]。地诺单抗是一种新型RANKL单克隆抗体,可以与RANKL特异性结合从而阻断RANKL-RANK通路,干扰破骨细胞的分化,起到抑制破骨细胞介导的骨破坏作用。有文献报道地诺单抗逐渐被广泛应用于难治性骨巨细胞瘤的治疗[4-6]。有研究结果显示,术前应用地诺单抗治疗可以使肿瘤边界更为清晰,并可缩小肿瘤体积,可能将不可切除的肿瘤转化为可切除肿瘤,从而为治愈患者提供机会。将地诺单抗应用于骶骨或骨盆等解剖结构复杂部位的肿瘤,也逐渐成为一种减小手术创伤的新型治疗方式[7-8]。应用地诺单抗治疗骨巨细胞瘤引起的变化包括骨皮质和软骨下骨增厚、肿瘤边界清晰、新生骨形成和病理骨折愈合等[9-10]。该药物的应用在某些病例中还可降低手术级别,如将原本需要切除的肿瘤转变为可刮除的肿瘤,起到保留关节和提高术后功能的作用[4,9]。但用药导致的病灶内分隔增多和显著硬化是否会增加刮除手术的难度也值得关注。如果术中不能将硬化成分完全去除,术后复发风险是否会增加需要进一步研究证实。手术治疗骶骨和骨盆骨巨细胞瘤术中大量失血导致的相关风险较大,术前应用地诺单抗是否会降低肿瘤局部血流有待研究。肿瘤组织的微血管密度(microvessel density,MVD)和增强CT影像可用来评价肿瘤局部血流。如果病灶血管和局部血流增加,其增强CT值也会相应增加[11-12]。本研究的目的是探索上述有待解决的问题,观察包括应用地诺单抗治疗骨巨细胞瘤后肿瘤局部血流、手术计划级别和手术难度的变化以及肿瘤学预后。
资料与方法
一、资料
本研究为治疗前后自身对照研究。病例纳入标准:成年人或骨成熟的12岁以上青少年;病理学检查结果为骨巨细胞瘤;存在可测量的骨病灶;符合Campanacci分期标准的3期[1];不可手术切除或关节等重要结构术后不能保留。病例排除标准:接受过动脉栓塞、放射治疗或其他可能影响肿瘤局部血流的治疗;存在骨坏死或骨髓炎病史;孕妇。纳入2014年6月至2017年3月北京积水潭医院骨肿瘤科收治的患者20例,男11例,女9例,平均年龄31.6(18~48)岁。其中9例肿瘤位于骶骨或骨盆(骶骨7例,髂骨和坐骨各1例),11例肿瘤位于肢体骨(胫骨和桡骨各3例,肱骨2例,股骨、腓骨和尺骨各1例)。
二、方法
1.CT检查和评价:患者在治疗前接受增强CT检查。药物治疗方案为地诺单抗120 mg,每4周1次,初次用药后第8天和第15天各增加1次用药。治疗12周后,使患者在同一台CT机上再次接受增强CT检查,并对病灶进行重新评估。如果治疗前的不可切除病灶已转化为可切除病灶,或关节等重要结构已转变为术后可以保留,则停止药物治疗行手术治疗。如果未达到上述停止药物治疗标准,则继续用药。本研究组患者术前接受药物治疗的平均时间为5.1(3~12)个月。
根据可评价病灶的大小,选取4~8个CT层面进行测量。分别在药物治疗前后测量病灶相同区域的CT值,同时测量病灶相同侧面主要血管的CT值。CT强化率=增强CT值/平扫CT值。以血管的CT强化率为参照,比较药物治疗前后的病灶。
2.免疫组织化学检查:分别计算药物治疗前后肿瘤组织的MVD。采用CD34抗体行免疫组织化学染色,由经验丰富的病理医生进行评价[13-14]。在×40和×100倍显微镜下观察并确认MVD显著表达的热区,对每个标本选取表达最高的4个热区进行评价,在×200倍显微镜下计数MVD。将被其他组织分割且具有独立管腔的染色阳性血管计为1个血管。以不同热区MVD的平均值作为该组织的MVD结果。
3.数据收集和随访:记录药物治疗前后的相关指标数据如下:临床获益;严重不良反应(3~4级);CT强化率;手术计划;手术难度;组织学改变;局部复发。对术后患者每3个月进行1次随访。随访项目包括体格检查,局部X线、超声和CT以及胸部CT。
4.统计学处理:采用SPSS 19.0软件对数据进行统计学处理。连续变量比较采用均值检验,非连续变量比较采用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。
结 果
一、临床结果
本研究组患者接受药物治疗后均有临床获益,包括疼痛减轻、肢体活动度增加和肢体功能改善等。未观察到严重不良反应。
二、CT评价结果
本研究组患者接受药物治疗前主要血管的平均平扫CT值和平均增强CT值分别为44.1(38.0~51.0)Hu和136.3(94.0~170.0)Hu,平均CT强化率为3.10(1.92~4.56);药物治疗后主要血管的平均平扫CT值和平均增强CT值分别为43.4(35.0~55.0)Hu和138.1(93.0~158.0)Hu,平均CT强化率为3.18(1.90~4.70)。药物治疗前后的差异均无统计学意义(t=0.152,P=0.683)。药物治疗前后的CT检查结果具有可比性。
本研究组患者接受药物治疗前病灶的平均平扫CT值和平均增强CT值分别为45.9(33.0~65.0)Hu和92.7(50.0~150.0)Hu,平均CT强化率为2.02(1.22~4.05);药物治疗后病灶的平均平扫CT值和平均增强CT值分别为84.7(32.0~357.0)Hu和118.2(37.0~380.0)Hu,平均CT强化率为1.40 (1.02~2.31)。用药后平扫CT值增高(t=9.761,P=0.012),CT强化率降低 (t=19.322,P<0.001),差异均有统计学意义。药物治疗后病灶内硬化增加并有新生骨形成(图1,2)。
本研究组患者接受药物治疗前后骶骨或骨盆病灶的平均CT强化率分别为2.51和1.48(F=18.650,P=0.001);药物治疗前后肢体病灶的平均CT强化率分别为1.62和1.33(F=5.019,P=0.030)。骶骨或骨盆病灶的CT强化率下降程度较肢体病灶更为显著(F=10.509,P=0.015)。
三、免疫组织化学检查结果
本研究组患者接受药物治疗前后肿瘤组织平均MVD分别为221.9(68~324)个和106.4(21~197)个,差异有统计学意义(F=36.103,P<0.001)(图3)。病理学检查结果示药物治疗后破骨细胞样巨细胞几乎消失,单核细胞显著减少(图3)。药物治疗后的大体标本显示肿瘤组织显著坚实硬化,完全不同于典型的骨巨细胞瘤。
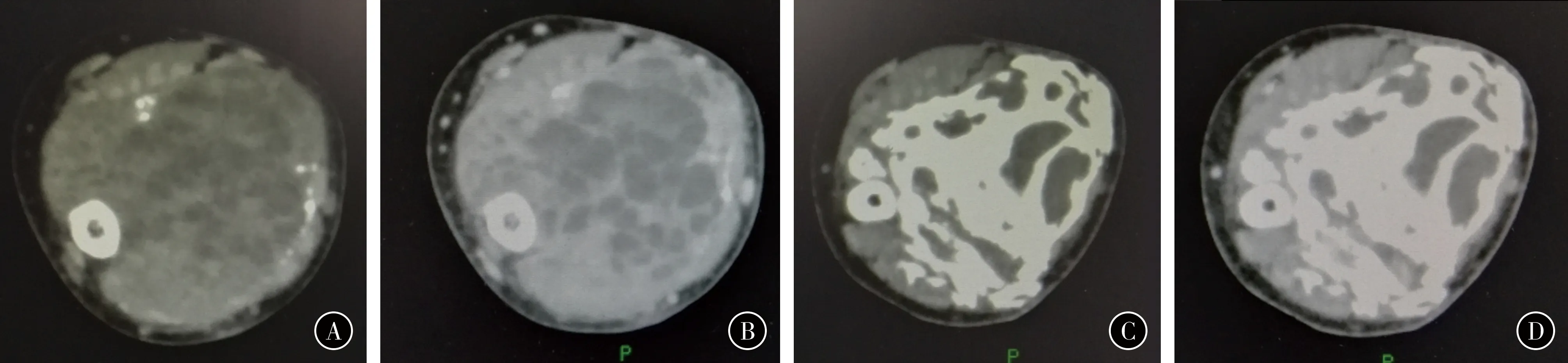
图1患者女,28岁。桡骨远端骨巨细胞瘤,外院刮除术后复发ACT示病灶范围大,桡骨远端骨结构几乎完全被破坏,肿瘤与周围组织边界不清B接受药物治疗前增强CT示肿瘤强化明显C接受药物治疗6个月后,CT示病灶内硬化明显,边缘有新生骨形成骨壳D接受药物治疗6个月后,增强CT示肿瘤强化程度降低
四、手术计划和结果
11例肢体肿瘤的初始手术计划如下:2例因肿瘤边界不清无法行手术治疗,7例行关节置换,2例行截肢。药物治疗后该11例患者的手术计划均有改变:2例不可行手术治疗者可行切除手术,7例关节置换者转变为保留关节的刮除术, 2例行截肢者转变为肿瘤切除手术。7例骶骨或骨盆肿瘤最终的手术治疗方案均为可避免较大结构和功能损伤的刮除术。药物治疗后肿瘤显著硬化,虽然周边形成新的骨壳,但病灶内有骨性分隔和新生骨形成,反而增加了刮除手术的难度,尤其是骶骨肿瘤(图2)。病灶周缘的硬化使得边界更为清晰,便于行切除手术,这一点在破坏范围较大且边界不清的肢体肿瘤病例尤为明显(图1)。
五、术后肿瘤复发结果
术后平均随访21.5(12~32)个月。5例患者出现肿瘤复发,复发率为27.8%,包括4例骶骨肿瘤(复发率为66.7%)和1例肢体肿瘤(复发率为9.1%)。平均复发时间为术后7.8(5~12)个月。4例复发骶骨肿瘤患者再次接受手术治疗,术后未见再复发。1例复发肢体肿瘤为尺骨切除后的多发软组织复发。再行药物治疗6个月后,患者临床症状缓解,CT示多发软组织病灶,再次行手术切除。但术后再次出现多发软组织复发,患者接受截肢手术。继续随访显示患者肺多发转移瘤进展。
讨 论
最新研究结果显示,应用地诺单抗治疗可以改善骨巨细胞瘤患者的临床症状,且药物的耐受性和安全性良好[15-18]。本研究组患者接受地诺单抗治疗后均有临床获益,包括疼痛减轻以及肢体活动度增加和功能改善等。一项纳入35例复发或不可切除骨巨细胞瘤患者的Ⅱ期临床试验结果显示,地诺单抗治疗使超过80%的病例得到显著效果和临床获益,如疼痛减轻和肢体功能改善[9]。另一项研究结果显示,脊柱骨巨细胞瘤患者接受超过6个月的地诺单抗治疗后,疼痛和神经压迫症状显著缓解[19]。
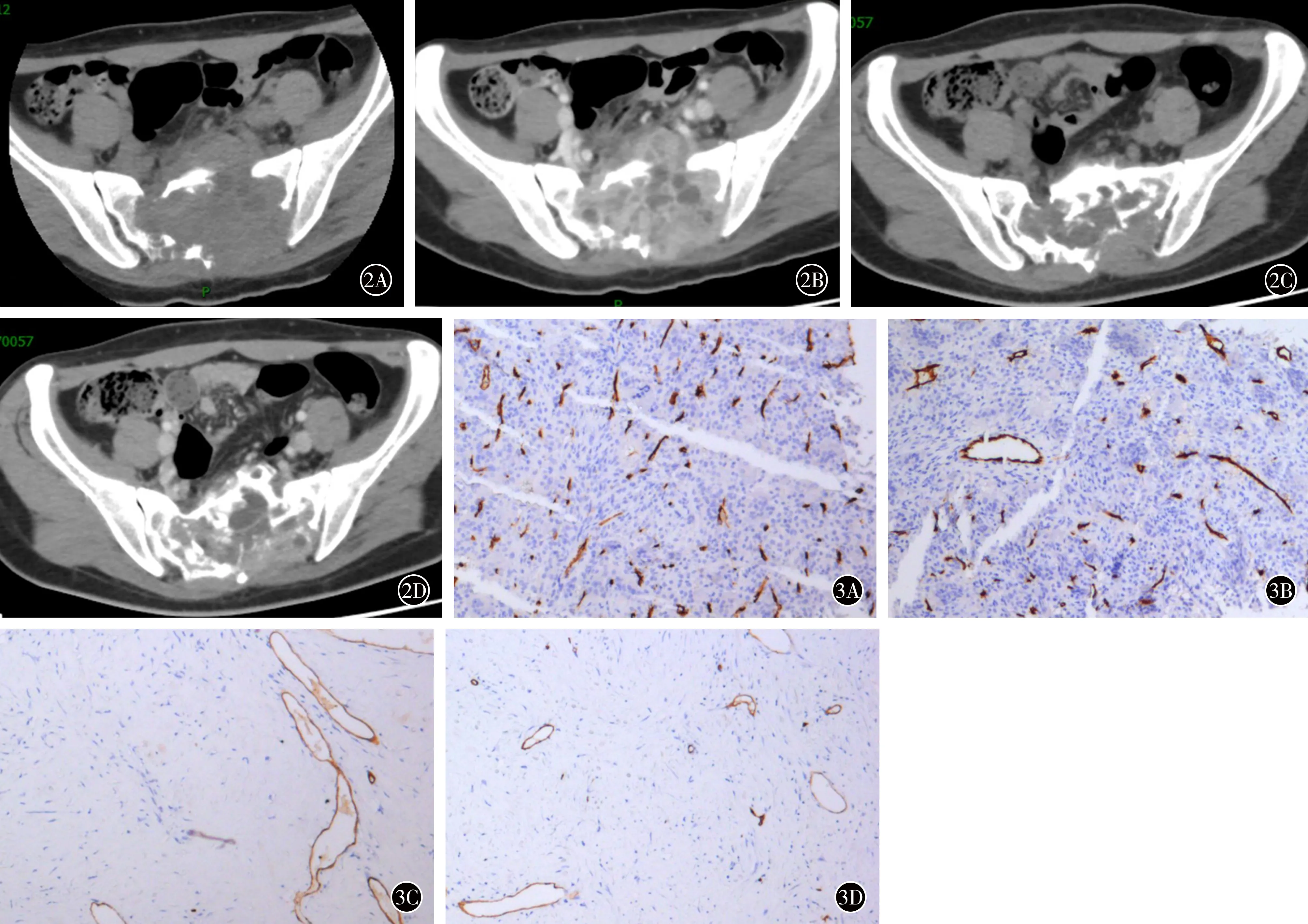
图2患者女,24岁。骶骨骨巨细胞瘤A接受药物治疗前CT示肿瘤破坏范围大,骶骨前侧和后侧皮质均不完整,肿瘤包块向前突破进入盆腔B接受药物治疗前增强CT示肿瘤强化明显C接受药物治疗9个月后,CT显示骶骨前侧形成硬化骨壳,病灶内硬化明显D接受药物治疗9个月后,增强CT示强化程度降低图3接受药物治疗前后的肿瘤组织CD34抗体免疫组织化学检查结果(HE×10)A,B接受药物治疗前肿瘤组织标本示密集的单核基质细胞中夹杂大量多核巨细胞,符合骨巨细胞瘤的组织学特征,并可见大量CD34抗体染色的微血管C,D接受药物治疗后术中获得肿瘤组织标本示破骨细胞样多核巨细胞几乎完全消失,单核细胞显著减少,CD34抗体染色的微血管显著减少
骨巨细胞瘤局部血流丰富,尤其是位于骶骨或骨盆的累及范围较大的肿瘤,手术治疗风险较高,术中失血量大可能严重干扰手术操作且影响围手术期安全。CT强化率可以反映肿瘤的局部血流状态,甚至可提示部分肿瘤的生物性特点和预后[20-21]。本研究通过增强CT评价地诺单抗对骨巨细胞瘤的治疗效果,结果显示经药物治疗后肿瘤的CT强化率显著降低,这意味着肿瘤局部血流的减少。这一阳性结果得到了MVD检测结果的支持。其中骶骨或骨盆肿瘤的CT强化率下降更为显著。经药物治疗后的骶骨肿瘤术中出血显著减少。因此,术前药物治疗在骶骨或骨盆肿瘤中显现出更好的降低肿瘤局部血流的效果。尽管CT强化率和MVD检查结果均提示肿瘤经药物治疗后局部血流减少,但相关机制尚不明确,可能与经药物治疗后破骨细胞样巨细胞几乎完全消失和单核细胞的显著减少相关,药物治疗前活跃的肿瘤组织已经被硬化的乏血供组织替代。一项针对复发或不可切除骨巨细胞瘤的Ⅱ期临床试验结果显示,经地诺单抗治疗后肿瘤内多核巨细胞几乎消失,单核细胞显著减少[6]。另一项研究也取得类似的结果,应用地诺单抗治疗骨巨细胞瘤6个月后,肿瘤内多核巨细胞和RANKL表达几乎消失[10]。
本研究结果显示,骨巨细胞瘤患者术前经地诺单抗治疗后可以使手术方案发生变化,即药物治疗后可将某些不可切除病灶转化为可切除病灶,或将原计划行切除术的病灶转化为可行保留重要结构的刮除术。一项包括222例骨巨细胞瘤患者的Ⅱ期临床试验结果显示,经超过1年的地诺单抗治疗后,96%原计划行关节置换的患者转变为可接受保留关节的刮除术[4]。既往文献报道,术前地诺单抗治疗在骨盆骨巨细胞瘤病例中有降低手术级别的效果[8]。本研究组中骶骨骨巨细胞瘤病例的研究结果提示,尽管应用地诺单抗治疗后可行损伤较小的刮除术,并可降低术中失血量,但这样的刮除术似乎缩小了原计划中的肿瘤去除范围。这种手术级别降低意味着没有完全去除病灶中的硬化成分,可能为术后肿瘤复发留下隐患[17,22]。
增强CT检查还显示药物治疗后病灶CT值显著增高,这提示病灶硬化的增加,使得肿瘤边界更为清晰,从而降低切除手术的难度。但病灶内硬化和骨性分隔的增加会增加刮除手术的难度,尤其是对于骶骨肿瘤病例。经药物治疗后病灶内新增加的骨性分隔有时难以与正常骨质相鉴别。从神经或血管上分离显著硬化的肿瘤病灶也较为困难。尽管新生成的骨壳便于术者在其范围内进行刮除,但可能包含肿瘤间质细胞的硬化壳可能成为停药后肿瘤复发的源泉[10]。本研究结果显示,在应用地诺单抗治疗骨巨细胞瘤的过程中间质细胞表现得非常安静,而一旦微环境中缺少地诺单抗,间质细胞会恢复增殖活性。既往研究结果显示,骶骨骨巨细胞瘤经刮除术治疗后的复发率为20%~40%[23-25]。而本研究组中骶骨肿瘤患者的复发率高达66.7%,在接受地诺单抗治疗后如此高的复发率与上述刮除手术中的困难相关。最新文献报道,准备行刮除手术的骶骨骨巨细胞瘤术前应慎用地诺单抗治疗[16]。一项前瞻性研究结果显示,术前接受地诺单抗治疗导致的皮质骨增厚和肿瘤基质硬化增加了判断肿瘤刮除范围的困难[10]。另外,对于骶骨肿瘤不可能做到类似于肢体肿瘤的扩大刮除,这也与其高复发率相关。
本研究通过对1例肢体骨巨细胞瘤术后复发病例的分析,发现在停止地诺单抗治疗后肿瘤复发和进展非常迅速,患者不得不接受截肢手术。尽管表现出难以控制的局部复发和肺转移灶的快速进展,病理学检查结果仍提示肿瘤没有恶变。文献中有骨巨细胞瘤经地诺单抗治疗后恶变的个案报道[4,9,26-28]。因此,应警惕地诺单抗治疗的安全性。
本研究存在一定局限性。第一,纳入病例相对少,由于骨巨细胞瘤发生率低,符合应用地诺单抗入组条件的病例少。第二,未设对照组,由于若将相同肿瘤条件的患者分为直接手术和先行辅助药物治疗两组,在患者知情同意和临床执行上存在困难。
综上所述,应用地诺单抗治疗骨巨细胞瘤可显著降低肿瘤局部血流,并可减少术中失血,对于部分病例可降低其手术级别。经药物治疗后肿瘤边界更为清晰,利于行切除手术。但是,在骶骨肿瘤刮除手术中增加的难度和较高的术后复发率应受到关注。根据肿瘤范围进行精确的术前设计和术中导航辅助可能有助于降低肿瘤复发率。对于应用地诺单抗治疗骨巨细胞瘤,如何选择适合的病例,确定合理的术前药物治疗时间和药物治疗后的手术时机以及停药后的反跳现象,均有待今后继续深入研究。

