自身免疫性肝炎的研究进展▲
范俊华 刘耿烽 吕小平
(广西医科大学第一附属医院消化内科,南宁市 530021)
【提要】 自身免疫性肝炎是一种肝脏慢性炎症性疾病,发病机制尚未阐明。随着人们对疾病认识及诊疗水平的不断提高,自身免疫性肝炎的发病率呈上升趋势,因而越来越受到人们的重视。目前,自身免疫性肝炎在基础和临床研究方面取得了许多新进展,尤其是自身免疫性肝炎的发病机制、临床特征、临床诊治等方面的研究值得同行关注,以增强临床医生对自身免疫性肝炎的诊断及治疗水平。
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种累及肝实质的渐进性坏死性炎症性肝病,其发病率和死亡率均较高。AIH主要影响女性,表现为不同程度的血清转氨酶和球蛋白升高、血清自身抗体阳性和交界性肝炎;临床表现复杂多样,从无症状性肝功能异常到急性肝衰竭症状均有可能出现。任何肝功能异常的人都应排查AIH,尤其是高丙种球蛋白血症者[1-6]。AIH在欧洲的年发病率为0.8~1.9/10万,流行率为11.6~17/10万[1-6];日本报道AIH的年发病率为0.015~0.08/10万[6];AIH在我国的发病率和流行率均未见报道。
1 发病机制
AIH由自身抗原诱导的免疫耐受丧失所致,目前的研究表明,AIH的女性患者占多数,并在主要组织相容性复合体等位基因中发现特定的同种异体,提示AIH具有遗传易感性。与这些基因的关联因种族和地域而有所不同,欧美常见,亚洲少见,其中人类白细胞抗原同种异体DRB1*0301和DRB1*0401与AIH的发病密切相关[2-4,6]。
免疫耐受丧失涉及一种抗原、组织相容性复合体(major histocompatibility complex,MHC)和一种T细胞受体,它们共同形成一种复合体,其中互补决定区识别并接触抗原-MHC复合体[2,4,6]。导致这种针对肝脏的由T细胞介导的免疫反应的环境触发因素包括病毒、药物甚至免疫接种。巨细胞病毒、单纯疱疹病毒和丙型肝炎患者中发现了肝抗原的交叉反应抗体。米诺环素、硝基呋喃妥英和阿托伐他汀等也可能诱发AIH。
适应性免疫反应和体液免疫反应在AIH中起着重要作用,其通过调控CD4+CD25+T细胞,从而抑制自反应T细胞增殖来抑制自我耐受,导致AIH的发病[4,6]。
2 临床表现
AIH好发于女性,占80%以上,可发生在各年龄段,发病高峰为14~60岁,可表现出多种临床症状,也可在完全无症状的人群(12%)中偶然发现AIH,如保险、就业或献血前检查。长期疲劳是最常见的症状(61%),其他相关症状还有乏力、低热、食欲减退、关节疼痛、恶心、呕吐、腹痛、瘙痒或皮疹等。AIH发展至肝硬化后,可出现黄疸、肝掌、蜘蛛痣、腹水或食管胃底静脉曲张等。小部分患者可表现为急性肝衰竭,因急性肝衰竭进行的肝移植中有2%~5%是AIH[1-6]。另外AIH可同时合并溃疡性结肠炎、类风湿性关节炎、系统性红斑狼疮、甲状腺炎、Ⅰ型糖尿病、腹腔疾病等疾病而表现出相应的肝外临床症状。
3 实验室检查
AIH的诊断主要靠血清学和组织学检查,并排除其他类型的慢性肝病。患者大多出现血清丙种球蛋白异常升高,特别是以IgG升高为主。高丙种球蛋白血症的同时,出现自身抗体阳性是AIH的特征性标志。虽然自身抗体在AIH的发病机制中所起的作用还不清楚,但与AIH相关的自身抗体日益增多,包括抗核抗体(antinuclear antibodies,ANA)、平滑肌抗体(smooth muscle antibody,SMA)、抗肝肾微粒体抗体(anti-liver-kidney microsomal antibody type 1,LKM-1)、抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies,ANCA)、抗可溶性肝抗原/肝胰抗原抗体(anti-soluble liver antigen/liver-pancreas antibody,SLA/LP)、抗肝细胞胞质1型抗体(anti-liver cytosol antibody type 1,LC-1),以及抗双链DNA、抗去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGPR)和反环瓜氨酸肽等。根据血清自身抗体的不同,AIH主要分为三型:可检测到ANA或SMA为Ⅰ型,主要见于成人;血清ANA和SMA阴性,而LKM-1或LC-1阳性为Ⅱ型,Ⅱ型AIH比较少见,主要见于儿童,通常病情进展迅速;以SLA/LP阳性为特征者为Ⅲ型[2,4,7-8]。研究表明[7-8],ANA、SMA和LKM-1的灵敏度分别为32%、16%和1%,ANA和SMA联合检测的灵敏度可上升至43%,正确预测值为97%。在乙型肝炎和丙型肝炎、酒精性肝病以及非酒精性脂肪肝患者的血清中,也可检测到ANA和SMA,甚至SLA、LKM-1、LC-1、ASPGR等自身抗体阳性,被认为是肝组织出现严重病理学变化的标志。有研究通过分析AIH患者的肠道微生物成分和功能,认为肠道微生物可以作为评估疾病活动的无创标志物[9]。
4 组织学表现
疑似AIH的患者应进行肝组织活检,以明确诊断及指导治疗。组织学评估对于症状不典型、自身抗体阴性和/或IgG水平正常的患者尤为有效。经典的AIH病理表现是在门静脉和肝实质交界处出现炎性细胞(淋巴细胞、浆细胞或单核细胞)浸润的交界性肝炎,以及典型肝玫瑰花结形成。症状轻的病例仅见纤维化,进展期病例可见桥接纤维化和肝硬化。严重的急性AIH患者的肝组织中可以看到明显的界面炎症和小叶坏死,纤维化程度较轻。如果同时合并有原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)、自身免疫性胆管炎等疾病,病理上可出现胆管萎缩减少、破坏性胆管炎等情况。
5 诊断标准
为方便临床的诊治和研究,国际自身免疫性肝炎组(International Autoimmune Hepatitis Group,IAIHG)制订了几种评分系统(表1[9]和表2[10])。1999年的评分系统对AIH的诊断最为具体和敏感,但过于烦琐。2008年修订的简化版评分标准的特异度较高,但灵敏度较低(分别为99.5%和70%)[10-11]。因AIH的经典临床表现并不会出现在每一位患者身上,急性发病或合并其他疾病的患者通常会被这些评分系统误导而导致漏诊、误诊。AIH的诊断是一种排除性诊断,必须排除病毒相关的感染,如乙型和丙型肝炎、巨细胞病毒、疱疹病毒等。AIH评分系统和所有诊断标准一样,可以得出假阳性或假阴性结果,这强调了结合临床病史对评分系统的每个要点进行综合性分析的重要性。实际上AIH的诊断是基于临床表现、流行病学、实验室检查和组织学的综合诊断。
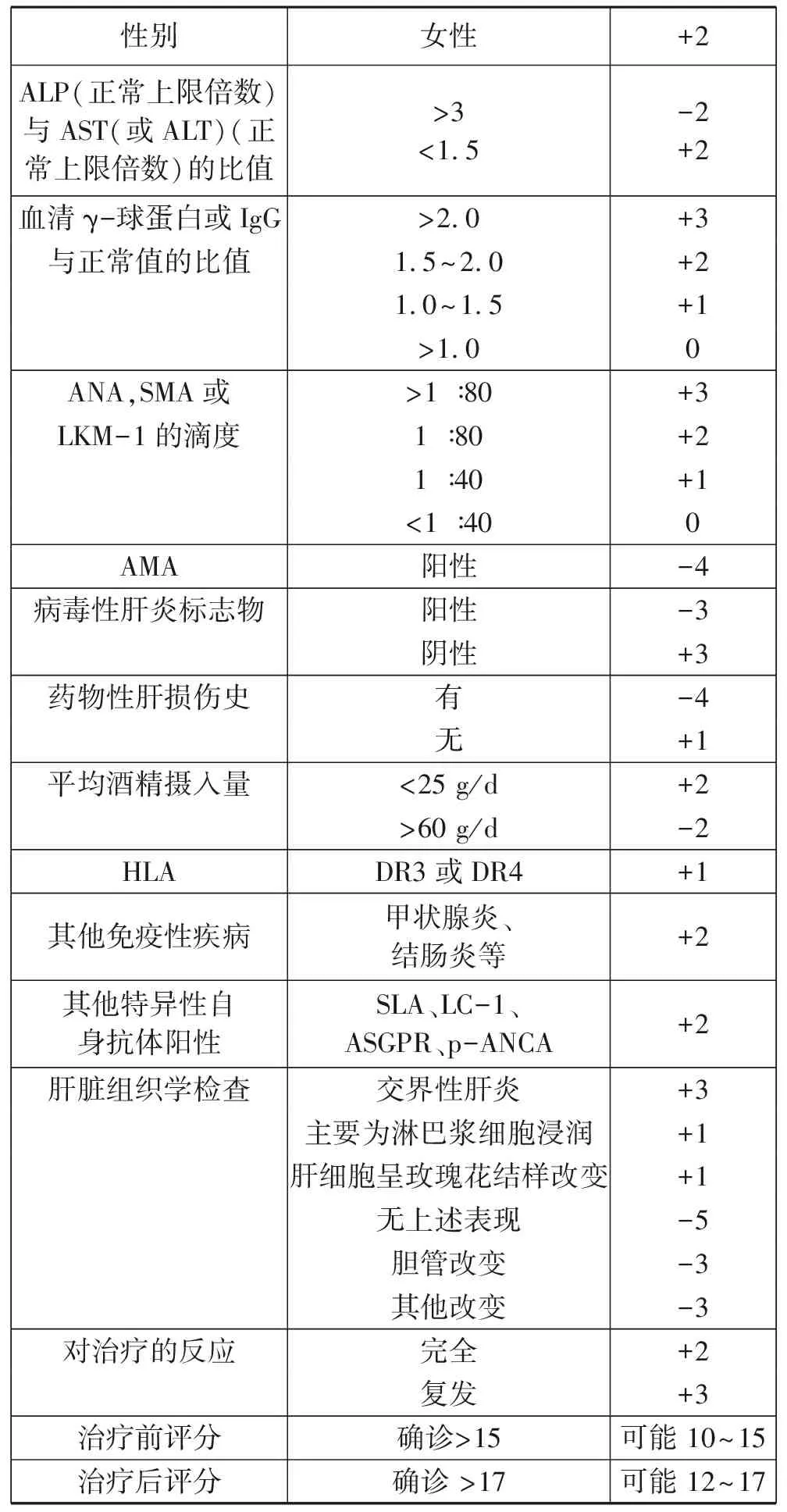
表1 IAIHG 1999年修正的自身免疫性肝炎诊断积分系统
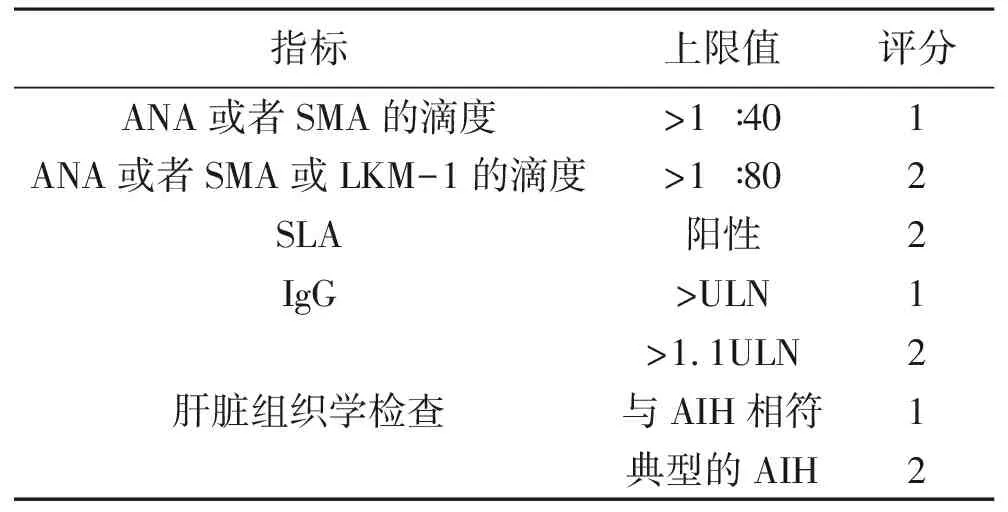
表2 AIH简化诊断标准
注:评分>6分可能AIH,>7分确诊AIH。
6 重叠综合征
部分AIH患者可能会同时出现其他自身免疫性肝病的特征,如PBC和PSC。目前尚缺乏标准的重叠综合征的定义。AIH和PSC或PBC的重叠特征存在于2%~19%的病例中[12-13],但临床医生应将注意力集中在主要疾病的表现上并进行相应的治疗,而不是集中在这两种疾病的特点上。
6.1 PBC-AIH重叠 2015年欧洲肝脏研究协会临床实践指南采用了AIH-PBC重叠的诊断标准,规定每种疾病至少符合相应疾病的两条以上诊断标准。AIH标准包括:(1)谷丙转氨酶(ALT)≥5倍正常上限(ULN);(2)IgG≥2倍正常上限或SMA阳性;(3)肝组织病理:伴有中度或重度门静脉周围或界面淋巴细胞性肝炎。PBC标准包括:(1)ALP≥2倍正常上限(ULN),或者γ-GGT≥5倍正常上限(ULN);(2)AMA阳性;(3)肝组织病理检查提示胆管病理损伤[13]。
6.2 AIH-PSC重叠 诊断标准[12]:内镜下逆行胰胆管造影或肝组织病理学提示PSC患者特征性胆管病变,同时符合AIH诊断标准。据统计,PSC患者中有7%~14%的病例可能同时合并有AIH,或者AIH患者在做影像学检查时发现有胆管病变。但由于在AIH最初的诊断中并没有专门针对胆道影像学资料进行比较,所以这些病例不可能被真正归类为重叠综合征。AIH-PSC重叠综合征在儿童中更为常见并得到广泛的研究,对免疫抑制疗法的反应明显优于PSC。
7 IgG4相关性疾病和AIH
IgG4相关性疾病曾被认为是一种器官特有的自身免疫性疾病。对IgG4相关性自身免疫性胰腺炎的研究表明,IgG4可累及胰外病变,包括肝脏在内的众多靶器官,2%~34%的病例在活检标本的免疫染色中可能存在异常高水平的IgG4[13]。IgG4相关的AIH具有典型的AIH临床表现和组织学特征,没有出现胆管病变,但有显著(>10/HPF)的IgG4阳性浆细胞(血清和肝组织),并且在糖皮质激素的治疗中起效快[14]。目前国内外相关研究不多,IgG4的相关性疾病在AIH中的意义仍然不确定。
8 妊娠合并AIH
妊娠期AIH的发病无法预测,但高达20%的AIH患者在妊娠期间会发病,这与胎儿和母亲并发症的高发生率有关。因此,建议AIH妇女在控制疾病处于最佳状态后至少推迟1年再妊娠[2,4]。妊娠期AIH的发病机制尚不清楚,可能是自身抗体和由疾病激活的天然免疫细胞靶向参与母胎界面结构(绒毛间隙的细胞成分、螺旋静脉的内皮组织和蜕膜的表面上皮细胞)引起,整个过程会增加妊娠早期流产和早产的风险。血栓形成是内皮损伤和补体系统激活引起的并发症,以上均会导致严重的围产期并发症。患有AIH的妇女会增加妊娠风险和新生儿发病率,即使接受治疗,病情严重患者的胎儿预后往往较差[2]。
妊娠期AIH的首选治疗包括尽可能低剂量的糖皮质激素单用,或与硫唑嘌呤联合使用。美国食品药品监督管理局将药物的妊娠安全性分为A~D类(最安全到最不安全)。硫唑嘌呤属于D类药物,孕期使用有明确的风险,但获益大于风险。强的松属于C类药物,不会广泛穿过胎盘,与胎儿的致畸性无关,是控制AIH孕妇疾病活动的首选药物。虽然研究数据有限,但硫唑嘌呤和强的松在AIH孕妇中使用并不会增加胎儿和母亲不良反应的风险[2,4]。其他用于治疗AIH的药物,包括吗替麦考酚酯(Mycophenolate mofetil,MMF)和他克莫司,在妊娠期禁用,因为它们会导致先天畸形/先天性残疾、早产、低出生体重和孕妇严重感染。使用强的松期间母乳喂养相对安全,而硫唑嘌呤在母乳中的排泄量很低,尽管制造商建议哺乳期间慎用,但大多数专家仍建议母乳喂养期间继续使用硫唑嘌呤[2,4]。目前尚没有布地奈德、霉酚酸酯和母乳喂养的研究数据。孕妇AIH复发的治疗与非孕妇一样,使用更大剂量的强的松和/或联合硫唑嘌呤。
40%以上的AIH患者合并有肝硬化[2],代偿期肝硬化妇女怀孕不是禁忌,但这与增加子痫前期、低出生体重、早产和复发的发生率有关。终末期肝病模型评分大于10分的孕妇和胎儿预后差的风险很高,失代偿期风险更高,孕产妇死亡率高达7.8%[2]。这类患者应与产科和肝病专家就选择性终止妊娠、代孕或者推迟妊娠至肝移植后进行深入讨论。肝硬化患者门静脉和奇静脉的侧支静脉代偿性扩张,怀孕期间因循环血容量增加和子宫对下腔静脉的压迫,导致门脉高压加重,增加食管胃底静脉曲张破裂出血的风险,特别是在妊娠晚期和分娩期,这是最常见的并发症,也是造成产妇死亡的重要原因。因此,所有AIH孕妇都应检查胃镜,存在重度静脉曲张的孕妇应进行预防性内镜下静脉曲张结扎,尤其是在妊娠28周左右发生最大体积扩张。其他并发症如肝性脑病和腹水等的处理同普通人群[2,4]。
分娩后,随着免疫力的恢复,AIH可能会复发。妊娠期及产后复发的概率是正常人的两倍,建议患者到肝病专科随访。分娩时应监测患者的肝功能和IgG水平,产后前3个月每4~6周监测1次[2]。
9 药物治疗
美国肝病研究协会和英国胃肠病学会自身免疫性肝炎管理指南指出[4]:AIH治疗的绝对指征是血清AST高于正常水平至少10倍,或5倍且伴有γ-球蛋白水平是正常上限的两倍以上,组织学提示桥状坏死或多小叶坏死;治疗的相对指征是有乏力、关节痛、黄疸等症状,血清AST和/或γ-球蛋白水平异常但低于绝对指征标准,组织学检查示界面性肝炎。据报道[6],轻症和未治疗病例的10年生存率明显低于治疗病例。因为有些患者的肝病进展无症状,直到出现严重纤维化或肝硬化才确诊,所以推迟医疗干预的患者应每3个月检测一次ALT和IgG。如果这些指标升高,建议进行后续肝活检;如果该疾病已变得活跃,则应开始治疗。ALT水平低于正常上限的3倍、肝活动指数评分<4/18、无晚期纤维化,则应根据患者的年龄和病理情况进行治疗。目前推荐的AIH初始治疗方案是单独使用强的松(60 mg/d),或强的松(30~40 mg/d)联合硫唑嘌呤(50 mg/d)。
10 诱导及维持缓解
诱导缓解的主要药物仍然是皮质类固醇,加或不加硫唑嘌呤。类固醇的诱导剂量在30~60 mg/d,一般起始剂量为40 mg/d,可在诱导开始时或在肝功能正常化后添加硫唑嘌呤(1 mg·kg-1·d-1)。以上治疗应至少持续1个月,其后在临床症状改善、实验室指标和肝组织正常后,泼尼松龙剂量每个月减少10 mg,硫唑嘌呤减少50 mg,直至达到常用的维持剂量5 mg。单独治疗时,泼尼松龙的维持剂量为 10 mg/d,也可逐渐降至5~7.5 mg/d或隔日顿服。目前研究表明低剂量泼尼松龙(<10 mg/d)和硫唑嘌呤联合治疗或较高剂量硫唑嘌呤单一疗法(2 mg·kg-1·d-1)的维持治疗比泼尼松龙单一疗法更有效[4,6]。研究表明[1]在无脑病的急性重症AIH患者中使用高剂量的皮质类固醇激素(corticosteroid,CS)是非常有效的,诱导方案包括静脉注射泼尼松龙(1.5 mg·kg-1·d-1)或静脉注射甲基强的松龙3 d(1 g/d),参与研究的34例患者均没有接受肝移植,这些乐观的结果可能与患者处于疾病的早期阶段(相对较低的终末期肝病模型评分,没有急性肝功能衰竭)和早期开始CS治疗以及CS的给药途径和剂量有关[1]。
布地奈德是一种糖皮质激素,对糖皮质激素受体有很高的亲和力。研究发现,如果布地奈德治疗剂量为9 mg·kg-1·d-1,再加上1~2 mg·kg-1·d-1的硫唑嘌呤,则其诱导缓解作用比泼尼松龙和硫唑嘌呤更有效。但在激素耐药治疗的病例中,布地奈德的疗效可能很小[6]。由于布地奈德主要是通过肝脏进行代谢,其中约90%经过肝脏的首过消除,因此副作用相对比较小,但也限制了其在肝硬化患者中的使用。
熊去氧胆酸对改善胆汁淤积性肝病患者的临床症状有效,早期联合糖皮质激素治疗AIH-PBC重叠综合征能获得更好的生化反应和改善组织学,但熊去氧胆酸并不适用于治疗失败的替代治疗和激素撤药的替代治疗[14]。
11 治疗目标、缓解和复发
AIH的早期治疗侧重于将转氨酶的活性降低到正常的1~2倍。生化参数的正常化与复发率和肝硬化的进展有关。我们的治疗目标应该是转氨酶、γ-球蛋白的正常化,最好是组织学上的证据表明疾病已经静止。因药物治疗有显著的副作用,在证实生化参数和肝组织检查正常的一段时间之后,患者可以考虑撤药。但停药前免疫抑制治疗(immunosuppressive therapy,IST)持续时间以及停药前生化和组织学缓解标准方面并没有达成共识。复发的表现是ALT高于正常上限三倍,或者γ-球蛋白高于正常上限两倍。治疗1年后停药的复发率为25%~100%。与IST停药后复发相关的可能因素有[5]:(1)缺乏可识别的初始疾病触发因素。(2)存在其他自身免疫性疾病。(3)持续的生化异常时间较长,以及停药后血清转氨酶升高。(4)目前关于复发与年龄、IST持续时间和组织学缓解失败之间关联的研究报道差别较大。持续的IST至少在5年内降低了AIH复发的风险。然而,没有证据表明长期使用IST能改善疾病结局。(5)AIH患者患肝外癌的风险增加,尤其是非黑色素瘤皮肤癌,而长期IST可能会导致这种风险。长期皮质类固醇治疗与体重增加、低创伤骨折、糖尿病以及可能的血管疾病有关。
Grant等[15]学者的研究发现,通过实验技术可以纠正AIH的免疫功能异常,特别是修复异常的Treg细胞。在Ⅱ型AIH小鼠模型中,移植体外扩增的自体CXCR3阳性Treg细胞可缓解AIH[16]。因此,通过移植Treg细胞恢复外周免疫耐受有可能是未来治疗难治性AIH的一种有希望的方法。
12 替代治疗
治疗失败的患者不宜再使用标准方案复治,需要采用二线药物的替代方案。
环孢素A是含11个氨基酸残基的环状多肽,可选择性抑制T淋巴细胞亚群的分泌功能而发挥免疫抑制作用。在儿童患者的治疗中[4],小病例组显示出较高的生化缓解率,但其副作用较大,包括高血压、高胆红素血症、肾功能不全、运动脊髓综合征、感染和恶性肿瘤等。目前对这类药物还缺乏大样本的研究以进一步确定其疗效和安全剂量。
MMF是一种抗T和B细胞增殖作用的肌球蛋白单磷酸抑制剂,曾用于治疗难治性AIH患者或硫唑嘌呤不耐受的患者。有报道使用MMF联合糖皮质激素治疗后,AIH的缓解率从25%提高到100%[6,17]。MMF在AIH的诱导和维持治疗中,维持MMF的剂量在1.5~2 mg/d之间,88%的患者均有较好的生物化学反应[6,18]。由于MMF缺乏长期的安全数据,而且怀孕是禁忌,这限制了年轻女性的使用,也限制了MMF的广泛推广。
他克莫司是一种新型钙调神经磷酸酶抑制剂。研究表明[19-20],AIH患者以他克莫司进行诱导治疗,可以改善转氨酶活性和肾功能不全,并且诱导治疗后缓解率很高,但由于目前研究的病例数量有限,缺乏足够的临床依据,具体用法、用量及疗程、适用人群仍需进一步深入研究。
其他免疫抑制剂包括环磷酰胺、甲氨蝶呤、利妥昔单抗等在临床上也有研究,但这些药物在使用上还没有达成共识,临床疗效也不确切。
13 预 后
大约30%~50%的AIH患者会进展为肝硬化。疾病进展的危险因素主要有治疗的前6个月内AST水平未能下降,未能坚持治疗至缓解,以及非裔美国人后裔。
肝细胞癌是AIH比较少见的并发症,但国外病例数据表明肝细胞癌比以前更常见[6],肝细胞癌的筛查在肝硬化随访期间仍然是至关重要的,药物治疗无效、病程进入晚期,尤其是出现肝衰竭的患者可以考虑肝移植。在患有急性黄疸的AIH患者中,有一小部分患者可能发展成急性肝功能衰竭,需要进行紧急肝移植,移植后的5年存活率为76%~80%[1,4,6]。肝硬化移植的适应证与其他慢性肝病的适应证相同。出现腹水或静脉曲张出血的患者应及早转诊到肝移植中心进一步治疗。肝移植后的复发率因种族不同而有所不同,脾切除术可能抑制肝移植后AIH的复发,在小鼠AIH模型中,通过移除中央Treg细胞,脾切除术延长了皮质类固醇的作用,脾切除术也可能是治疗AIH的另一种选择[6]。
皮质类固醇的不良反应包括水钠潴留、高血压、糖尿病、骨质疏松、精神病、白内障等。对于类固醇不良反应不能耐受的患者,布地奈德是一种潜在的替代药物。
使用硫唑嘌呤的患者,25%可能会出现副作用,该副作用在肝硬化患者中更为常见。虽然恶心是最常见的副作用,但医务工作者和患者更为关注的是恶性肿瘤和骨髓抑制的风险。长期使用硫唑嘌呤出现恶性肿瘤风险的概率尚不明确。目前对炎症性肠病患者使用硫唑嘌呤治疗是否会增加恶性肿瘤的风险存在相反的两种研究结果,因此很难完全推断AIH出现恶性肿瘤的风险。治疗上的益处是来自硫鸟嘌呤核苷酸代谢物和甲基硫嘌呤核苷酸的毒性作用,通过测定负责其代谢的主要酶的浓度来预测硫唑嘌呤的疗效和毒性作用,对提高疗效和降低其恶性肿瘤及骨髓抑制发生的风险具有指导意义。
虽然目前的标准疗法可用于治疗大部分AIH患者,但一些关键的临床问题仍然存在。首先,布地奈德在诱导和维持治疗中的确切作用仍需要进一步阐明,而且在肝硬化患者中,布地奈德的作用是有限的,因此,使用泼尼松龙的标准治疗仍然是首选。其次,AIH缓解的定义是什么,基于什么证据来考虑撤药和撤药的方法。最后,治疗失败的问题,因为目前还没有一种标准化的循证方法来界定二线制剂的选择,可参考英国胃肠病学会自身免疫性肝炎管理指南的建议进行选择。对于进展期肝硬化的患者,有肝移植的适应证,在移植后可能有较高的生存率。对于那些治疗失败、出现严重门脉高压的患者,建议尽早转诊到肝移植中心。

