高效液相色谱法测定生物转化反应液中N,N′-乙二胺二琥珀酸
吴智超, 吴恩国, 杨仲毅*, 陶宇翔, 陈 潭, 钟永军
(1. 台州学院, 浙江 台州 318000; 2. 浙江海正药业股份有限公司, 浙江 台州 318000;3. 台州市博纳化工有限公司, 浙江 台州 318000)
乙二胺二琥珀酸(N,N′-ethylenediamine disuccinic acid, EDDS)是一种天然生物源氨基多羧酸类螯合剂,主要用于化妆品、洗涤剂,以及环保行业如重金属污染土壤的修复等。与乙二胺四乙酸(EDTA)相比,EDDS具有更高的pH耐受性和更好的生物可降解性,是当前土壤修复研究中新一代生物螯合剂[1-4]。EDDS可以采用化学法、发酵法、生物转化法进行生产[5],其中生物转化法具有较好的环境兼容性,是国内外重点研发的方法。在生物转化法中,EDDS裂合酶催化富马酸与乙二胺,从而合成EDDS;反应过程中富马酸也较容易形成副产物苹果酸(见图1)。
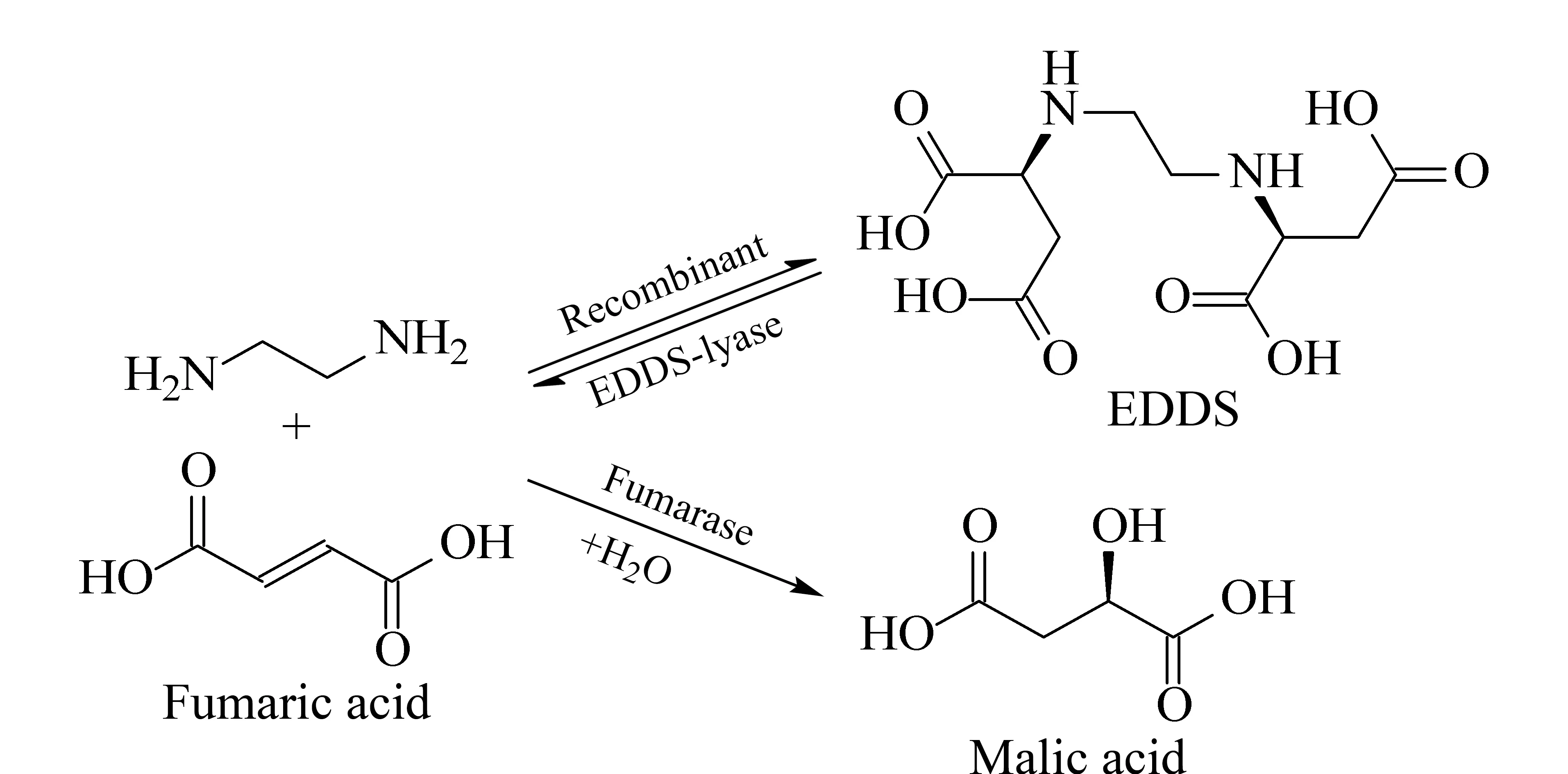
图 1 EDDS的生物转化Fig. 1 Biosynthesis of N,N′-ethylenediamine disuccinic acid (EDDS)
EDDS的快速分析是其当前研究、生产和应用的一项重要任务。EDDS的检测方法主要有钙螯合值法、比色法、离子色谱-电感耦合等离子体-质谱法、气相色谱法(GC)和高效液相色谱法(HPLC)[6-8]。土壤修复中EDDS的检测常用到离子交换色谱法和反相HPLC[6,9-11],其中反相HPLC检测中,EDDS与流动相中的铜盐形成EDDS-Cu络合物,在254 nm处有较强吸收。EDDS生物转化过程的监测,则要求能同时测定原料富马酸、产物EDDS、副产物苹果酸,检测过程应简单快速,并且最好能同时鉴别类似物如EDTA等物质,这也对检测方法提出了更高的要求。富马酸、苹果酸等有机酸的常规检测中,离子色谱法是常用的方法[12,13]。在EDDS生物合成研究中,Poddar等[14]采用核磁共振鉴定生成EDDS,并通过测定反应液在240 nm处紫外吸收的下降来判断转化过程中原料富马酸的浓度变化。Witschel等[15]利用反相离子对色谱法测定反应生成的EDDS,并利用离子排阻色谱法检测反应过程中苹果酸和富马酸的浓度。更多的报道[16,17]则是利用四丁基氢氧化铵作为反相离子对试剂,HPLC同时检测反应过程中富马酸和EDDS。Kato等[18]利用C8柱,同时测定富马酸、L-苹果酸和EDDS。
鉴于C18柱更广泛的应用[19],建立基于C18柱能同时分析富马酸、L-苹果酸、EDDS的HPLC方法,并能同时测定产物的类似物EDTA及苹果酸进入三羧酸循环后的典型代谢物柠檬酸的方法,将有利于EDDS生物合成研究的深入开展。
1 实验部分
1.1 仪器、试剂与材料
Micromass Quattro Micro API液相色谱-三重四极杆质谱仪(美国Waters公司); LC3000型HPLC系统(北京创新通恒科技有限公司),包括P3000高压输液泵、UV3000紫外可见波长检测、RPL-D2000型柱温箱;UV-3300分光光度计(上海美谱达仪器有限公司); FA2004B十万分之一电子天平(上海精密科学仪器有限公司)。
甲醇为色谱纯,由美国Fisher公司提供;富马酸、L-苹果酸、磷酸、25%(质量分数)四丁基氢氧化铵、乙酸铜为分析纯,购自上海阿拉丁生化科技股份有限公司;EDDS对照品由台州市博纳化工有限公司提供,含量为98.0%(质量分数)。
表达EDDS裂合酶的基因工程菌来自本实验室。该酶的GenBank登录号为ABG61966,是一种精氨琥珀酸裂合酶[14,20]。
1.2 实验条件
1.2.1标准溶液的配制
称取乙二胺二琥珀酸三钠盐固体粉末305.2 mg,加入约30 mL超纯水,超声5 min,用10 mol/L的氢氧化钠溶液滴加并调节溶液的pH值至8.5,使EDDS溶解澄清,以去离子水定容至100 mL,得到EDDS标准储备液。
称取富马酸固体粉末300 mg,加入约30 mL超纯水,超声5 min,用10 mol/L氢氧化钠溶液滴加并调节溶液的pH值至8.5,使富马酸溶解澄清,以去离子水定容至100 mL,得到富马酸标准储备液。
1.2.2供试品溶液制备
EDDS的生物合成反应:在500 mL锥形瓶中加入富马酸11.6 g、乙二胺盐酸盐6.7 g、氢氧化镁2.9 g,以及去离子水50 mL、工程菌菌体5.0 g,用10 mol/L氢氧化钠溶液滴加调节溶液pH至8.8,用去离子水定容至100 mL。于30 ℃以200 r/min条件在摇瓶中进行反应。取反应7 d的反应液作为样品1;加入10 g/L的EDDS对照品于样品1中,作为样品2。
EDDS的水解反应:在500 mL锥形瓶中加入去离子水50 mL、EDDS 1.0 g,用10 mol/L氢氧化钠溶液滴加调节溶液至pH≈8.5,再加入工程菌菌体5.0 g,继续以10 mol/L氢氧化钠溶液调节溶液pH至8.5,并以去离子水定容至100 mL。于30 ℃以200 r/min条件在摇瓶中进行反应,3 h后取样作为样品3。
1.2.3样品处理
移取样品1、2和3各1.0 mL,加入3 mol/L盐酸200 μL终止反应,于5 min后加入3 mol/L NaOH溶液调节pH值至7.0~9.0,再用去离子水定容至20 mL,继续用去离子水稀释至适当浓度后,移取1.0 mL溶液,以10 000 r/min离心2 min,上清液待HPLC分析。
1.2.4色谱条件
色谱柱为InertSustain AQ-C18色谱柱(250 mm×4.6 mm, 5 μm,日本岛津公司);柱温为30 ℃;流动相为25%(体积分数)甲醇水溶液(含1.0 g/L一水乙酸铜、2.0 g/L四丁基氢氧化铵,以磷酸调节pH值至2.80);流速为1.0 mL/min;进样量为20 μL;检测波长为254 nm。
1.2.5质谱条件
离子源为电喷雾电离(ESI-)源;离子源温度为100 ℃;脱溶剂温度为300 ℃;毛细管电压为3 200 V;锥孔电压为20 V;气帘气为氮气,流量为52 L/h;脱溶剂气为氮气,流量为650 L/h;检测方式为全扫描,扫描范围为m/z20~800;进样方式为蠕动泵直接进样。
2 结果与讨论
2.1 色谱条件的选择
2.1.1检测波长的选择
在190~700 nm波段对0.5 g/L的EDDS溶液进行扫描,EDDS在195 nm处有最大吸收峰,而在250 nm之后则基本无吸收。在溶液中加入1 g/L的一水乙酸铜后再次扫描,EDDS-Cu复合物在190~285 nm处均有较高的吸收,并于320 nm左右降至接近基线。与EDDS不同,富马酸的紫外吸收受乙酸铜的影响相对较小,其富马酸-Cu复合物与EDDS-Cu复合物的扫描曲线基本重叠(见图2)。实验选择254 nm作为HPLC的检测波长,既保证了EDDS-Cu复合物有较高的紫外吸收,又可以避开游离EDDS对检测的干扰。
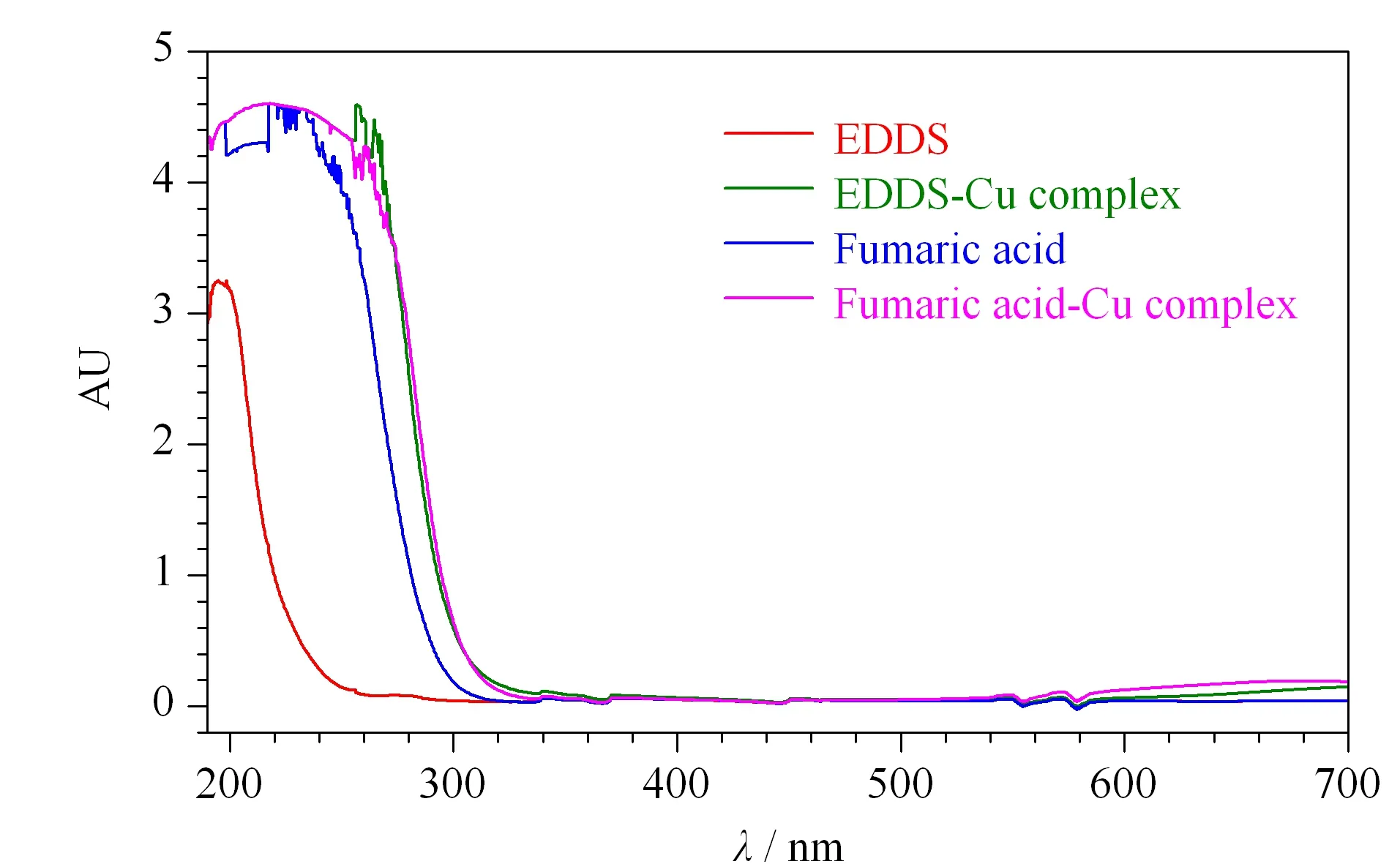
图 2 乙二胺二琥珀酸、富马酸及其铜复合物的光吸收曲线Fig. 2 Absorbance curves of N,N′-ethylenediamine disuccinic acid, fumaric acid and their complex with copper salts
2.1.2流动相中甲醇体积分数的选择
为开发一个快速简便的HPLC方法,比较了流动相中甲醇的体积分数对出峰时间的影响(见图3)。甲醇体积分数为15%时,EDDS、富马酸和EDTA的出峰时间分别为7.5、10.1和11.8 min;甲醇体积分数为35%和50%时,EDDS和富马酸的出峰时间虽然大为缩短,但EDTA出峰次序提前,且EDDS与苹果酸、柠檬酸及EDTA不能有效分离,不利于副产物和其他杂质的分离检测;甲醇体积分数为25%时,EDDS、富马酸及苹果酸、柠檬酸和EDTA可基线分离,峰形均较对称,其出峰时间分别为3.3、3.7、4.2、5.2和6.1 min,总出峰时间在8 min以内,且在254 nm处均有较为适中的光吸收,较有利于样品的快速检测。
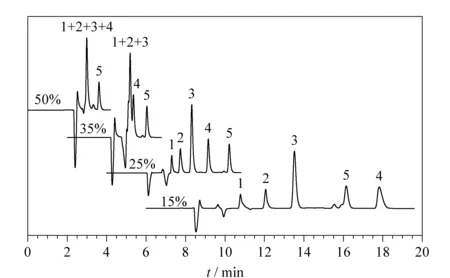
图 3 流动相中甲醇体积分数对HPLC分析的影响Fig. 3 Effect of volume fractions of methanol in the mobile phases on HPLC analysis 1. malic acid; 2. citric acid; 3. EDDS; 4. ethylenediaminetetraacetic acid (EDTA); 5. fumaric acid.
2.1.3方法的适用性
EDDS、富马酸及苹果酸、柠檬酸和EDTA这5种物质的快速分离使得本方法适用于EDDS的多个研究领域。比如在EDDS的生物转化和发酵法生产过程中,除了原料富马酸、产物EDDS外,富马酸在微生物富马酸酶的催化下会产生副产物苹果酸(见图1),苹果酸和富马酸进入三羧酸循环后容易产生柠檬酸,因而本方法可以用于生物转化和发酵法生产EDDS的检测;在工艺过程中混入EDTA还会影响EDDS的产品质量,在土壤修复的研究中需要对比EDTA和EDDS等不同螯合剂的效果,本方法也能有效区分EDDS和EDTA。
2.2 方法线性范围、检出限、精密度及回收率
2.2.1线性范围和检出限
精密吸取EDDS和富马酸标准储备液,用去离子水稀释成0~3 g/L的系列标准工作液,进行HPLC分析。EDDS和富马酸的质量浓度与峰面积的关系见图4。

图 4 EDDS与富马酸的质量浓度-峰面积关系曲线Fig. 4 Mass concentration-peak area curves of EDDS and fumaric acid
从图4可见,EDDS在含量较低时峰面积与质量浓度之间的线性关系较为明显,随着质量浓度的升高,其线性关系降低。EDDS在0.06~0.6 g/L范围内呈现较好的线性关系,以峰面积为纵坐标(Y)、质量浓度为横坐标(X, g/L)绘制标准曲线,其回归方程为Y=11 583.0X+123.1,相关系数(r)为0.999 5。
样品中EDDS最大允许质量浓度可以根据流动相中铜离子的质量浓度进行估算。在254 nm处,EDDS基本没有光吸收,峰面积主要由EDDS-Cu复合物引起。本文中流动相铜离子浓度为0.5 mmol/L,铜离子与EDDS等物质的量形成复合物,则相应色谱峰中EDDS最高浓度也是0.5 mmol/L。在甲醇体积分数为25%的流动相中,EDDS峰洗脱液体积为400 μL, HPLC进样体积为20 μL,将EDDS峰形近似作为三角形进行估算,则可计算得到样品中EDDS的最大允许质量浓度为1.791 g/L。即样品中EDDS质量浓度超过1.791 g/L时将导致HPLC流动相中无足够铜离子与EDDS形成复合物。这与本实验结果基本吻合,当EDDS质量浓度高于1.8 g/L,HPLC的峰面积增长已趋于非常缓慢的状态(见图4)。
与EDDS不同,富马酸在反相柱上的分离并不依赖铜复合物的形成,铜离子的存在不影响富马酸的紫外吸收。在0.06~1.8 g/L范围内,富马酸的质量浓度与峰面积具有较好的线性关系,其回归方程为Y=5 013.6X+28.9,r为0.999 5。
通过逐步稀释标准溶液,获得EDDS和富马酸的检出限(S/N=3),分别为0.98 mg/L和1.32 mg/L。
2.2.2精密度和稳定性
对0.6 g/L的富马酸和EDDS样品进行分析,各连续进样6次,记录峰面积,计算得富马酸和EDDS峰面积的RSD分别为0.85%和1.12%(n=6),表明仪器精密度良好。
取样品2进行稀释,分别于0、2、4、6、8、10 h进样测定,记录峰面积,计算得到EDDS和富马酸峰面积的RSD分别为0.41%和1.73%(n=6)。结果表明,供试品溶液在10 h内稳定。当供试品溶液继续放置20 h和24 h时,EDDS和富马酸峰面积的RSD分别为0.70%和3.48%(n=8),说明EDDS依然相对稳定,而富马酸则相对变化较大。
2.2.3回收率
在未添加工程菌的EDDS合成反应液中加入EDDS和富马酸标准品,测定并配制成质量浓度均为5 g/L的EDDS和富马酸混合溶液。取该溶液18份,每份精密量取1.0 mL,分为3组,每组按低、中、高水平分别精密加入相当于3.92、4.90、5.88 g/L的EDDS或富马酸标准品,测定并计算回收率(见表1)。结果表明该方法准确性良好。

表 1 EDDS和富马酸在3个水平下的加标回收率(n=9)
2.3 EDDS生物合成和水解反应样品的测定
按照1.2.2和1.2.3节方法制备供试品溶液并处理样品,按1.2.4节色谱条件对样品1进行测定。结果表明,富马酸残留为7.22 g/L,但产物EDDS含量仅为0.25 g/L,副产物苹果酸达到了36.56 g/L。将该样品进行质谱分析,质谱图中m/z为133的信号较高,进一步证实该副产物为苹果酸(见图5)。

图 5 EDDS生物合成样品的色谱图和质谱图Fig. 5 Chromatogram and MS spectrum of the EDDS biosynthesis sample
上述HPLC测定结果表明,该基因工程中的EDDS裂合酶催化EDDS合成活性较低。由于该酶催化的反应为可逆反应,为验证该基因工程菌表达的酶是否有活性,重新设计了以EDDS为底物的水解反应。以10 g/L EDDS为底物,经过工程菌水解3 h,得到样品3,并进行测定,测得苹果酸、EDDS的含量分别为3.05 g/L和6.76 g/L,未能检测到典型的富马酸峰。由于EDDS需要先在EDDS裂合酶催化下形成富马酸,再在富马酸酶作用下形成苹果酸(见图1),因而推测该基因工程菌表达的EDDS裂合酶具有催化活性,同时该工程菌宿主菌中具有较高的富马酸酶活性。
3 结论
本文建立的反相离子对色谱法可以快速同时分离苹果酸、柠檬酸、EDDS、EDTA和富马酸,为EDDS生物合成机理和工艺开发提供了有效的分析技术支持。
致谢 本文的质谱分析得到普济生物科技(台州)有限公司徐刚博士的支持。

