高效液相色谱法测定鸡组织中苯并咪唑类药物残留标志物
邹 游, 邵琳智, 吴映璇
(广东检验检疫技术中心, 广东 广州 510623)
苯并咪唑类(BMZs)化合物是含有两个氮原子的苯并杂环化合物,具有良好的生物活性[1],同时抗菌、抗病毒、抗寄生虫等疗效明显[2],被广泛用于农业、水产养殖和兽医中。研究表明,BMZs具有致畸与致突变作用,且在体内转化的代谢产物仍具有毒理作用[3]。因此,中国、美国、欧盟等大多数国家和地区将其作为食品安全重要的监控对象,并制定了最高残留量(MRL)[4]。
我国最新出台的《食品安全国家标准动物性食品中兽药最大残留限量》(征求意见稿)[5]较之前的农业部235号公告[6]对苯并咪唑类药物作了较大修改,不仅增加了药物的种类,而且规范了名称,其次对残留标志物也作了修改:非班太尔、芬苯达唑和奥芬达唑的残留标志物为芬苯达唑、奥芬达唑和奥芬达唑2-氨基砜的总和;奥苯达唑的残留标志物为奥苯达唑;噻苯达唑的残留标志物为噻苯达唑和5-羟基噻苯达唑;三氯苯达唑的残留标志物为三氯苯达唑酮;阿苯达唑的残留标志物为阿苯达唑-2-氨基砜;氟苯达唑的残留标志物为氟苯达唑;甲苯达唑的残留标志物为2-氨基-5-苯甲酰基苯并咪唑和5-羟基甲苯达唑,共涉及9种苯并咪唑类药物,对应残留标志物共11种。
苯并咪唑类药物因其化学结构的关系,一般呈弱碱性,但其中三氯苯达唑的残留标志物三氯苯达唑酮为中性化合物,若要同时检测这9种苯并咪唑类药物的残留标志物,技术上存在许多困难,尤其是采用高效液相色谱法时,对于样品的净化具有更高的要求。然而,不管是已颁布的国家标准[7,8]或行业标准[9],还是已发表的文献或研究[10-18],都尚未有完全包括这11种残留标志物的检测方法公开。本文采用的前处理方式具有独创性,尤其是净化技术,解决了三氯苯达唑酮等几种残留标志物不保留、回收率低的问题。本方法为鸡组织中苯并咪唑类药物残留标志物测定标准的制定提供了可靠的参考依据,具有广阔的应用前景。
1 实验部分
1.1 仪器、试剂与材料
LC-20AD高效液相色谱仪,配自动进样器、柱温箱、紫外检测器和二极管阵列检测器(日本岛津公司);感量0.000 01 g的分析天平和感量0.01 g的天平(德国Sartorius公司); GM 200型肉类组织捣碎机(德国Retsch公司); MS 3 basic旋涡振荡器、减压旋转蒸发仪(德国IKA公司); SW 30H超声波水浴(瑞士Sono Swiss公司); 3-30K离心机(德国Sigma公司)
奥芬达唑(oxfendazole, CAS号:53716-50-0)、芬苯达唑(fenbendazole, CAS号:43210-67-9)、奥芬达唑-2-氨基砜(oxfendazole sulphone, CAS号:54029-20-8)、阿苯达唑-2-氨基砜(albendazole-2-aminosulfone, CAS号:80983-34-2)、噻苯达唑(thiabendazole, CAS号:148-79-8)、5-羟基噻苯达唑(5-hydroxythiabendazole, CAS号:948-71-0)、2-氨基-5-苯甲酰基苯并咪唑(mebendazole-amine, CAS号:52329-60-9)、5-羟基甲苯达唑(5-hydroxymebendazole, CAS号:60254-95-7)、氟苯达唑(flubendazole, CAS号:31430-15-6)、奥苯达唑(oxibendazole, CAS号:20559-55-1)和三氯苯达唑酮(ketotriclabendazole, CAS号:1201920-88-8),含量均在97%以上(德国Dr. Ehrenstorfer公司);乙腈、甲醇(色谱纯,美国Fisher公司),乙酸(色谱纯,德国Merck公司);实验室用水为超纯水(符合GB/T 6682-2008一级水要求);其他未作特殊说明的试剂均为分析纯;Oasis MCX固相萃取柱(60 mg/3 mL,美国Waters公司)。
1.2 样品前处理
1.2.1提取
称取5 g试样(准确至0.01 g),置于50 mL离心管中,加入15 mL乙腈溶液,超声5 min,涡旋振荡15 min,以4 000 r/min离心5 min,上清液转移至25 mL容量瓶中;残渣再加入10 mL乙腈溶液,重复上述过程,合并上清液,并用乙腈定容至刻度,摇匀,备用。
1.2.2净化
取5 mL上述提取液,置于15 mL塑料离心管中,加入5 mL 0.1 mol/L盐酸溶液,再加入5 mL正己烷,涡旋振荡1 min,以10 000 r/min离心5 min,弃去上层正己烷层,下层清液加入5 mL 0.1 mol/L盐酸溶液混匀,转入经过预处理的MCX固相萃取柱中,以小于1 mL/min的流速使样品溶液全部通过小柱,弃去流出液。依次用3 mL 0.1 mol/L盐酸-甲醇(2∶1, v/v)、4 mL 5%(v/v)氨水溶液淋洗,淋洗液全部通过小柱,弃去淋洗液。最后用4 mL 5%(v/v)氨水甲醇以0.5 mL/min的流速洗脱,收集洗脱液于具刻度的浓缩瓶中。
1.2.3浓缩、定容
将收集的洗脱液于38 ℃水浴下减压旋转蒸发至约500 μL,加入0.1 mol/L盐酸溶液定容至1 mL,涡旋2 min,以10 000 r/min离心5 min,待测定。
1.3 色谱条件
色谱柱:Atlantis T3色谱柱(250 mm×4.6 mm, 5 μm);柱温:40 ℃;流动相:A为甲醇溶液,B为1%(v/v)乙酸水溶液;流速:1.0 mL/min;进样量:40 μL;检测波长:292 nm。洗脱梯度见表1,梯度均为线性变化。

表 1 梯度洗脱程序
A: methyl alcohol; B: 1% (v/v) acetic acid aqueous solution.
2 结果与讨论
2.1 色谱条件的优化
苯并咪唑类药物属于弱碱性物质,中等极性,现有国家标准和参考文献多采用C18柱进行检测[7-9]。针对极性较小的化合物,普通C18柱保留较弱,本方法尝试选择Atlantis T3色谱柱进行分离,其键合和端基封尾技术的结合,不仅对极性化合物保留出色,且更加稳定耐用,较好地改善了普通C18色谱柱碱性化合物分离不佳、柱寿命较短等状况。
本方法在选择流动相时,比较了有机相乙腈和甲醇溶液的分离与保留效果,发现并无太大差异,但使用乙腈作为有机相洗脱时会产生较多杂峰,使用甲醇时则杂峰较少。对于本方法中的11种苯并咪唑类药物残留标志物,流动相中不同酸度的水相对其分离和保留的影响较大。本方法尝试了采用0.5%、1%和2%体积分数的乙酸水溶液,发现采用1%(v/v)乙酸水溶液时,全部待测化合物的分离和保留达到最佳。因此本方法最终采用甲醇-1%(v/v)乙酸水溶液进行梯度洗脱。经过色谱优化后,得到的11种苯并咪唑类残留标志物标准溶液(100 μg/L)、空白鸡肝脏样品和加标鸡肝脏样品(500 μg/L)的高效液相色谱图见图1。
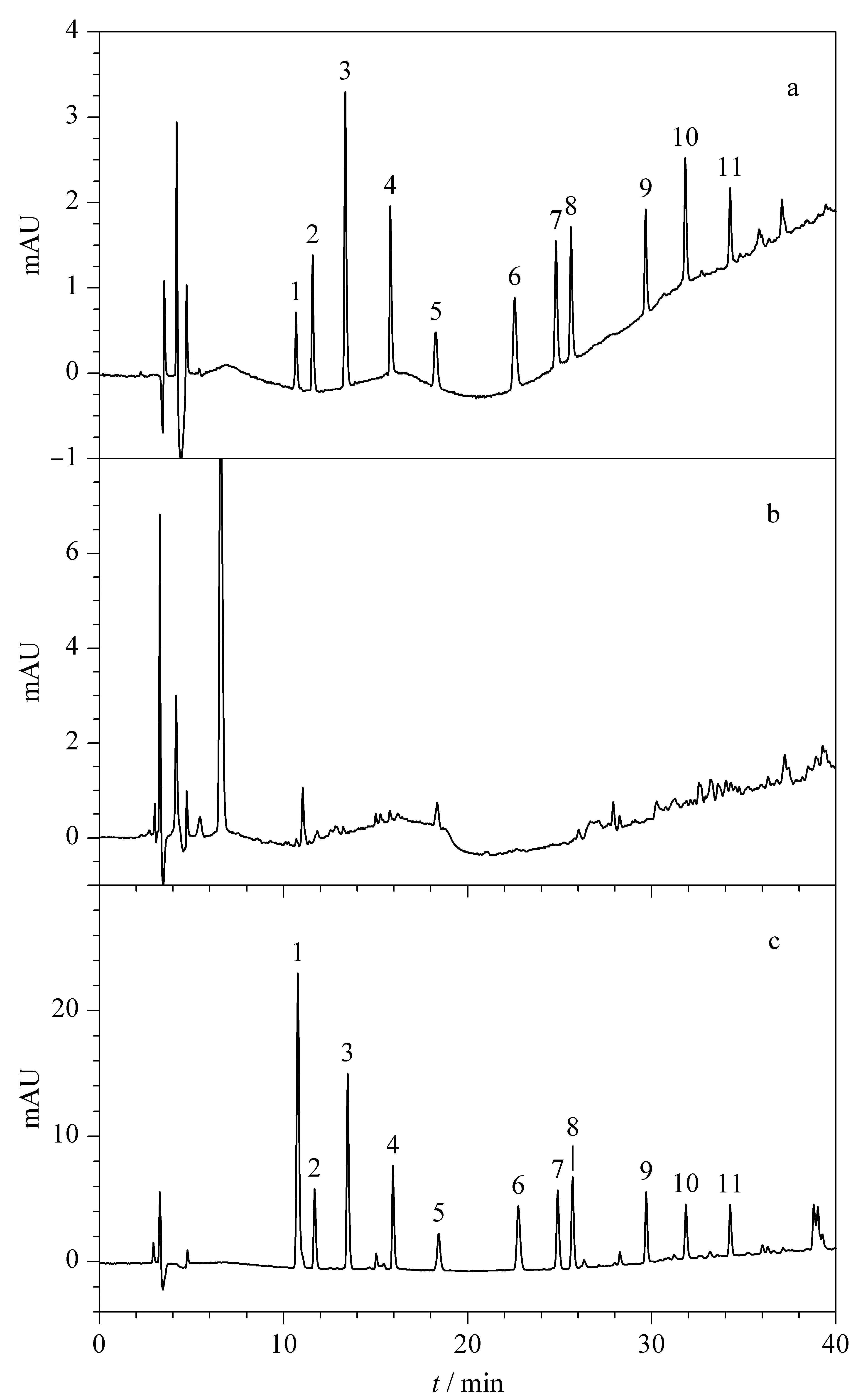
图 1 (a)11种苯并咪唑类残留标志物标准溶液 (100 μg/L)、(b)空白鸡肝脏样品和(c)加标鸡肝脏样品(500 μg/L)的色谱图 Fig. 1 (a) Chromatograms of the 11 benzimidazoles residue marker standard solution (100 μg/L), (b) blank chicken liver sample and (c) spiked chicken liver sample (500 μg/L) 1. albendazole-2-aminosulfone; 2. 5-hydroxythiabendazole; 3. thiabendazole; 4. mebendazole-amine; 5. 5-hydroxymebendazole; 6. oxibendazole; 7. oxfendazole; 8. oxfendazole sulphone; 9. flubendazole; 10. fenbendazole; 11. ketotriclabendazole.
2.2 提取溶剂的选择
与大多数标准和文献所采用的提取溶剂不同,本文比较了乙腈、甲醇、80%(v/v)乙腈水溶液、二氯甲烷、乙酸乙酯或碱性乙酸乙酯(含0.15 mL 50%(质量分数)氢氧化钾水溶液,下同)[7]的提取效果。使用甲醇、80%(v/v)乙腈水溶液或二氯甲烷提取时,芬苯哒唑、奥芬哒唑等目标物质的回收率低于50%;使用乙腈、乙酸乙酯或碱性乙酸乙酯时,所有化合物的提取效率都超过90%。但在本方法的色谱条件下,乙腈提取时干扰峰远远少于采用乙酸乙酯或碱性乙酸乙酯时的干扰峰。另外,乙酸乙酯或碱性乙酸乙酯提取液在后一步净化上柱前必须进行溶剂转换,常用方法为吹氮浓缩或减压旋转蒸发浓缩至干,再用乙腈-0.1 mol/L盐酸(1∶2, v/v)溶液溶解。然而浓缩过程会引起三氯苯达唑酮的降解;而采用乙腈提取则省去浓缩步骤,加入0.1 mol/L盐酸溶液后即可上柱,且乙腈提取液对所有化合物的提取效率均可达到95%以上。因此本文选择乙腈作为提取溶剂。
2.3 净化方式的优化
本方法比较了C18、HLB和MCX固相萃取小柱的萃取效果,使用C18和HLB小柱,且上样溶液中乙腈的体积分数大于10%时,奥芬达唑-2-氨基砜和5-羟基噻苯达唑会有所损失,故乙腈提取液必须先进行浓缩,而浓缩又会导致待测化合物降解,且复溶解时有机溶剂含量低,溶解效果差,也会导致回收率降低,所以这两种固相萃取小柱均不适用。本方法选择采用MCX小柱,在乙腈体积与水相体积之比不超过三分之一的情况下,所有待测化合物在固相萃取柱上都能全部保留,提取液无需浓缩,可稀释后直接上样。

表 2 11种苯并咪唑类药物残留标志物的回归方程、相关系数(r)和定量限
Y: peak area;X: mass concentration, μg/L.
采用MCX固相萃取小柱进行净化时,11种待测化合物存在两种不同的保留机理,对于三氯苯达唑酮而言,填料中的N-乙烯基吡咯烷酮-二乙烯苯共聚物起反相吸附的作用;而对于其余10种化合物而言,不仅存在反相吸附作用,填料中共聚物基质上键合的磺酸基还起到离子交换的作用。故对于上柱、淋洗和洗脱溶液会有更多限制条件,需要兼顾溶液的酸碱性和其中有机溶剂所占的体积分数。按照GB/T 21324-2007《食用动物肌肉和肝脏中苯并咪唑类药物残留量检测方法》中所用的过柱条件处理加标样品,三氯苯达唑酮会随淋洗液流出,导致回收率为零。在本方法的上柱溶液中,乙腈与0.1 mol/L盐酸溶液的体积比为1∶2,若比例为1∶1,三氯苯达唑酮几乎不被小柱保留,损失大半,而淋洗使用的0.1 mol/L盐酸-甲醇溶液中甲醇的体积分数也不宜超过30%;另一淋洗溶液5%(v/v)氨水溶液能有效去除奥芬达唑-2-氨基砜和5-羟基噻苯达唑两个峰之间的杂质,若采用0.1 mol/L盐酸溶液则不能去除该杂质;若用氨水乙腈洗脱,氨的体积分数对2-氨基-5-苯甲酰基苯并咪唑的影响较大,采用5%(v/v)氨水乙腈溶液洗脱,回收率约为50%,氨的体积分数升高,非常容易挥发,导致方法的重现性不好。最终,选择了对各组分的洗脱能力比较稳定且后续浓缩也更为容易的5%(v/v)氨水甲醇作为洗脱液。
2.4 方法学验证
2.4.1灵敏度
在空白鸡肉、鸡肝脏和鸡肾脏样品中分别添加一定浓度的苯并咪唑类药物残留标志物标准溶液,测定其S/N,以S/N≥10且回收率和相对标准偏差均符合残留检测方法要求时的含量为定量限。以峰面积(Y)对其质量浓度(X, μg/L)进行线性回归,绘制标准工作曲线(见表2)。结果表明,11种苯并咪唑类药物残留标志物在25~1 000 μg/L范围内线性关系良好,定量限能够满足相关监管部门的要求。
2.4.2准确度和精密度
准确称取5.0 g空白试样,置于50 mL离心管中,加入已知浓度的系列标准工作液,制成低、中和高3个不同水平的鸡肉、鸡肝和鸡肾组织样品,每个水平做6个平行样品,按样品前处理过程处理后分析,计算加标回收率(见表3)。结果表明,11种苯并咪唑类药物的加标回收率为70.91%~103.21%, RSD为1.48%~10.08%。
2.5 实际样品测定
采用本方法检测鸡肉、鸡肝脏及鸡肾脏样品共150份。结果显示,1个鸡肝脏样品检出阿苯达唑-2-氨基砜,含量为78 μg/kg,其余样品均未检出相关物质。
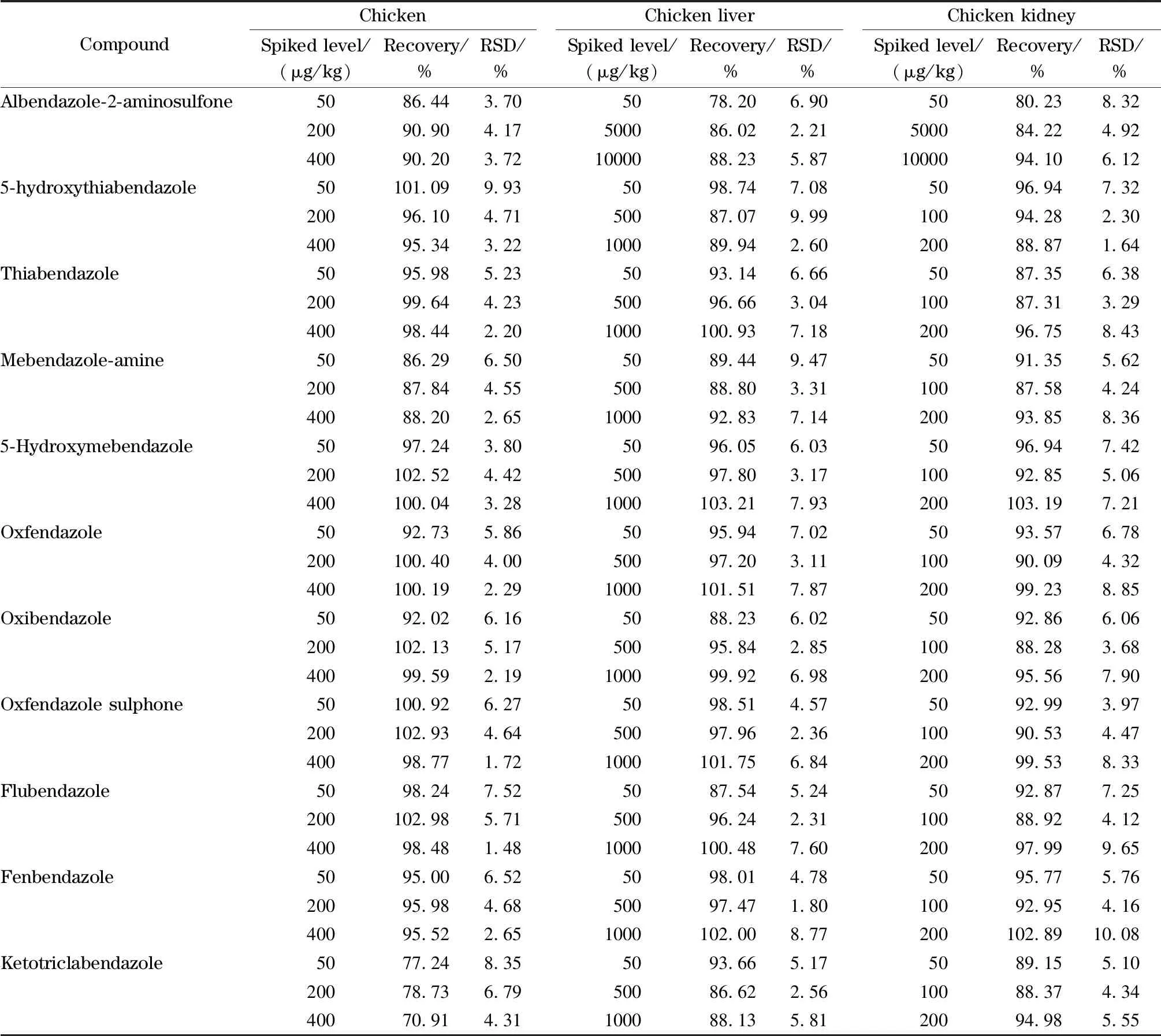
表 3 鸡肉、鸡肝脏和鸡肾脏样品中11种苯并咪唑类药物残留标志物的加标回收率及相对标准偏差(n=6)
3 结论
本文建立了高效液相色谱同时测定鸡肉、鸡肝脏和鸡肾脏中苯并咪唑类药物残留标志物的检测方法。该方法定量科学准确,抗干扰能力强,基质适应范围广,可广泛应用于鸡组织中苯并咪唑类药物残留的日常监测,能够满足我国相关监管部门的最新技术要求,为管理部门提供可靠有效的技术支持。

