入侵植物黄顶菊的植物学性状和种子传播特性观察及ITS分子鉴定
陈 曦, 李新臣, 宋小玲, 强 胜, 戴伟民
(南京农业大学杂草研究室, 江苏 南京 210095)
黄顶菊在2001年入侵中国河北和天津,引起了国内学者的广泛关注[7-11]。李香菊等[9]将河北境内的黄顶菊与Powell[2]描述的黄顶菊形态特征进行对比,推测入侵河北的黄顶菊可能是黄顶菊属的一个新的种间杂交种。白艺珍等[12]发现,黄顶菊在中国的潜在适生区域集中分布于广东、广西、云南、海南、福建、台湾、江西、湖南、贵州、四川、重庆、湖北、安徽、江苏和上海,其中高风险区域包括广东、广西、台湾、海南、福建、云南、四川、贵州和重庆等地,表明华南和西南地区比北方地区更适合黄顶菊生长。目前,黄顶菊的入侵范围已逐渐扩大到华北地区,即山东、河南、河北、天津和北京,有些野外发生点已紧邻江苏[10]。作者所在课题组在南京的温室中种植黄顶菊,发现黄顶菊能够在南京完成整个生活史。
对于入侵植物,尤其是一年生入侵植物,种子传播是其入侵成功与扩散的关键[13],快速准确鉴定入侵植物和掌握其种子传播特性,有利于制定入侵植物的防控措施;而ITS序列因其稳定性被广泛应用于属内及种间关系的研究[14-15],利用ITS序列分析可明确入侵中国的黄顶菊的分类地位,从而达到快速鉴定的目的。为此,作者以入侵天津的黄顶菊植株为研究对象,进行植物学性状观察和统计,研究黄顶菊种子的传播特性,并对其ITS序列进行测定和系统进化树分析,以期为黄顶菊的快速准确鉴定以及制定有效的防控措施提供基础研究数据。
1 材料和方法
1.1 材料
供试35株黄顶菊植株分别于2017年11月和2018年1月采自天津静海区环湖北路,具体地理坐标为北纬38°57′25″、东经117°07′41″。该区域属于暖温带半湿润大陆性季风气候,四季分明,年均温约14.5 ℃,年均降水量552.5 mm。
在南京农业大学牌楼科研基地(北纬32°01′17″、东经118°51′08″)采集加拿大一枝黄花(SolidagocanadensisLinn.)4株、紫茎泽兰〔Ageratinaadenophora(Spreng.) R. M. King et H. Rob.〕4株、胜红蓟(AgeratumconyzoidesLinn.)3株和万寿菊(TageteserectaLinn.)3株,用于ITS序列分析;其中,前3种为国内常见菊科入侵种,万寿菊为栽培种。该区域属于北亚热带湿润气候,四季分明,年均温约18 ℃,年均降水量1 081.4 mm。
1.2 方法
1.2.1 植物学性状观察和统计 于2017年11月下旬,在天津静海区环湖北路黄顶菊种群(发生面积约1 333.3 m2)中随机采集黄顶菊成熟植株,观察植株生境,并测量株高、茎直径(距地面30 cm处)和根系形态。之后将植株带回实验室,取下所有蝎尾状花序分别放于塑料袋中,将种子由蝎尾状花序中剥离后分别放于纸袋中,常温保存、备用。于2017年12月,在南京农业大学杂草研究室中统计黄顶菊花序和种子的生物学性状,包括小花数、饱满种子数和结实率以及种子的千粒质量、萌发势和萌发率。根据公式“结实率=(饱满种子数/总种子数)×100%”计算种子结实率;采用万分之一电子天平称量种子千粒质量。
在垫有2层滤纸的培养皿(直径9 cm)中均匀撒入100粒成熟饱满的种子,加入10 mL去离子水,共5皿,视为5次重复;密封后置于XZ型智能光照培养箱(宁波江南仪器厂)中培养;培养温度25 ℃、光照时间12 h·d-1、光照强度120 μmol·m-2·s-1。以种子胚根长度大于种子长度的50%视为种子萌发标准,分别在培养3和7 d时统计发芽种子数,计算种子萌发势和萌发率(分别为培养3和7 d时发芽种子数占总种子数的百分比)。
于2018年3月取约1 500粒成熟饱满的种子,播种于南京农业大学牌楼科研基地;在蝎尾状花序形成后的0、3、5、7和10 d,分别取5个蝎尾状花序正中间的头状花序,观察花序发育过程,并制做管状花子房纵切面的石蜡切片[16]。采用Olympus SZX7型体视镜(日本Olympus公司)观察管状花和舌状花的子房;采用Olympus BH4型显微镜(日本Olympus公司)观察石蜡切片,每个时期观察约50个视野;采用Image-Pro Plus 6.0图像处理软件拍照。
1.2.2 种子传播特性研究 采用郝建华等[17]的方法测定不同风力条件下黄顶菊种子的水平漂移距离。用风扇(直径250 mm、高80 cm)作为风源,释放风速0.7、1.5、2.2和3.5 m·s-1的稳定水平风;在风扇前方的降落区域内固定摆放白色纸板,用镊子轻轻夹住25粒成熟饱满的种子,在风源前释放,用卷尺(精度1 mm)测量种子在顺风条件下的水平漂移距离。采用AT816数字风速仪(深圳市希玛英豪贸易有限公司)测定风速。每次随机选取100粒成熟饱满的种子进行测定,3次重复。
只要知道非线性控制系统的状态方程,且f(x(t),u(t),t)的各阶导数均存在,就可以根据上述公式求出状态向量的逐次近似解,并且无穷级数解的极限函数即为非线性控制系统状态方程的精确解.上式可改写为:
在3 L蒸馏水中轻轻放入100粒成熟饱满的种子,分别于静止和搅拌条件下观察漂浮种子数量,每处理3次重复。采用MS-H280-Pro磁力搅拌器(美国Scilogex公司)进行搅拌处理,于转速200 r·min-1条件下搅拌5 s,每6 h搅拌1次;每6 h观察水分蒸发情况,并加入蒸馏水补足至3 L。分别于处理的0、6、12、18、24、30和36 h后统计漂浮种子的数量。
1.2.3 叶片DNA提取及ITS片段扩增和测序 于2018年4月在南京农业大学牌楼科研基地分别采集黄顶菊及上述4种菊科植物的新鲜幼嫩叶片约300 mg,用液氮充分研磨后,采用植物DNA提取试剂盒〔天根生化科技(北京)有限公司出品〕提取叶片DNA,操作参照试剂盒说明书。
根据文献[18]设计上游引物以及下游引物,上游引物ITS1的序列为5′-TCCGTAGGTGAACCTGCGG-3′,下游引物ITS4的序列为5′-TCCTCCGCTTATTGATATGC-3′。以叶片DNA为模板进行PCR扩增,反应体系总体积20.0 μL,包含2×PCR Master Mix〔购自生工生物工程(上海)股份有限公司〕10.0 μL、10 nmol·mL-1正向引物和反向引物各2.0 μL、1.0 g·μL-1模板DNA 1.0 μL和双蒸水 5.0 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸90 s,30个循环;最后于72 ℃延伸10 min。扩增产物于4 ℃保存。取扩增产物各1.5 μL,用含0.5 μg·mL-1EB的质量分数1%琼脂糖凝胶对其纯度进行电泳检测,并由南京金斯瑞生物科技有限公司进行测序。
1.3 数据处理和分析
采用SPSS 19.0软件计算数据的平均值和标准误;采用EXCEL 2013软件进行统计和作图;采用Duncan’s新复极差法进行显著性检验。
采用MEGA 7.0软件,基于文献[15,19-20],从NCBI(http:∥www.ncbi.nlm.nih.gov)中下载已公布的黄顶菊属及其近缘属植物的111条ITS序列,结合本研究获得的黄顶菊和其他4种菊科植物的ITS序列,分别用邻接法(NJ)、最大似然法(ML)和最小进化法(ME)构建系统进化树,采用自举检验法检验各分支的可靠性,共1 000次循环;建立系统进化树时,空缺(gap)作缺失(missing)处理。
2 结果和分析
2.1 黄顶菊的植物学性状及其管状花和舌状花的发育过程
黄顶菊植株的形态特征以及花序发育过程和纵切面解剖结构见图1。
观察和统计结果显示:黄顶菊株高0.3~2.0 m,距地面30 cm处的茎直径1.62~5.45 mm;根系发达,为主根系植株,但主根欠发达而须根发达(图1-A,B)。黄顶菊的花序为头状花序聚合而成的蝎尾状花序,每个头状花序包含小花1~20朵,其中,舌状花1朵、管状花0~19朵(图1-C,D,E)。黄顶菊边缘舌状花为黄色,雌性可育,具有舌状花冠,合瓣花,花冠下部连合(呈筒状),上部连合(呈扁平舌状);管状花为黄色,两性可育,花冠连合(呈管状),缘部5裂,管状花的雄蕊位于花冠的内方,花丝顶端有5个条形花粉囊组成的花药,雌蕊位于花的中央。成熟种子黑色、披针状、扁平、无冠毛,种皮具10棱痕(图1-F)。黄顶菊单株有小花8 302朵,饱满种子6 698粒,结实率为80.7%,种子千粒质量为0.224 0 g,种子萌发势和萌发率分别为86.0%和98.6%。
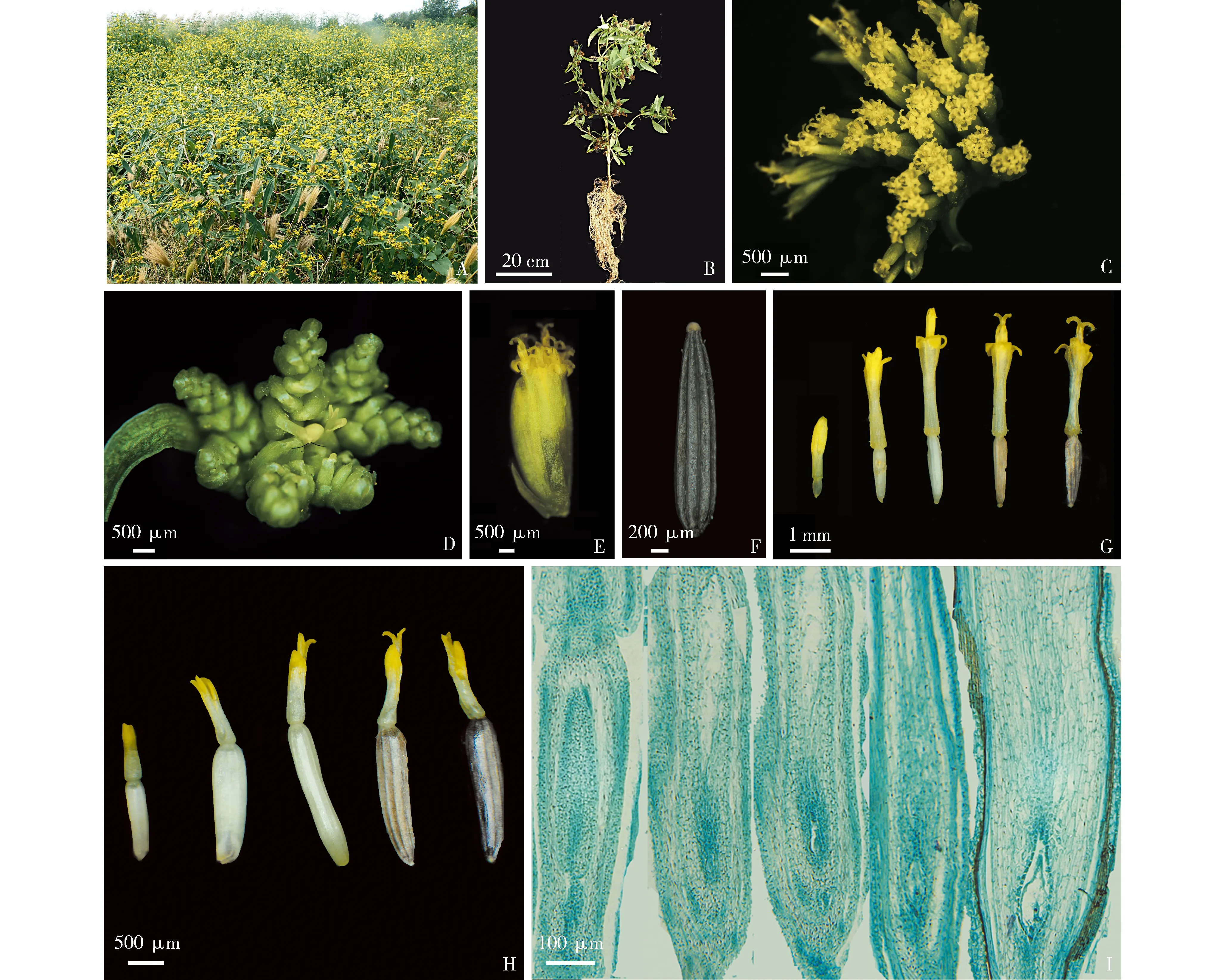
A: 群落Community; B: 单株Individual; C,D: 蝎尾状花序形态Morphology of scorpioid inflorescence; E: 头状花序形态Morphology of capitulum; F: 成熟种子Mature seed; G: 管状花的下位子房发育过程Development process of inferior ovary of tubular floret; H: 舌状花的下位子房发育过程Development process of inferior ovary of ray floret; I: 管状花子房纵切面的解剖结构 Anatomic structure of longitudinal section of ovary in tubular floret. 图1 黄顶菊植株和花序的形态及其管状花和舌状花的发育过程Fig. 1 Morphology of plant and inflorescence of Flaveria bidentis (Linn.) Kuntze and development processes of its tubular floret and ray floret
当黄顶菊的蝎尾状花序形成后,随着时间的推移,管状花和舌状花均逐渐发育。管状花的黄色花冠逐渐伸长,柱头露出后展开为鸭舌二裂状,下位子房颜色由浅绿色转变为白色,最终变为黑色,下位子房的形状也由椭球状逐渐伸长至披针状(图1-G)。舌状花的下位子房由浅绿色转变为白色,最终变为黑色,披针状下位子房逐渐伸长并加粗(图1-H)。管状花和舌状花的下位子房均发育出细胞型胚乳,在初生胚乳分裂后即产生细胞壁,形成胚乳细胞(图1-I)管状花和舌状花均可结实,二者的种子在形态和活力上无明显差异。
2.2 黄顶菊种子的传播特性
2.2.1 风传播特性 在不同风速下黄顶菊种子水平漂移距离见图2。结果显示:在0.7~3.5 m·s-1风速范围内,随风速增大黄顶菊种子的水平漂移距离逐渐增大,且差异显著(P<0.05)。其中,在0.7 m·s-1风速(相当于自然界中一级风)下,种子的水平漂移距离最小,仅为19.46 cm;在3.5 m·s-1风速(相当于自然界中三级风)下,种子的水平漂移距离最大,达到60.54 cm,显示黄顶菊种子具有随风传播能力。
2.2.2 水漂浮性 在静止和搅拌条件下,经不同浸泡时间后黄顶菊漂浮种子数的差异见表1。结果显示:浸泡6~36 h,静止与搅拌处理的漂浮种子数差异明显。在搅拌条件下,随搅拌次数和浸泡时间的增加,漂浮种子数逐渐减少,浸泡36 h(6次搅拌)后已无漂浮种子。在静止条件下,浸泡36 h后仍无种子下沉,漂浮种子数保持恒定,显示黄顶菊种子具有长时间的漂浮能力和随水流长距离传播的可能性。

不同小写字母表示差异显著(P<0.05)Different lowercases indicate the significant (P<0.05) difference.图2 不同风速下黄顶菊种子的水平漂移距离Fig. 2 Horizontal dispersal distance of seed of Flaveria bidentis (Linn.) Kuntze at different wind speeds



处理Treatment不同浸泡时间的漂浮种子数1) Number of floating seed at different soaking times1)0 h6 h12 h18 h24 h30 h36 h静止Motionless100.0±0.0a100.0±0.0a100.0±0.0a100.0±0.0a100.0±0.0a100.0±0.0a100.0±0.0a搅拌Stirring100.0±0.0a76.0±4.6b24.0±3.6c10.0±2.0d7.3±1.5d0.7±0.6d0.0±0.0d
1)同行中不同的小写字母表示差异显著(P<0.05)Different lowercases in the same row indicate the significant (P<0.05) difference.
2.3 黄顶菊叶片ITS片段测序及其遗传关系分析
对供试的黄顶菊单株以及加拿大一枝黄花、紫茎泽兰、胜红蓟和万寿菊单株叶片的ITS片段进行扩增,结果见图3。对获得的ITS片段进行测序,结果显示:黄顶菊、加拿大一枝黄花、紫茎泽兰、胜红蓟和万寿菊的ITS片段的平均长度分别为682、661、674、693和686 bp,各片段序列已登录至GenBank。其中,3株黄顶菊的ITS序列登录号分别为MK729066、MK729067和MK729068,4株加拿大一枝黄花的ITS序列登录号分别为MK729073、MK729074、MK729075和MK729076,4株紫茎泽兰的ITS序列登录号分别为MK729069、MK729070、MK729071和MK729072,3株胜红蓟的ITS序列登录号分别为MK729087、MK729088和MK729089,3株万寿菊的ITS序列登录号分别为MK731978、MK731979和MK731980。
基于上述5种植物的17条ITS序列,并从NCBI查询获得黄顶菊属及其近缘属植物的111条ITS序列,对ITS序列的碱基位点进行比对,结果显示:与其他植物相比,供试黄顶菊的ITS序列含有变异位点310个、简约信息位点284个、保守位点242个和自裔位点26个;T(U)、C、A和G的碱基数分别占碱基总数的26.6%、23.6%、24.0%和25.8%。供试黄顶菊与原产地黄顶菊的ITS序列完全一致。
采用邻接法、最大似然法和最小进化法分别构建系统进化树, 3种方法构建的系统进化树中各样本的系统关系基本一致。从NJ系统进化树(图4)上可见:供试黄顶菊与原产地黄顶菊的遗传距离最近,而与其他4种供试菊科植物以及黄顶菊属及其近缘属植物的遗传距离均较远。
M: DNA marker; 1-3: 黄顶菊Flaveria bidentis (Linn.) Kuntze; 4-7: 加拿大一枝黄花Solidago canadensis Linn.; 8-11: 紫茎泽兰Ageratina adenophora (Spreng.) R. M. King et H. Rob.; 12-14: 胜红蓟Ageratum conyzoides Linn.; 15-17: 万寿菊Tagetes erecta Linn.图3 黄顶菊及其他4种菊科植物的ITS片段扩增图谱Fig. 3 ITS fragment amplification map of Flaveria bidentis (Linn.) Kuntze and other four species in Asteraceae
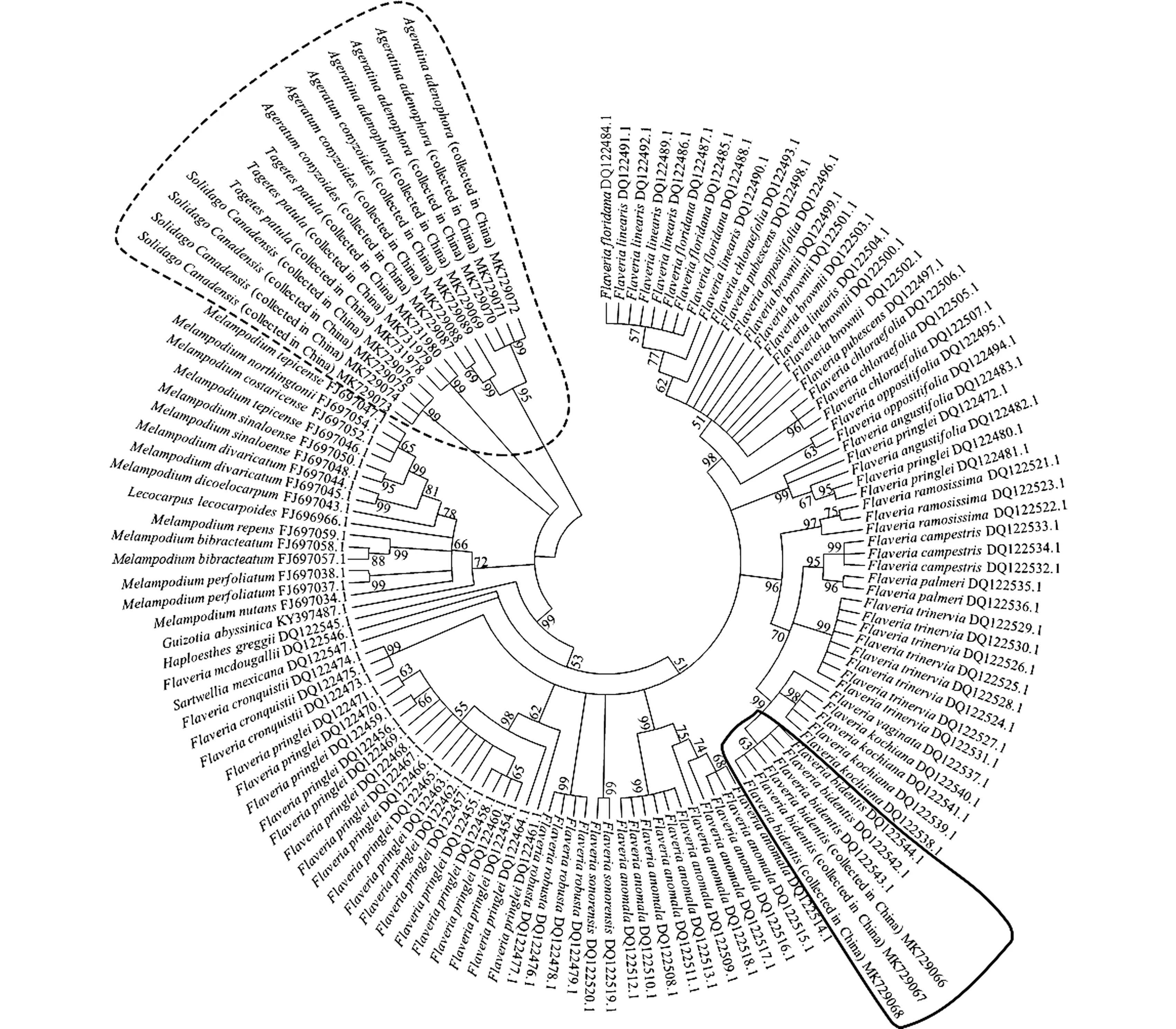
实线框内样本为供试黄顶菊以及产自南美洲的黄顶菊Samplings in solid box are the tested ones of Flaveria bidentis (Linn.) Kuntze and the ones from South America; 虚线框内样本为供试的加拿大一枝黄花、紫茎泽兰、胜红蓟和万寿菊Samplings in dashed box are the tested ones of Solidago canadensis Linn., Ageratina adenophora (Spreng.) R. M. King et H. Rob., Ageratum conyzoides Linn. and Tagetes erecta Linn. 分支上的数据为自展支持率 The data on the branches indicate the bootstrap values.图4 基于ITS序列构建的黄顶菊及菊科其他植物的NJ系统进化树Fig. 4 NJ phylogenetic tree of Flaveria bidentis (Linn.) Kuntze and other species in Asteraceae based on ITS sequence
3 讨论和结论
3.1 供试黄顶菊与原产地黄顶菊的形态特征差异
Powell[2]对原产地黄顶菊形态的描述为:一年生草本;株高100 cm;茎被短绒毛;叶蓝绿色,无毛或密被短柔毛,披针状、椭圆形,有锯齿或刺状锯齿;头状花序总苞片一般为3(4),每个头状花序包含小花2~9朵,其中,舌状花0~1朵、管状花2~8朵。刘全儒[8]和李香菊等[9]通过观察和比较,认为中国出现的黄顶菊茎和叶的形态特征与原产地基本一致,但株高、头状花序总苞片数以及头状花序所包含的管状花数均高于原产地。本研究结果显示:天津的黄顶菊根、茎、叶的形态特征与刘全儒[8]和李香菊等[9]的描述较为一致,且管状花数(0~19朵)也多于原产地。导致这种现象的可能原因有2个:一是黄顶菊在中国的入侵地的地理位置与原产地有较大差异,导致其遗传分化,表现出植株变高、小花数增加,以适应入侵地的生境;二是属内种间易杂交导致形态的变化[9]。ITS序列分析结果表明:在NJ系统进化树上,供试黄顶菊与原产地黄顶菊的遗传距离最近,而与其他4种供试菊科植物以及黄顶菊属及其近缘属植物的遗传距离均较远。说明入侵天津后黄顶菊形态上的变化是其对入侵地生境适应的结果,并非杂交产生的遗传变异。
3.2 黄顶菊种子的传播特性
作为一年生菊科入侵植物,黄顶菊的危害性极大,其单株最高可产生30多万粒种子[21]。自2001年发现黄顶菊入侵中国[8,22]后,尽管采取了多种防控措施,但由于其传播方式不明确,依然呈现入侵面积逐渐扩大的趋势。虽然本研究测定的种子数较少,但随机测定的结实总量依然达到每株近万粒饱满种子,萌发率高达98.6%,对入侵地的生态环境造成极大威胁。此外,本文测定的种子数偏少可能是由于不同的生长环境和地点,植株的结实量不同。
郝建华等[17]对10种菊科外来种类的研究结果表明:在风的作用下,对种子水平漂移距离影响最大的因子是连萼种子的质量和冠毛长度。本研究中,黄顶菊种子在3.5 m·s-1风速(相当于自然界中三级风)下水平漂移距离在1 m以下,与黄顶菊种子无冠毛且种子质量较大有关。黄顶菊种子的这一传播特性也是其自入侵中国以来目前仍主要分布于华北地区的原因之一。陆秀君等[23]认为,在持续浸泡3个月后,黄顶菊的种子仍有约10%的萌发力。本研究结果表明:黄顶菊种子的漂浮能力较强,且在静水状态下其种子能维持较高的萌发率。据此推测黄顶菊种子一旦随风扩散到水流的上游,很可能随水流传播到下游各处,并依靠其种子数量大、活力强的繁殖特性而快速定植,从而对入侵地的乡土植物产生危害。
3.3 黄顶菊的防治措施
目前,对黄顶菊的防治措施主要有人工拔除、化学防除和生物防除3类:人工防除主要是利用人工对黄顶菊进行定期的拔除[24],但这类措施用工量大,无法实施大面积的防除;化学防除主要以灭生性除草剂及激素类除草剂对黄顶菊进行防除[25],该类措施的防除效果明显,但大量使用则存在防治成本高且对环境有潜在危害的问题;生物防除可利用与黄顶菊具有较强竞争优势的植物作为其替代控制种类,从而达到防除的目的[26-30],但替代种植过程相对缓慢,无法实现快速防控的目的。在植物的生殖生长阶段,花期是对环境胁迫的敏感时期,同时也是决定种子产量的主要环节[31]。因此,对于黄顶菊这类一年生草本入侵植物,如果在其开花结实期(如花芽分化期)用低浓度花芽抑制剂进行处理,通过抑制其花芽分化降低其结实率和种子萌发力,使其不能完成整个生活史,既可以有效防止黄顶菊的大面积扩散和入侵,又能降低防治成本,从而达到绿色防治的目的。
致谢:中国农业科学院皇甫超河研究员和河北省农林科学院王贵启研究员对野外采样和调查工作提供了帮助,在此表示感谢!

