基于紫杉醇不良反应的合理用药分析
何小霞,王 俊 ,谭 斌,晏永波,曾小青,程宏文,邓秀蓉
(重庆市万州区人民医院药剂科,重庆 404100)
紫杉醇(paclitaxel)是从红豆杉中分离出来的一种抗肿瘤药物,抗癌机制独特。紫杉醇在杀灭肿瘤细胞的同时,也会对正常组织及器官造成一定损害,导致一系列不良反应,包括神经系统损伤、骨髓抑制、胃肠道反应及过敏反应等[1]。重庆市渝东北片区是三峡库区的腹心地带,既有较发达的中心城市和较大规模的工业产业,又有连片特困地区,区域内整体医疗条件较差且分布不均衡;抗肿瘤药品不良反应监测起步晚,监测数据不全。为了解重庆市渝东北片区紫杉醇应用过程中不良反应的种类、发生频率及严重程度,同时对比其他地区报道的数据,尤其是发达地区的数据,为提高本地区不良反应上报完整性和准确性提供参考。本研究中回顾性分析了2016年3月至2017年3月应用紫杉醇的肿瘤住院患者临床资料,现报道如下。
1 资料与方法
收集2016年3月至2017年3月在重庆市渝东北片区二级以上医院确诊并经紫杉醇治疗的患者病历。通过医院信息系统(HIS)查阅患者的病历,设计统计表格,包括患者基本信息、化学治疗(简称化疗)方案、预处理方案、不良反应类型、发生时间及症状。不良反应分级按抗癌药急性及亚急性毒性反应分度标准[世界卫生组织(WHO)标准]进行分类,应用Excel 2016软件分析。
2 结果
2.1 基本情况
共收集到符合要求的患者428例,病历中记录有不良反应的102例,其中非小细胞肺癌25例,卵巢癌19例,乳腺癌21例,头颈部癌12例,食管癌17例,非霍奇金淋巴瘤4例,纤维肉瘤4例。患者年龄34~81岁,平均(67.7 ± 4.5)岁,详见表 1。
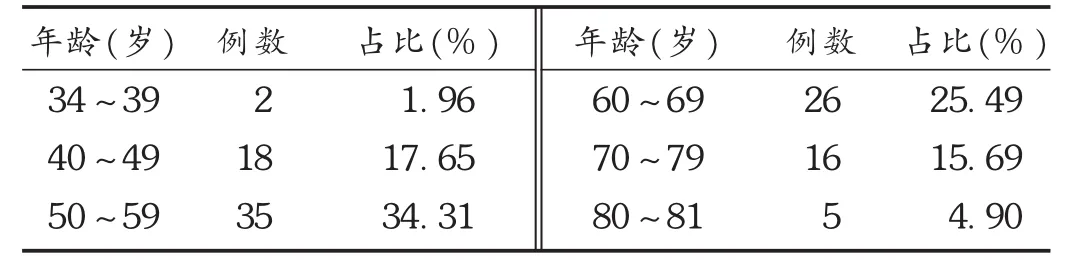
表1 102例患者年龄分布
2.2 区县分布
结果见表2。
2.3 化疗方案
102例不良反应中,方案包括TP方案(紫杉醇+顺铂)46例、单用紫杉醇方案21例、TC方案(紫杉醇+卡铂)17例、TL方案(紫杉醇+洛铂)11例、其他方案7例。
2.4 预处理方案
紫杉醇预处理采用地塞米松20 mg+苯海拉明40 mg+西咪替丁 400 mg方案最多,有 46例(45.10%);无任何预处理措施19例(8.63%),主要集中在未设置肿瘤科的二级医院及综合医院的非肿瘤专科医嘱;地塞米松20 mg+苯海拉明40 mg方案、地塞米松20 mg+异丙嗪25 mg+西咪替丁400 mg方案、单用地塞米松20 mg方案分别有8例、11例和11例。
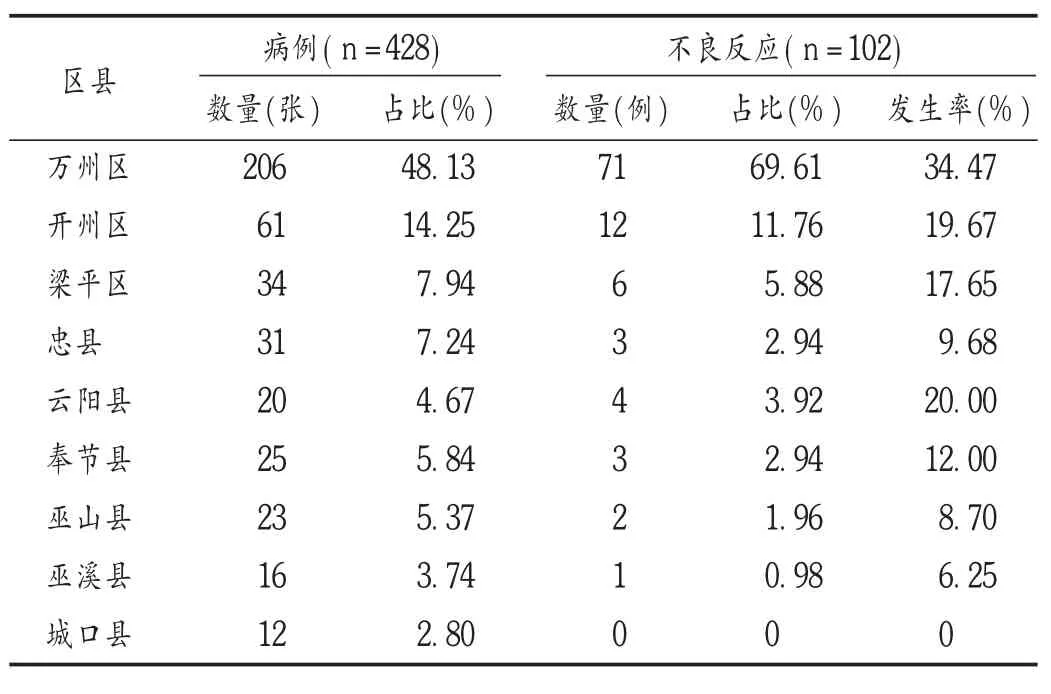
表2 不良反应区县分布
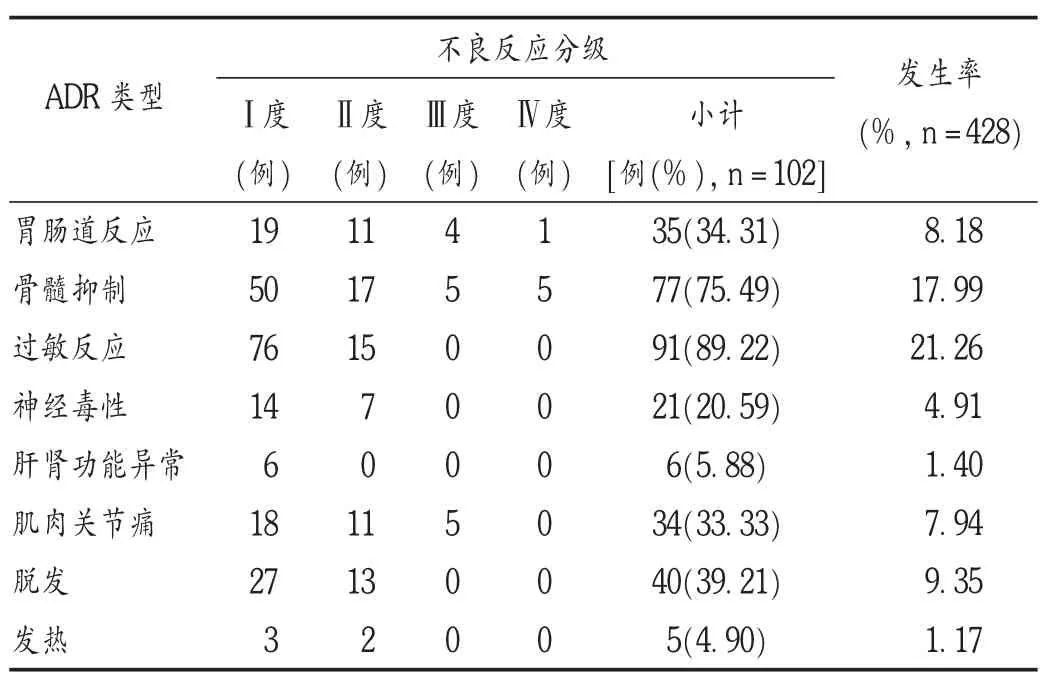
表3 不良反应分级及发生率
2.5 不良反应分级
根据世界卫生组织(WHO)抗癌药物毒性反应分级,将患者用药后出现的不良反应进行分级,详见表3。
3 讨论
本研究中,428例患者中发生不良反应102例,发生率为23.83%,低于张清[2]报道的28.75%。可能的原因是渝东北地区医疗条件较差和医务工作者不良反应上报意识较弱。纳入本研究的病例中,主要诊断为非小细胞肺癌、卵巢癌、乳腺癌、食管癌,与紫杉醇的抗肿瘤适应证和本地区肿瘤谱[3]基本吻合。肿瘤化疗方案选择最多的是TP方案,其次为紫杉醇单药化疗方案,患者化疗方案的选择与主要诊断相适应。年龄构成方面,年龄最小为34岁的非霍奇金淋巴瘤患者,年龄最大为81岁的食管癌患者,50~59岁的患者占比最多,达34.31%,与赵明月等[4]报道的数据相似。
由表2可见,区域分布方面,渝东北片区医疗中心万州区206例病例中发现不良反应最多,在较偏远的城口县12例中未发现不良反应。提示区域内整体医疗条件分布不均衡,除中心城市外的其他区县,不良反应发生率普遍较低,可能由于医务工作者不够重视。
由于紫杉醇预处理方案可见,符合(包括基本符合)药品说明书要求的预处理方案有57例(55.88%),在肿瘤专科病区医嘱中基本能按药品说明书要求预处理。无任何预处理措施的病例占18.63%,主要集中在无肿瘤专科病区的医院。反映本地区合理用药意识非常弱,急需临床药师参与病区查房,指导合理用药。
由表3可见,不良反应类型占比最高的是过敏,其次是骨髓抑制、脱发、胃肠道反应和肌肉关节疼痛,最低的为发热。各类不良反应占比明显低于赵明月等[4]报道的北京地区的数据,可能与地区肿瘤疾病谱不同有关,也可能是因为北京地区的医疗中心会自动筛选患者。
因为紫杉醇在水中溶解度很低,加入聚氧乙烯蓖麻油(cremophor EL)和无水乙醇(50 ∶50)混合液来助溶,而聚氧乙烯蓖麻油易导致患者发生变态反应。故过敏反应是常见的不良反应,主要表现为皮肤瘙痒、面部潮红等轻度反应。本研究入选病例过敏反应发生率最高,超过30%的患者为首次接受紫杉醇治疗,故对于首次输注紫杉醇的患者应给予足够重视。可加用0.22 μm微孔膜滤过装置滤除沉淀而有效降低严重不良反应的发生率[5];或先将小剂量紫杉醇加入100 mL溶剂中静脉输注,无反应后再将余量加入500 mL溶剂中,用聚乙烯输液器恒速静脉输注3 h,以减轻患者的痛苦[6]。本研究中过敏反应发生率远低于BEGER等[7]报道的40% ~78%。提示医务工作者可能对不良反应还不够重视或病历书写不完整。
骨髓抑制主要表现为血小板和白细胞减少,于治疗后1周左右开始出现,2~3周恢复。大多数为较轻微的Ⅰ度骨髓抑制,有5例Ⅳ度骨髓抑制患者暂停或延期化疗。因此,接受紫杉醇治疗时需密切监测血常规,必要时给予粒细胞集落刺激因子[8]。但本研究中骨髓抑制发生率为18%,与黄淑娟[9]所报道的80%有很大差距。相比其他类型不良反应,骨髓抑制发生率相对较高,仅次于过敏反应。判断患者是否发生骨髓抑制主要来源于患者的检验数据,不管医师是否记录在病历中。但超过1/2的患者住院期间只监测1~2次血常规,并不能完全记录患者骨髓抑制最严重时的数据,且出院后复查的检验数据无法调取。
本研究中脱发发生率为9.35%,可能与实际情况有一定差距。因为病历中基本无相关描述,数据来源为患者主诉因脱发导致的心理问题,不愿意外出,不希望病情被他人知晓。何明珠等[10]报道,肿瘤化疗患者的心理韧性普遍较低。因此,关注肿瘤患者心理健康、提高心理韧性,对于提高治疗效果十分关键。
胃肠道反应主要表现为恶心呕吐和腹胀腹痛,发生率为8.18%,大部分为轻度恶心呕吐,其中4例患者呕吐经地塞米松+西咪替丁+托烷司琼治疗后好转;1例患者发生难治性呕吐,严重影响生活质量。化疗前给予地塞米松、苯海拉明、西咪替丁预处理后,会大大降低患者的胃肠道反应,必要时加入5-HT3受体拮抗剂和NK1受体拮抗剂治疗顽固性呕吐[11]。
神经毒性发生率为4.91%,主要表现为感觉神经障碍,如手指麻木,受冷加重,且与剂量呈正相关。肌肉关节痛发生率为7.94%,症状程度与剂量呈正相关,疼痛部位主要是手臂和下肢关节,常出现于用药后2~3 d内,短时间内可恢复。紫杉醇导致的肝肾功能异常发生率为1.40%,化疗前需要全面检查,对已有肝肾功能不全患者需详细评估后方可使用。发热发生率为1.17%,多为低热,用药期间应密切监测。
综上所述,对渝东北片区紫杉醇不良反应的分析发现,总不良反应发生率低于其他报道,每类不良反应的数据也普遍低于其他地区的报道,尤其是沿海发达地区。结合本地区相对滞后的合理用药意识,提示可能的原因是医务人员不良反应意识较弱,许多不良反应发生了但没有认识到,认识到了但在病程记录中无记录。因此,加强合理用药宣传,提高医务工作者对药品不良反应的意识是当下的重点工作。

