黄曲霉拮抗菌B10-6-1脂肽类抗生素粗提物的性质与抑菌机理研究
张学雯 王奕丁 李红亚

摘要:采用酸沉醇提法从菌株B10-6-1发酵液中提取脂肽类抗生素粗提物,采用抑菌圈法确定其最低抑菌浓度及抑菌谱,考察温度、pH、蛋白酶、金属离子、EDTA等因素对其抑菌活性的影响;通过孢子萌发法和显微观察法考察脂肽类抗生素粗提物对黄曲霉(Aspergillus flavus)菌孢子萌发和菌丝的作用。结果表明,脂肽类抗生素粗提物的最低抑菌浓度为4 g/L,在40 ℃,pH为8时抑菌活性最高;温度、pH、蛋白酶、金属离子、EDTA对脂肽类抗生素粗提物抑菌活性都没有较明显的影响;该粗提物抑菌谱广泛,对白菜黑斑菌、小麦纹枯菌等9株真菌都有明显抑制作用。脂肽类抗生素粗提物处理菌丝可使菌丝细胞壁出现消融,并使孢子的萌发率降低,即该物质是通过抑制黄曲霉菌孢子萌发和菌丝生长起到抑菌作用的。
关键词:黄曲霉(Aspergillus flavus)拮抗菌;脂肽类抗生素粗提物;性質鉴定;抑菌机理
中图分类号:S476 文献标识码:A
文章编号:0439-8114(2019)14-0070-06
Abstract: The crude lipopeptide extract was extracted from the fermentation broth of strain B10-6-1 by acid precipitation. The minimum inhibitory concentration and the antimicrobial spectrum were determined by the inhibition circle method. The effects of temperature, pH, protease, metal ions, EDTA and other factors on the bacteriostatic activity were investigated. The effects of crude lipopeptide extracts on Aspergillus flavus spore germination and hyphae were investigated by spore germination and microscopic observation. The results showed that the minimum inhibitory concentration of crude lipopeptide extract was 4 g/L, with the highest inhibitory activity at 40 ℃ and pH of 8, while temperature, pH, protease, metal ion and EDTA had no obvious effect on the antibacterial activity of crude lipopeptide extract. The antifungal spectrum of the crude extract was extensive and had obvious inhibitory effect on 9 strains of fungi such as Alternaria brassicae and Rhizoctonia cerealis etc. The mycelium treated with lipopeptide extract could dissolve the site of mycelium cell wall and decrease the germination rate of spores, which could inhibit the germination of Aspergillus flavus spores and the growth of hyphae.
Key words: Aspergillus flavus antagonistic bacteria; crude extract of lipopeptide antibiotics; characterization; antibacterial mechanism
黄曲霉(Aspergillus flavus)菌在自然界中分布广泛,它主要的危害是感染玉米、花生和其他粮食作物,产生黄曲霉毒素[1,2]。黄曲霉毒素是毒性最强且能够引起生物污染的生物毒素之一,会对人体和动物的肝脏造成严重损害,低于1 mg/kg即可导致半数致死[3,4]。
在对黄曲霉菌的防治中,生物防治技术受到了国内外科学家的青睐。它与化学防治方法相比,具有显著的抗菌效果,且对环境友好,是减少或完全清除黄曲霉菌污染最有前景的方法[5]。迄今为止,已有不少研究者从曲霉、芽孢杆菌、乳酸菌和酵母菌中筛选出了能够抑制黄曲霉菌的菌株[6-9]。其中,芽孢杆菌因为可以生产多种酶和抗生素,对人和动物无毒无害,具有广谱的抗菌活性和强大的抗菌性能等诸多优点,已经被广泛地应用于农业生产之中[10-14]。
目前,国内外许多科学家致力于黄曲霉拮抗菌拮抗物性质和抑菌机理的研究,且取得了可喜进展。已有文献报道黄曲霉拮抗菌拮抗物大多为蛋白质,并对其抑菌谱、性质及抑菌机理进行了研究。李金芝[15]发现空气芽孢杆菌Y-17-3的蛋白粗提液对温度和pH非常敏感,可以抑制黄曲霉菌丝的生长和孢子的萌发。章挺等[16]发现枯草芽孢杆菌B-SF06蛋白粗提液有广谱抑制真菌活性,对黄曲霉菌丝生长和孢子萌发有显著抑制作用,且不会受到温度和酸碱度影响。也有学者报道其他的抗菌物质,如周启升等[17]发现拮抗链霉菌S24产生的抗菌物质为多烯类,主要成分由四烯和五烯两类多烯大环内酯类抗生素组成,能够有效抑制黄曲霉菌丝的生长及孢子的萌发。也有拮抗菌产生脂肽类抗生素的报道,如Moyne等[18]从枯草芽孢杆菌发酵液中分离到2种质量相近的脂肽类抗生素,可以有效抑制黄曲霉生长。但关于脂肽类抗生素的结构、性质及作用机制,尚缺乏深入研究。
前期试验中已经筛选出一株黄曲霉拮抗菌B10-6-1(Bacillus amyloliqufaciens),经酸沉醇提法探明其拮抗物质不是蛋白类,而是脂肽类抗生素,且其抑菌活性显著高于已有菌株,具有开发成新型生物农药的潜力。关于脂肽类抗生素的报道较少,因此,有必要对其性质及抑菌机理进行深入研究,结果可为黄曲霉拮抗菌B10-6-1的进一步实际应用,以及黄曲霉抑制剂的开发奠定科学基础。
1 材料与方法
1.1 材料
1.1.1 菌种 黄曲霉菌株由广东省农业科学院作物研究所花生研究室馈赠。黄曲霉拮抗菌B10-6-1由河北农业大学生命科学学院制药工程系筛选并保藏。
1.1.2 培养基 牛肉膏蛋白胨培养基、马铃薯葡萄糖琼脂培养基参见文献[19]。发酵培养基:玉米粉3.0 g,黄豆饼粉2.0 g,氯化钾0.13 g,无菌水1 000 mL。
1.2 方法
1.2.1 发酵培养 挑取菌株B10-6-1的菌苔转接到牛肉膏蛋白胨液体培养基中,180 r/min、37 ℃摇床培养12 h得到种子液。将种子液以3%的接种量接种于发酵培养基中,同样条件下培养72 h得发酵液。
1.2.2 脂肽类抗生素粗提物的制备 脂肽类粗提物的提取采用酸沉和甲醇提取的方法。将上述发酵液于4 ℃,8 000 ×g离心20 min除去菌体,上清液用6 mol/L的浓盐酸调pH至2.0,在4 ℃环境下静置过夜,8 000×g离心20 min得沉淀,沉淀用甲醇抽提2次,8 000×g离心15 min除去沉淀。合并甲醇抽提液,旋转蒸发除去甲醇后,即为脂肽类抗生素粗提物[20]。
1.2.3 脂肽类抗生素粗提物的最低抑菌浓度 以二倍稀释法稀释脂肽类抗生素粗提物,将其制成不同浓度(32.00、16.00、8.00、4.00、2.00、1.00、0.50、0.25 g/L),采用打孔法进行抑菌试验:在黄曲霉菌的混菌平板小孔内加入70 μL上述待测溶液,将该病原菌平板置于28 ℃下培养48 h后观察抑菌效果,测定抑菌圈直径大小。当没有明显的抑菌圈出现时,则可将此浓度视为最低抑菌浓度。
1.2.4 金属离子对脂肽类抗生素粗提物抑菌活性的影响 将脂肽类抗生素粗提物溶于0.02 mol/L,pH 7.0的Tris-HCl缓冲液中,配制60 g/L的粗提液若干份,分别加入等体积的KCl、CaCl2、MnCl2、FeCl3、ZnCl2、NaCl、CuSO4母液,使金属离子浓度分别为25、50 mmol/L,加入无菌水作为对照,每组设3个平行,进行抑菌试验。
1.2.5 EDTA对脂肽类抗生素粗提物抑菌活性的影响 向质量浓度为60 g/L脂肽类抗生素的粗提液中分别加入等体积浓度为6.25、12.50、25.00、50.00 mmol/L的EDTA溶液,加入無菌水作为对照,每组设3个平行,进行抑菌试验。
1.2.6 pH对脂肽类抗生素粗提物抑菌活性的影响 将脂肽类抗生素粗提物用0.05 mol/L,pH分别为4.0、6.0、7.0、8.0的磷酸氢二钠-柠檬酸缓冲液和pH为10.0的甘氨酸-氢氧化钠缓冲液溶解,使最终质量浓度为30 g/L。用无菌水作为对照,每组设3个平行,进行抑菌试验。
1.2.7 温度对脂肽类抗生素粗提物抑菌活性的影响 将质量浓度为30 g/L的脂肽类抗生素粗提物经40、60、80和100 ℃水浴处理30 min,与室温(25 ℃)条件下的抑菌活性进行比较,每组设3个平行,进行抑菌试验。
1.2.8 蛋白酶对脂肽类抗生素粗提物抑菌活性的影响 向质量浓度为60 g/L的脂肽类抗生素粗提液中加入等体积胃蛋白酶和胰蛋白酶溶液,使脂肽类抗生素粗提物质量浓度为30 g/L,胃蛋白酶和胰蛋白酶的最终质量浓度为1 g/L。37 ℃孵育2 h,将体系加热至80 ℃维持10 min使酶失活终止反应。以相同浓度的未经蛋白酶处理的脂肽类抗生素粗提物作对照,每组设3个平行,进行抑菌试验。
1.2.9 脂肽类抗生素粗提物的抑菌谱 将质量浓度为30 g/L的脂肽类抗生素粗提液进行小麦纹枯菌、棉花枯萎病菌、禾谷镰刀菌、层出镰刀菌、尖孢镰刀菌、棉花黄萎菌、苹果斑点病菌、白菜黑斑病菌、恶疫霉的抑菌试验[21]。
1.2.10 黄曲霉拮抗菌株B10-6-1抑菌机理测定 将黄曲霉菌饼转接到马铃薯葡萄糖液体培养基中,180 r/min、28 ℃培养10 d后采用G2垂熔漏斗过滤发酵液,取过滤液置于灭菌试管中,振荡,采用灭菌培养基将其浓度稀释至107 CFU/mL,得到供试病原菌孢子悬液;漏斗上方菌丝用无菌培养液冲洗至无菌平皿中,在漏斗中过滤几遍,直到镜检视野里几乎看不到孢子,即得到纯净供试病原菌菌丝。菌丝与孢子液分别进行美蓝(亚甲基蓝)染色。
1.2.11 脂肽类抗生素粗提物对黄曲霉孢子的影响 用无菌水溶解脂肽类抗生素粗提物,将其配制成如下浓度:50.00、25.00、12.50、6.25 g/L。将上述溶液与孢子液等体积混合均匀,贴上标签并标记。28 ℃条件下培养,于0、24、48、72、96 h分别镜检,显微镜下观察孢子的萌发情况,并在48 h时,各取100 μL分别均匀涂布于PDA平板中,以加入等体积无菌水的孢子液作对照,每组3个平行,于72 h观察并记录各平板中的菌落数。
1.2.12 脂肽类抗生素粗提物对黄曲霉菌丝的影响 将“1.2.11”的孢子液换成菌丝液,28 ℃培养,0、24、48、72、96 h分别镜检,显微镜下观察菌丝形态变化,并在96 h后冻干,称重并记录菌丝的重量。
2 结果与分析
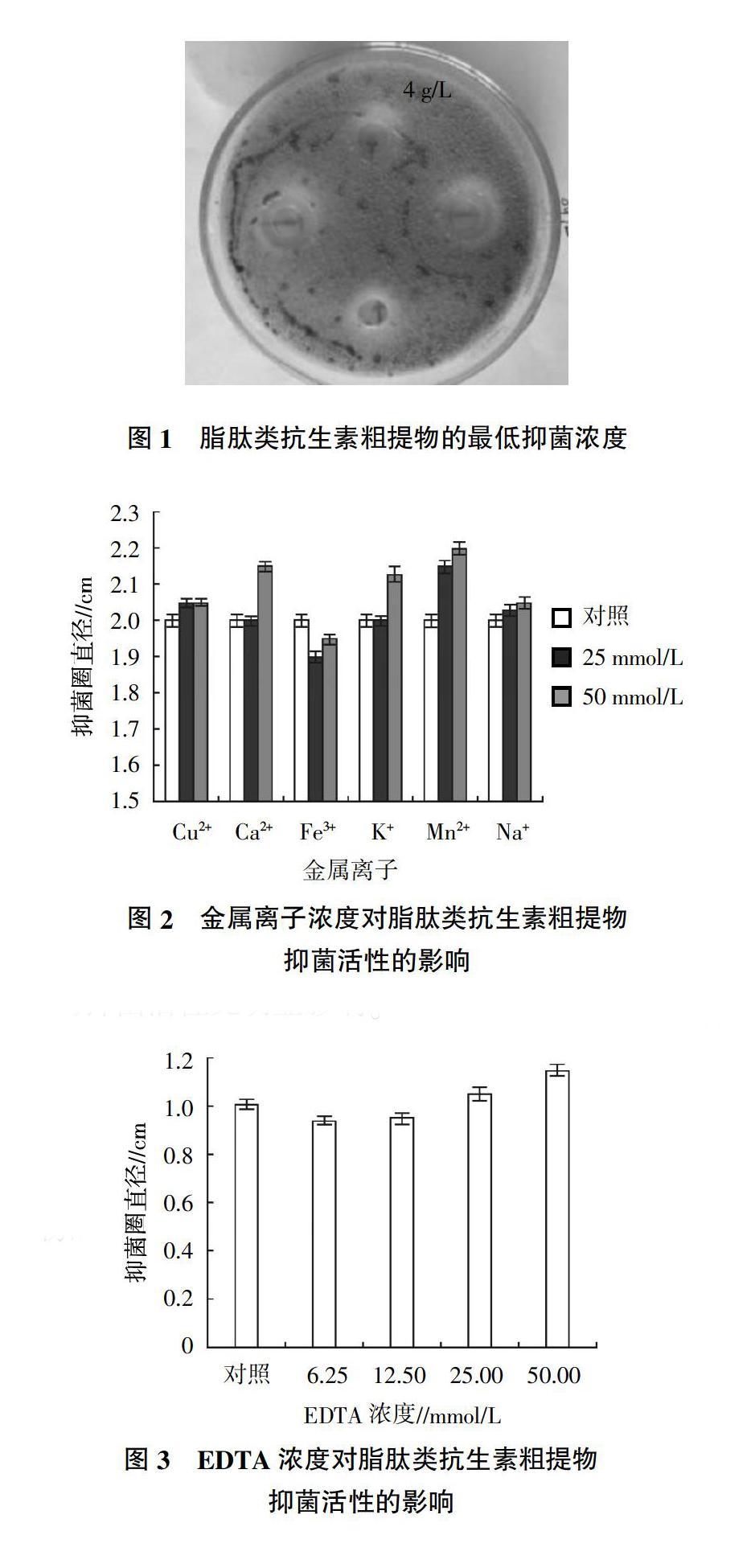
2.1 脂肽类抗生素粗提物的最低抑菌浓度
采用二倍稀释法测定到菌株B10-6-1脂肽类抗生素粗提物最低抑菌浓度为4 g/L(图1)。
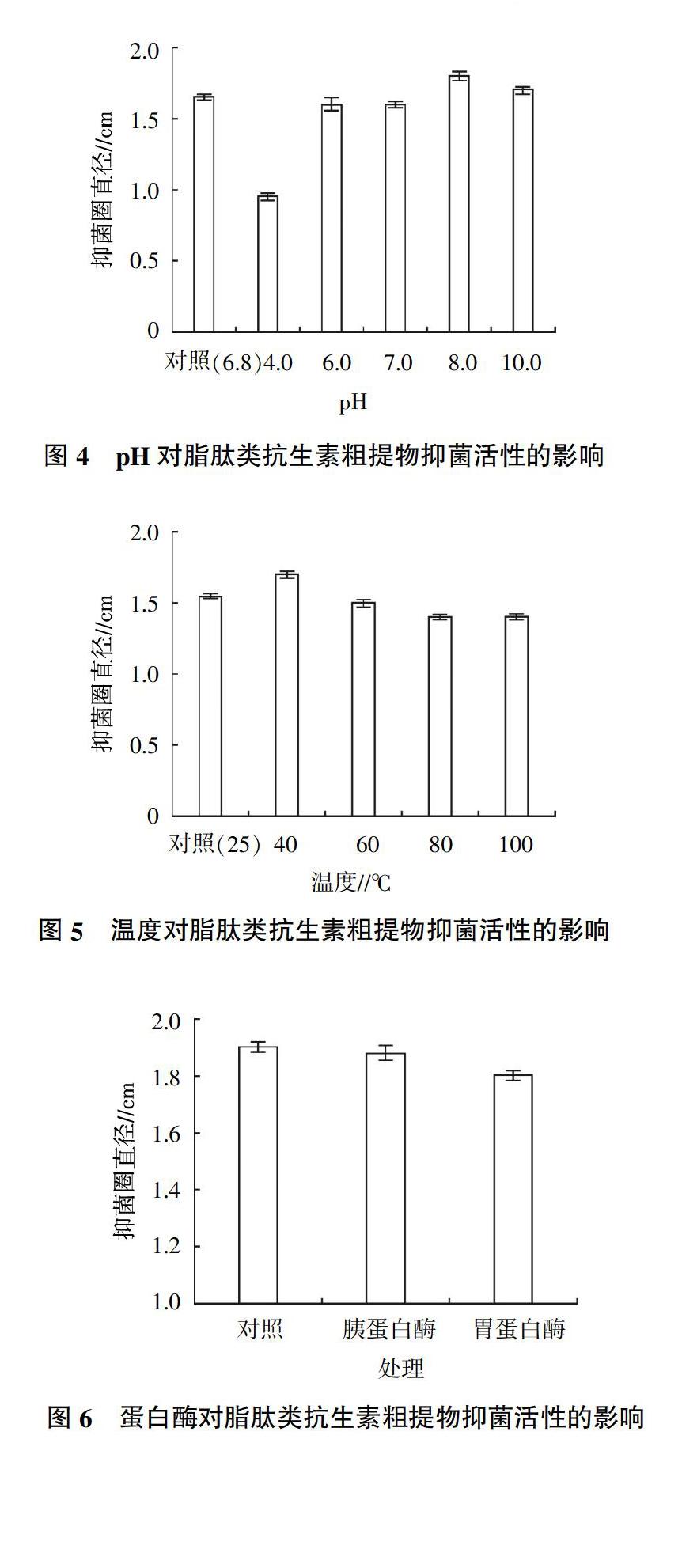
2.2 金属离子对脂肽类抗生素粗提物抑菌活性的影响
由图2可知,与对照相比金属离子Cu2+、Fe3+、Na+对脂肽类抗生素粗提物抑菌活性基本无影响,25 mmol/L金属离子Mn2+、50 mmol/L金属离子Mn2+、Ca2+、K+可使脂肽类抗生素粗提物的抑菌活性分别提高7.5%、10.0%、7.5%、6.5%。
2.3 EDTA浓度对脂肽类抗生素粗提物抑菌活性的影响
由图3可知,与对照相比,浓度为6.25、12.50、25.00、50.00 mmol/L的EDTA对脂肽类抗生素粗提物的抑菌活性无明显影响。
2.4 pH对脂肽类抗生素粗提物抗菌活性的影响
由图4可知,与对照相比,pH为6.0、7.0时对脂肽类抗生素粗提物抑菌活性无明显影响,pH为4.0时抗菌活性降低42.4%,在pH为8.0、10.0时抗菌活性分别增强9.1%、3.0%。
2.5 温度对脂肽类抗生素粗提物抗菌活性的影响
由图5可知,与对照相比,温度对脂肽类抗生素粗提物抑菌活性影响不大,但经40 ℃处理的脂肽类抗生素粗提物抑菌活性提高9.7%,经100 ℃处理的脂肽类抗生素粗提物抑菌活性保留90.3%,由此可知该脂肽类抗生素粗提物的耐热性较好。
2.6 蛋白酶对脂肽类抗生素粗提物抗菌活性的影响
由图6可知,与对照相比,经胰蛋白酶、胃蛋白酶处理过的脂肽类抗生素粗提物抑菌活性无明显影响。
2.7 脂肽类抗生素粗提物的抑菌谱
如图7所示,菌株B10-6-1脂肽类抗生素粗提物对所测的恶疫霉菌、层出镰刀菌、小麦纹枯病菌、棉花黄萎病菌、棉花枯萎病菌、尖孢镰刀菌、白菜黑斑病菌、禾果镰刀菌、苹果斑点病菌等9种真菌均有较明显的抑菌活性。其中,对层出镰刀菌的抑菌效果最好,抑菌圈直径为(1.730±0.871) cm,对其余真菌的抑菌圈直径均超过2.00 cm,对棉花黄萎病菌的抑菌效果最差,抑菌圈直径为(3.300±0.951) cm(表1)。
2.8 脂肽类抗生素粗提物对黄曲霉菌孢子萌发的影响
由表2可知,脂肽类抗生素粗提物能够抑制黄曲霉菌孢子萌发,且随着脂肽类抗生素粗提物浓度的增加,黄曲霉菌孢子的萌发率逐渐下降,即抑制作用增强。
由显微镜观察可知,与对照(图8A)相比,脂肽类抗生素粗提物作用于黄曲霉孢子后,出现孢子壁溶化,原生质体溶解,内容物分布不均、变形、空腔等异常(图8B、图8C)。且随着脂肽类抗生素粗提物浓度的增加,孢子数明显减少,死亡数明显增多,而不添加脂肽类抗生素粗提物的孢子(对照)正常萌发(图8A)。
2.9 脂肽类抗生素粗提物对黄曲霉菌丝的影响
称重结果(表3)发现,随着脂肽类抗生素粗提物浓度的升高,黄曲霉菌丝干重减少,即随着脂肽类抗生素粗提物浓度的升高黄曲霉菌丝生长受到的抑制作用增强。
镜检得知,不加脂肽類粗提液的黄曲霉菌丝正常生长,菌丝光滑,修长(图9A);而加脂肽类粗提液的黄曲霉菌菌丝形态异常,出现变粗、扭曲、皱裙、膨大、内容物流出、细胞壁消融等现象;且随着脂肽类抗生素粗提物浓度的增加,菌丝内膨大物增多,膨大扭曲加剧;原生质消融,出现透明条带;随作用时间的延长,最终菌丝体壁破裂乃至消融(图9B、图9C)。
3 小结与讨论
黄曲霉拮抗菌B10-6-1的脂肽类抗生素粗提物,最低抑菌浓度为4 g/L,在40 ℃,pH为8时抑菌活性最高,金属离子、EDTA浓度、温度、pH、蛋白酶对脂肽类抗生素粗提物抑菌活性都没有较明显的影响,其对白菜黑斑菌、小麦纹枯菌等9种真菌都有明显抑制作用,该物质通过抑制病原菌的孢子萌发和促使菌丝溶解断裂来发挥抑菌作用。
目前,国内关于芽孢杆菌的抗菌蛋白研究较多,脂肽类抗生素的报道相对较少且对其研究仍处于探索阶段[22,23]。芽孢杆菌抗菌蛋白一般具有抗真菌和细菌等特性,其抗菌谱广,稳定性高,对热、酶敏感。相比蛋白而言,小肽有许多独特特征:分子量很小,基本都是环状结构,含有一些特殊氨基酸,具有耐受高温和蛋白酶的作用等[24]。本研究中,菌株B10-6-1所产脂肽类抗生素对胰蛋白酶、胃蛋白酶不敏感,这与张宝俊等[25]研究的解淀粉芽孢杆菌LP-5抗菌蛋白和解淀粉芽孢杆菌Q-12抗菌蛋白均对胰蛋白酶、胃蛋白酶敏感不相同。对此结果进行分析,蛋白酶可以催化蛋白质水解,能将肽键分解成酸与胺两部分,胰蛋白酶仅能分解赖氨酸和精氨酸的肽键。胃蛋白酶作用的主要部位是芳香族氨基酸或酸性氨基酸的氨基所组成的肽键。据此推断本试验的脂肽类抗生素不含相应肽键,因此对胰蛋白酶和胃蛋白酶不敏感。
本研究的脂肽类抗生素在40~100 ℃热稳定性良好,且该物质有较宽的pH范围,较耐酸碱性。此结果与马俊美等[26]侧孢短芽孢杆菌S62-9所产脂肽类抗生素试验结果相同,稳定性试验结果显示,该脂肽类抗生素具有很强的热稳定性和pH稳定性。上述结果表明,此脂肽类抗生素不易受外界环境的影响,可以较长时间发挥生物学的作用,具有广阔的研究和应用价值。由此推测本试验的脂肽类抗生素属于小分子肽类,其性质可能与它的分子量小和环状结构有关。
通过脂肽类抗生素对黄曲霉菌丝的影响试验发现,菌丝发生崎形、扭曲,同时菌丝外壁的完整性出现严重破坏,内容物渗出,说明脂肽类抗生素对病原菌细胞壁与质膜的破坏是主要作用机理之一。王宇婷等[27]报道了脂肽类抗生素可影响真菌细胞壁的合成,造成真菌菌丝顶端膨大、不能正常生长,表明作用于细胞壁与细胞膜是脂肽类抗生素作用机制之一。脂肽类抗生素作用于细胞外基质生物大分子,包括抑制肽聚糖、几丁质的完整性,以及影响肽聚糖等大分子的合成、转运、交联等,而这些生物大分子的合成、完整性是菌体保持正常功能的必要条件。除对细胞壁造成影响外,脂肽类抗生素还会导致细胞膜功能紊乱,如菌体细胞膜去极化,进而离子和代谢产物泄露,呼吸作用等其他基本功能丧失直接或间接地导致细胞死亡[28-30]。为了进一步探明脂肽类抗生素作用机制,本试验后期拟进入如下研究:从空间构象的角度研究,探明脂肽类抗生素对细胞膜的作用方式;从化学物质的角度研究,探明脂肽类抗生素细胞外基质生物大分子合成与表达的方式;从分子生物学的角度研究,探明脂肽类抗生素与胞内DNA、RNA和蛋白质的相互作用。
参考文献:
[1] 范素芳,李培武,王秀嫔,等.高效液相色谱和高效液相色谱离子阱质谱测定花生、玉米和大米中黄曲霉毒素方法比较[J].食品科学,2011,32(12):254-258.
[2] 刘秀梅.加强真菌毒素暴露与控制的研究工作进一步保障食品安全[J].中华预防医学杂志,2006(5):307-308.
[3] 姚彦坡,张立田,郑百芹,等.花生黄曲霉毒素污染生防细菌筛选及菌株B85-1的鉴定与抗菌活性[J].花生学报,2016,45(3):20-26.
[4] 谢光洪,陈承祯,徐 闯,等.黄曲霉毒素检测方法的研究[J].饲料工业,2007,28(6):53-56.
[5] 闫培生,曹立新,王 凯,等.真菌毒素生物防治研究进展[J].中国农业科技导报,2008,10(5):89-94.
[6] 孔 青,刘奇正,于方塘,等.1株海洋芽孢杆菌抑制黄曲霉生长和毒素合成的研究[J].浙江大学学报(农业与生命科学版),2010, 36(4):387-392.
[7] SHUKLA R,SINGH P,PRAKASH B,et al. Antifungal, aflatoxin inhibition and antioxidant activity of Callistemon lanceolatus (Sm.)Sweet essential oil and its major component 1,8-cineole against fungal isolates from chickpea seeds[J].Food control,2012,25(1):27-33.
[8] ALINEZHAD S,KAMALZADEH A,SHAMS-GHAHFAROKHI M,et al. Search for novel antifungals from 49 indigenous medicinalplants:Foeniculum vulgare and Platycladus orientalis as strong inhibitors of aflatoxin production by Aspergillus parasiticus[J].Annals of microbiology,2011,61(3):673-681.
[9] GERBALDO G A,BARBERIS C,PASCUAL L,et al. Antifungal activity of two Lactobacillus strains with potential probiotic properties[J].FEMS microbiology letters,2012,332(1):27-33.
[10] 穆常青,潘 玮,陆庆光,等.枯草芽孢杆菌对稻瘟病的防治效果评价及机制初探[J].中国生物防治,2006,22(2):155-160.
[11] 李 晶,杨 谦.生防枯草芽孢杆菌的研究进展[J].安徽农业科学,2005,36(1):106-111,132.
[12] 郑 维,权春善,赵 晶,等.芽孢杆菌产环脂肽类化合物与生物合成机制研究进展[J].山东化工,2016,45(8):51-52,54.
[13] 熊汉琴,蔡燕飞,郭真真,等.芽孢杆菌脂肽类抗生素的研究进展[J].湖北农业科学,2015,54(12):2817-2821.
[14] 马 佳,李 颖,胡 栋,等.芽孢杆菌生物防治作用机理与应用研究进展[J].中国生物防治学报,2018,34(4):639-648.
[15] 李金芝.黄曲霉拮抗菌株的筛选、鉴定及其活性物质的初步研究[D].山东青島:青岛科技大学,2013.
[16] 章 挺,胡梁斌,王 飞,等.拮抗菌B-FS06的鉴定及其发酵产物对黄曲霉的抑制作用[J].中国生物防治,2007,23(2):160-165.
[17] 周启升,刘训理,张 楠,等.拮抗链霉菌S24发酵培养基的优化及其对黄曲霉的抑菌作用[J].生物工程学报,2011,27(2):203-211.
[18] MOYNE A L,SHELBY R,CLEVELAND T E,et al. Bacillomycin D:An iturin with antifungal activity against Aspergillus flavus[J].Journal of applied microbiology,2001,90(4):622-629.
[19] 程丽娟,薛泉宏.微生物学实验技术[M].第2版.北京:科学出版社,2002.
[20] 向亚萍,周华飞,刘永锋,等.解淀粉芽孢杆菌B1619脂肽类抗生素的分离鉴定及其对番茄枯萎病菌的抑制作用[J].中国农业科学,2016,49(15):2935-2944.
[21] 孙 珊,郝 林,王 倩.枯草芽孢杆菌W321产抑菌物质的理化性质及抑菌谱研究[J].食品工业,2012,33(11):110-112.
[22] 高学文,姚仕义,PHAM H,等.基因工程菌枯草芽孢杆菌GEB3产生的脂肽类抗生素及其生物活性研究[J].中国农业科学,2003, 36(12):1496-1501.
[23] WANG S L,YEN Y H,TZENG C G,et al. Produetion of antlfungal meterial by bioconversion of shellfish wastes fermentrd by Pseudomonas fluorescens K-188[J].Enzyme and microbial technology,2005(36):49-56.
[24] 程媛媛.华重楼内生菌脂肽类抗生素的分离纯化及其性质研究[D].成都:四川师范大学,2009.
[25] 张宝俊,张家榕,韩巨才,等.内生解淀粉芽孢杆菌LP-5抗菌蛋白的分离纯化及特性[J].植物保护学报,2010,37(2):143-147.
[26] 马俊美,宁亚维,王志新,等.侧孢短芽孢杆菌脂肽类抗生素的结构与性质[J].食品与生物科技学报,2016,35(6):629-634.
[27] 王宇婷,易有金,夏 菠,等.内生短短芽孢杆菌011菌发酵滤液抑菌活性研究[J].植物保护,2013,39(4):29-33,51.
[28] BLONDELLE S E,LOHNER K,AGUILAR M. Lipid-induced conformation and lipid-binding properties of cytolytic and antimicrobial peptides:Determination and biological specificity[J].Biochim Biophys Acta,1999,1462(1-2):89-108.
[29] HANCOCK R E,CHAPPLE D S. Peptide antibiotics[J].Antimicrob agents chemother,1999,43:1317-1323.
[30] 陈 萍,冯 芬,杨恬然,等.脂肽类抗生素及其作用机制[J].微生物学杂志,2015,35(5):89-93.

