白芷治疗痤疮的网络药理学作用机制
陈湘君, 刘靖
(1.广州中医药大学第一临床医学院,广东广州 510405;2.广州中医药大学第一附属医院,广东广州 510405)
痤疮,又称青春痘,是由多种因素引起的一种皮脂腺慢性炎症性疾病,好发于脸面部、胸部、背部等皮脂腺丰富的部位,表现为丘疹、脓疱、结节等多种皮损形式[1]。据统计,其在青少年的发病率高达80%,人群发病率约为9.4%。痤疮病程较长,是一种损容性皮肤病,不仅给患者带来经济负担,还带给患者精神上的压力[2,3]。现代医学治疗痤疮主要是运用抗感染、抑制油脂分泌、调节内分泌等手段。近年来,越来越多的临床数据显示,在西医治疗的基础上,配合中医药的辨证论治,往往能取得更好的治疗效果[4,5]。
白芷为伞形科植物白芷的干燥根茎,性温,味辛、微苦,具有祛风解表、消痈散结、排脓生肌的功效。临床上白芷及其制剂常被广泛应用于痤疮的治疗。药理研究[6-9]表明,白芷提取物具有一定的镇痛、抗炎、抑制皮脂腺分泌的作用。白芷对大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌等细菌均有不同程度的抑制作用。
对于白芷治疗痤疮疗效的研究目前主要通过临床试验或动物实验进行,其所含的活性成分及具体作用机制尚未被阐明。本研究以网络药理学为基础,筛选出白芷的活性成分,寻找其作用靶标及涉及的信号通路,最终建立起“成分——靶标——通路——疾病”网络,以探究白芷治疗痤疮的具体作用机制,现将研究结果报道如下。
1 资料与方法
1.1药物活性成分的获取利用中药系统药理学数据库与分析平台(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php),以“白芷”为关键词检索,获得白芷所含有的所有化学成分的信息。由于中药所含化学成分众多,故设置限定条件为“利用度(OB)值≥30%,且类药性(DL)值≥0.18”,将筛选后得到的化学成分作为白芷的活性成分。
1.2活性成分作用靶标的获取用Chembiodraw Ultra 12.0软件绘制白芷活性成分的3D结构图,保存为mol2格式。将所有mol2文件上传至反向分子对接服务器(DRAR-CPI)(https://omictools.com/drar-cpi-tool),为所有活性成分与靶标蛋白相互作用的亲和度打分,选取Z-score<-0.5的蛋白作为白芷活性成分的预测靶标。在Uniport数据库(https://www.uniprot.org/)中搜索白芷活性成分预测靶标的PDB ID,限定物种为“human”,收集预测靶标相对应的基因及UniProtKB。
1.3痤疮相关靶标基因的获取以“acne”或“acne vulgaris”或“common acne”作为关键词,分别在GeneCards数据库(https://www.genecards.org/)和在线人类孟德尔遗传(OMIM)数据库(http://www.omim.org/)中检索与痤疮相关的靶标基因。将检索得到的靶标基因和白芷活性分子的预测靶标基因进行对比,筛选出两者之间的共同靶标基因,作为白芷治疗痤疮的潜在作用靶标。
1.4成分——靶标网络构建与分析将白芷的活性成分与其治疗痤疮的潜在作用靶标关系导入Cytoscape 3.6.0软件,构建出成分——靶标网络。
1.5潜在作用靶标相互作用网络构建与分析将白芷治疗痤疮的潜在作用靶标导入String数据库(https://string-db.org/),限定物种为“human”,获得预测靶标的相互作用关系,保存为TSV格式。将靶标之间的相互作用关系导入Cytoscape 3.6.0软件中,绘制“核心靶标相互作用网络”,通过软件中的Network Analyzer工具进行网络分析,并根据Degree值(连接度)的大小调节节点的大小和颜色,获取最终的蛋白核心靶标相互作用网络。
1.6分子对接分子对接是通过电脑模拟受体与配体结合的过程,计算出一系列物理化学参数,以预测两者的结合亲和性的一种。筛选出蛋白相互作用网络中Degree值最高的5个靶标,将其导入System Dock Web Site(http://systemsdock.unit.oist.jp/iddp/home/index)服务器中与白芷活性成分进行分子对接,对结果的Docking评分进行分析,评估白芷活性成分与核心靶标之间的结合潜力。
1.7生物学过程与通路分析将白芷的作用靶标导入DAVID数据库(https://david.ncifcrf.gov/),进行基因本体论(GO)分类富集分析与京都基因和基因组百科全书(KEGG)通路富集分析。选取P<0.001的通路,并根据富集在通路上的基因数目,由大到小进行排序,选取排名前20的通路,使用OmicShare网站(http://www.omicshare.com/tools/)绘制气泡图。
1.8成分——靶标——通路网络构建通过对筛选得到的20条通路的KEGG通路富集分析,结合文献检索的结果,筛选出可能与治疗痤疮相关的通路,找出富集在这些通路上白芷治疗痤疮的靶点,并与相应药物的活性成分相匹配,构建“成分——靶标——通路”网络关系图。
2 结果
2.1白芷活性成分与相应靶标共收集到白芷化学成分223个。以口服OB≥30%、DL≥0.18作为限定条件,筛选出活性成分20个,见表1。将活性成分的3D结构图上传至DRAR-CPI服务器,获得Z-score<-0.5的靶标共有61个。
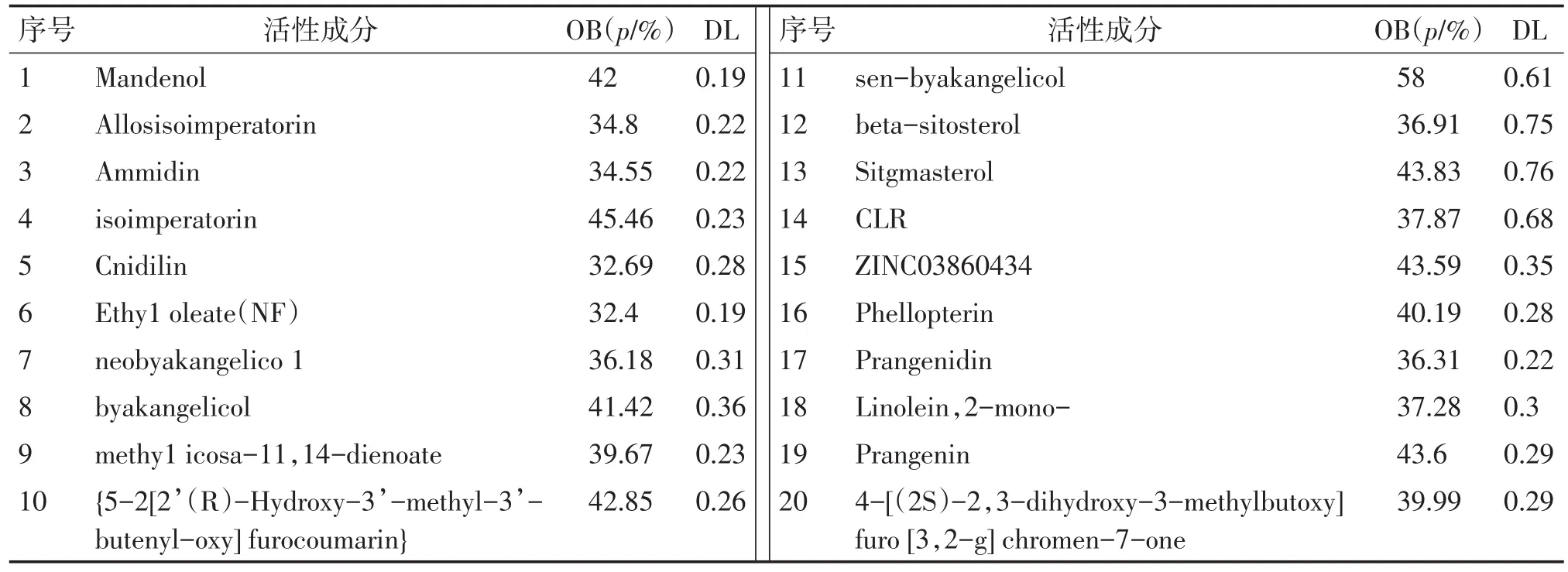
表1 白芷活性成分表Table 1 Active components in Radix Angelicae Dahuricae
2.2靶标预测将61个靶标输入UniProt数据库,获得61个靶标的相应基因及其UniProtKB。从GeneCards数据库和OMIM数据库中搜索得到与痤疮相关基因共924个。将白芷的靶标基因与痤疮相关基因进行对比,筛选出可能与白芷治疗痤疮相关的作用靶标55个,见表2。
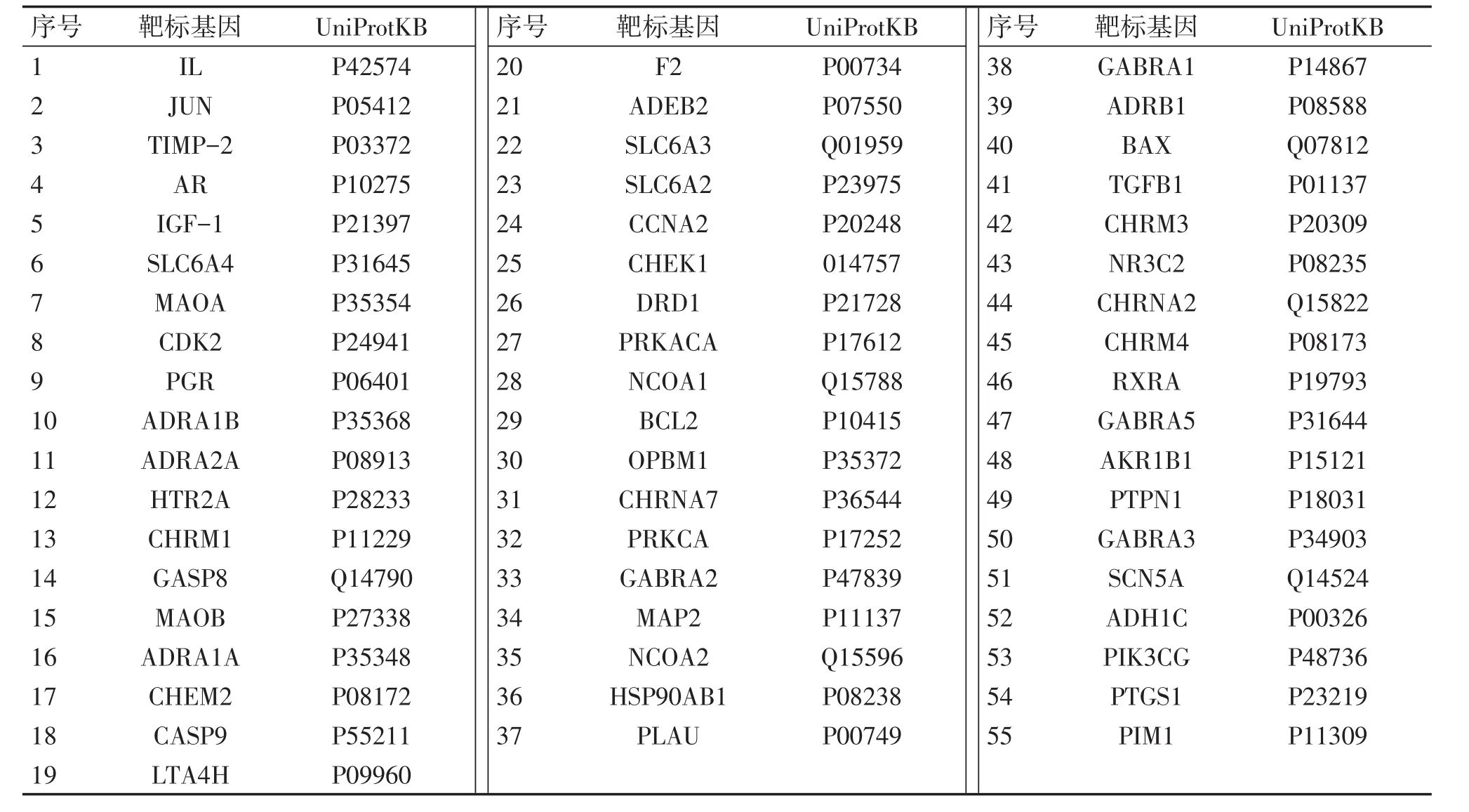
表2 白芷治疗痤疮潜在作用靶标信息表Table 2 The information of potential candidate targets of Radix Angelicae Dahuricae UniProtKB
2.3成分——靶标网络构建在Cytoscape软件中导入白芷的活性成分与作用靶标,构建成分——靶标网络,见图1。此网络共包括节点75个,边156条。不同的节点有不同的意义,其中蓝色六边形节点代表活性成分,绿色圆形节点代表作用靶标,而边则代表成分与靶标的关系。由图1可知,不同的靶标可对应相同的活性成分,同一靶标也可与不同的活性成分相对应,可见白芷治疗痤疮具有多成分、多靶标的特点。
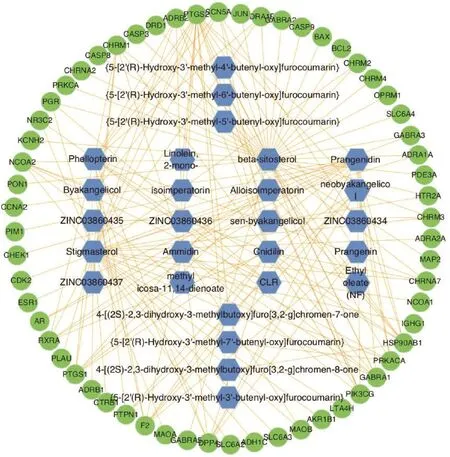
图1 白芷成分——靶标网络Figure 1 The component-target network of Radix Angelicae Dahuricae
2.4核心靶标相互作用网络构建将可能与白芷治疗痤疮相关的55个靶标导入String数据库中,获取其相互作用关系,并导入Cytoscape 3.6.0软件中,绘制其相互作用网络,见图2。此网络共包括节点55个,边239条。Degree值越大则图中节点越大、颜色越深。结果提示白芷治疗痤疮相关的潜在靶标中Degree值最高的5个靶点为包括白细胞介素(IL)、JUN、金属蛋白酶组织抑制因子2(TIMP-2)、血清胰岛素样生长因子1(IGF-1)、雄激素受体(AR)。
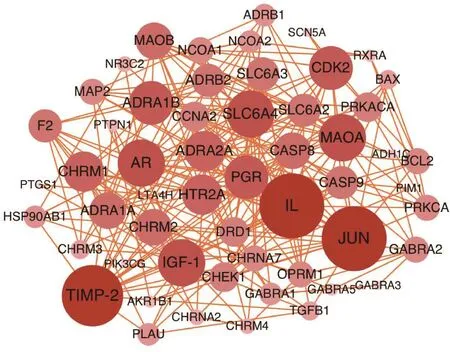
图2 白芷治疗痤疮潜在靶标相互作用网络Figure 2 The interaction network of candidate targets of Radix Angelicae Dahuricae
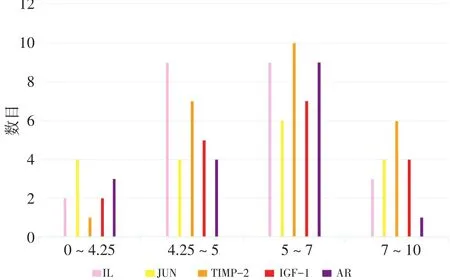
图3 分子对接图Figure 3 The diagram of molecular docking
2.5分子对接选取Degree值最大的5个靶标,将其分别输入Systems Dock Web Site软件中,进行分子对接验证,并与白芷的20个活性成分进行对接,见图2。结果显示:有18个(18%)的Docking Score值>7.0(结合能力很高),有41个(41%)的Docking Score值在7.0~5.0之间(结合能力较高),有29个(29%)的Docking Score值在5.0~4.25之间(有一定的结合能力),有12个(12%)的Docking Score值<4.25。由此可见,白芷的活性成分和关键靶标的结合能力较好。
2.6 GO和KEGG通路富集分析利用DAVID数据库对白芷治疗痤疮的潜在靶标进行GO分类富集和KEGG通路富集分析。筛选P<0.001的通路与生物过程,其中富集靶标越多、P值越小的通路,与白芷治疗痤疮的关系越为密切。GO分类富集分析包括细胞组分(cellular component,CC)、生物过程(biological process,BP)、分子功能(molecular function,MF)3个部分。其中富集比例较高、P值较小的在CC分析中为浆膜(plasma membrane)、细胞 核(nucleus)、 细 胞 质(cytoplasm)、 胞 液(cytosol)、浆膜成分(integral component of plasma membrane)等,见图4。BP分析中为信号转导(signal transduction)、药物应答(response to drug)、细胞增殖正调控(positive regulation of cell proliferation)、雌二醇应答(response to estradiol)、脂多糖应答(response to lipopolysaccharide)等,见图5。MF分析中为蛋白绑定(protein binding)、酶绑定(enzyme binding)、蛋白同源二聚化活性(protein homodimerization activity)、蛋白异源二聚化活性(protein heterodimerization activity)、药物绑定(drug binding)等,见图6。KEGG通路富集分析发现白芷治疗痤疮的靶标主要与磷脂酰肌醇-3-激酶(PI3K)/丝苏氨酸蛋白激酶Akt、核因子kappaB(NF-κB)、人类T淋巴细胞白血病病毒Ⅰ型(HTLV-1)感染、Nrf2、丝裂原活化蛋白激酶(MAPK)等通路关系较为密切,见图7。
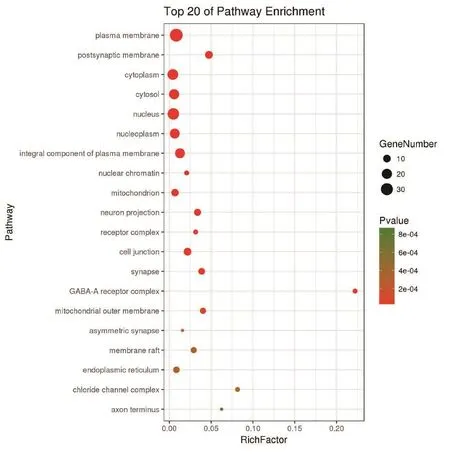
图4 白芷治疗痤疮的潜在靶标的CC分析Figure 4 GO pathway enrichment analysis for cellular component of candidate targets from active components of Radix Angelicae Dahuricae for acne
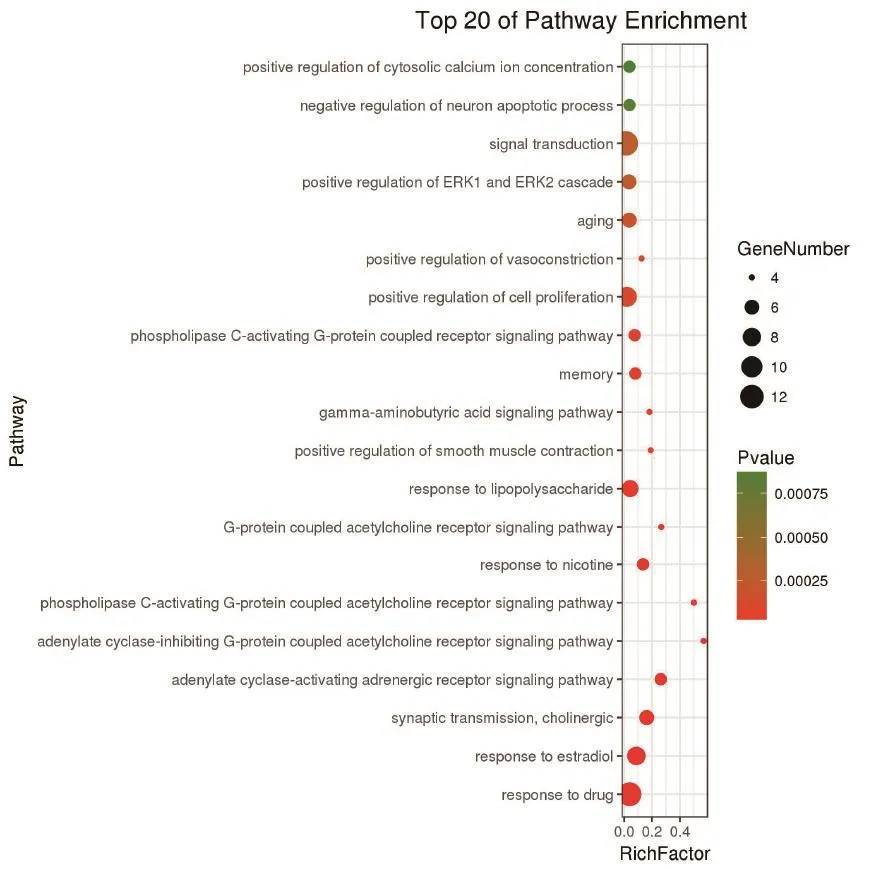
图5 白芷治疗痤疮的潜在靶标的BP分析Figure 5 GO pathway enrichment analysis for biological processes of candidate targets from active components of Radix Angelicae Dahuricae for acne
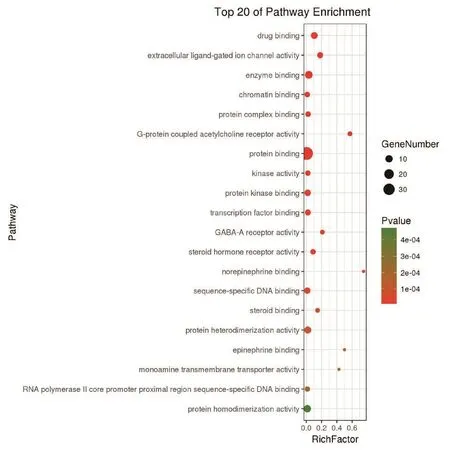
图6 白芷治疗痤疮的潜在靶标的MF分析Figure 6 GO pathway enrichment analysis for molecular function of candidatetargets from active components of Radix Angelicae Dahuricae for acne
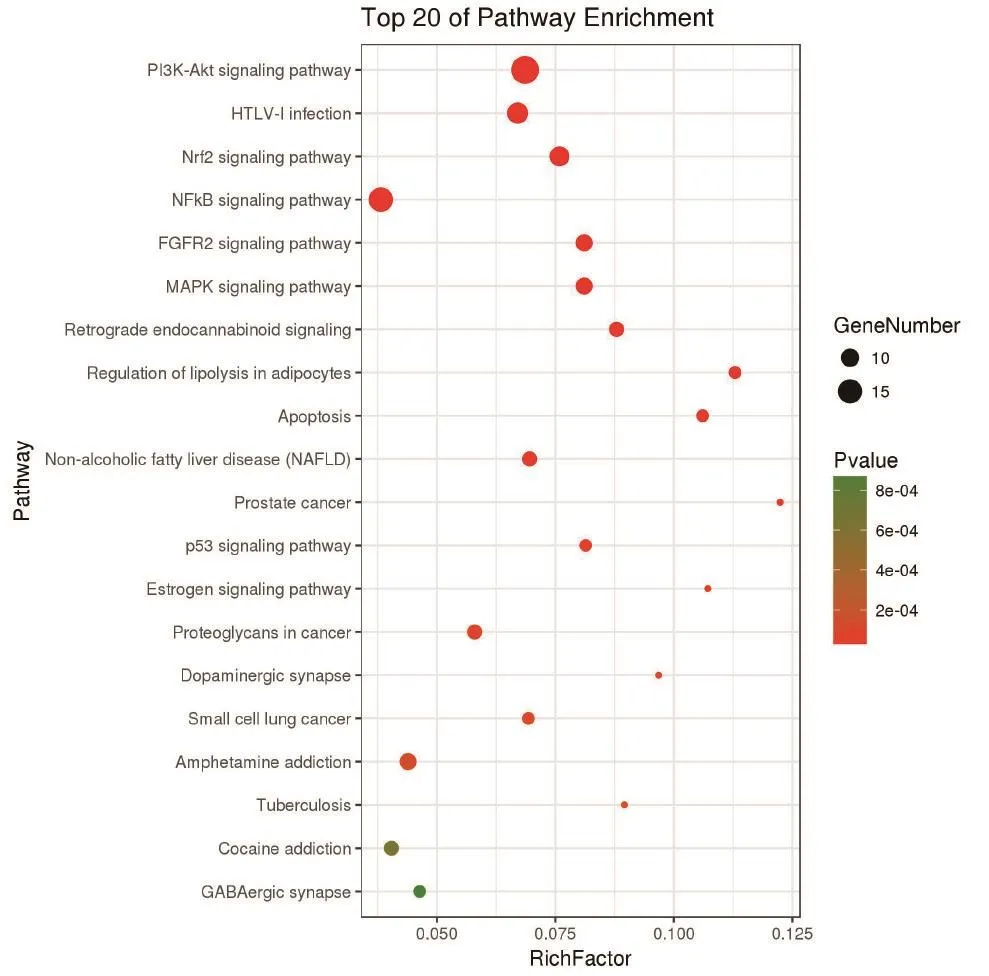
图7 白芷治疗痤疮的潜在靶标的KEGG通路富集分析Figure 7 KEGG pathway enrichment analysis of candidate targets from active components of Radix Angelicae Dahuricae for acne
2.7成分——靶标——通路网络构建通过检索与阅读文献,在排名前20的KEGG通路中筛选出可能与治疗痤疮相关的通路,并将其与白芷的活性成分、作用靶标三者结合,构建成分——靶标——通路网络图,见图8。其中蓝色三角形节点代表与白芷治疗痤疮相关的活性成分,绿色圆形节点代表潜在靶标,紫色六边形节点代表与痤疮相关通路。分析成分——靶标——通路网络图可知,白芷治疗痤疮涉及的活性成分共10个,包括别欧前胡素(Prangenidin)、别异欧前胡素(Alloisoimperatorin)、异珊瑚菜素(Cnidilin)、欧前胡素(Ammidin)、β-谷甾醇(beta-sitosterol)、新比克白芷内酯(neobyakangelicol)、白当归脑(Byakangelicol)、珊瑚菜内酯(Phellopterin)、C型凝集素受体(CLR)、豆甾醇(Stigmasterol)等。上述活性成分主要作用于IL、JUN、TIMP-2、IGF-1、AR等靶标,涉及PI3K/Akt、NF-κB、MAPK、成纤维细胞生长因子受体2(FGFR2)信号通路。
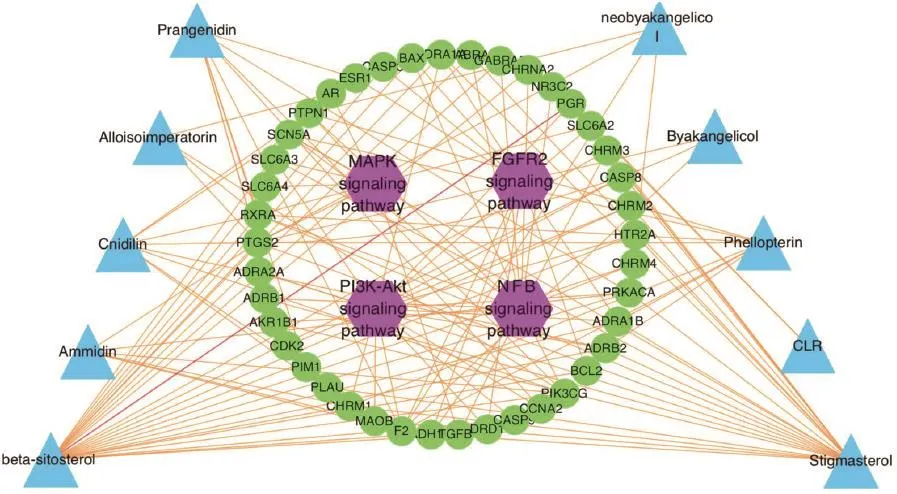
图8 “成分——靶标——通路”网络关系图Figure 8“Compound-target-pathway”network
3 讨论
白芷,性辛、温,趋向升浮,具有解表散寒、祛风止痛、宣通鼻窍、消肿排脓的功效,《本草汇言》云:“上行头目,下抵肠胃,中达肢体,遍通肌肤以至毛窍,向利泄邪气。”现代药理研究表明,白芷复方、中成药确有消肿排脓、美白延缓皮肤衰老和软化角质层的作用,但目前对于其治疗痤疮的具体作用机制尚不明确。因此,基于网络药理学的原理和方法,探究白芷治疗痤疮的作用机制,为其痤疮治疗的临床应用提供证据支持,对其在临床上进一步推广使用具有重大意义,并且可为更高层次的研究奠定基础。
本次研究所获得的白芷治疗痤疮的主要活性成分包括欧前胡素、β-谷甾醇、异欧前胡素、珊瑚菜内酯、豆甾醇等。白芷的主要有效成分之一即为香豆素类,截止目前共从白芷中分离得到55种香豆素类化合物。本次获得的有效成分大多属于香豆素类,如欧前胡素、别欧前胡素、白当归脑、异珊瑚菜素等。
相关研究[10]表明,欧前胡素对细菌具有较强的抑制作用,并且随着浓度的增大,抑菌效果更明显,可起到抗感染的治疗目的。异欧前胡素可以促进溶菌酶的生成,激活单核细胞,增加巨噬细胞的吞噬功能及抗原呈递功能,达到消炎抗感染的效果[11]。Choi等[12]发现β-谷甾醇是通过减少一氧化氮(NO)的合成,抑制巨噬细胞白细胞介素(IL)-6活性,减少IL-1、肿瘤坏死因子α(TNF-α)等炎性因子的分泌发挥抗炎作用。研究[13]表明,β-谷甾醇具有抗氧化、抗炎、降低胆固醇、抗肿瘤等功效。C型凝集素受体(CLR)在调节抗真菌寄生虫感染、过敏反应和肿瘤免疫中扮演重要角色[14]。β-豆甾醇能显著降低炎症因子IL-1β、IL-6、单核细胞超化蛋白1(MCP-1)和相关环氧合酶2(COX-2)[15]。白当归脑作为治疗呼吸道炎症药物的应用前景广阔,白当归脑可以剂量相关地抑制IL-1β诱导人肺上皮A549细胞中的前列腺素E2(PGE2)的释放[16]。珊瑚菜内酯能对脂肪分解具有促进作用并对脂肪合成具有抑制效果,还参与抗脂质过氧化、清除氧自由基、抗细胞凋亡等反应[17]。别欧前胡素、新比克白芷内酯、异珊瑚菜素等相关报道资料稀少,在此不作赘述。
本研究中的“成分——靶标”网络、靶标相互作用网络体现了白芷治疗痤疮具有多靶点、多途径的特点,作用机制复杂多样。分子对接试验结果提示白芷活性成分和治疗痤疮相关的核心靶标之间结合能力良好,提示本实验的数据与结果较为可靠,具有较高的参考价值。
同时本研究发现,白芷最可能是通过IL、JUN、TIMP-2、IGF-1、AR这5个靶标来发挥其治疗痤疮的作用。IL主要由单核巨噬细胞产生,介导免疫反应,可能参与了痤疮炎症级联反应的启动过程,刺激血管内皮细胞表达白细胞黏附分子,诱导内皮细胞通过自分泌或旁分泌方式产生IL-8、单核趋化因子1,还可刺激中性粒细胞释放炎症递质,加重炎症反应[18]。JUN蛋白是转录激活蛋白1的组成成分,同时也是激活转录激活蛋白1(AP-1)的必需物质。AP-1能够调节基质金属蛋白酶(MMP)类表达,包括MMP1、MMP3。JUN蛋白水平的上升能激活更多的AP-1,提高金属蛋白酶的活性,促进皮肤胶原蛋白降解,增加皮肤皱纹的形成,促进皮肤光老化,增加皮肤损害[19,20]。Guillemin等[21]使用敷料GBT013作用于糖尿病小鼠慢性创面模型,发现其能促进糖尿病创面的愈合,与抑制体外MMP-2酶活性,防止生长因子降解,促进细胞增殖有关。有研究[22]结果显示,IGF-1可促进皮脂腺细胞皮脂分泌增多,同时皮脂分泌增多的皮脂腺细胞Sox9的表达也明显增多,说明在皮脂腺细胞中IGF-1可以上调Sox9的表达引起痤疮。AR普遍存在于正常人的毛囊和皮脂腺中。已有研究发现,痤疮的发生与毛囊皮脂腺单位AR水平或AR对正常血清水平的雄激素的敏感性呈正相关[23]。AR可能是通过增加皮脂腺的皮脂分泌,导致痤疮的发生[24],也可能是干扰IGF-1的活性,诱导皮脂腺细胞参与脂质的合成[25]。
本研究结果表明,白芷治疗痤疮主要涉及PI3K/Akt、NF-κB、MAPK、FGFR2 信号通路。PI3K/Akt通路在皮肤愈合中扮演重要的角色,促进痤疮溃破后愈合。通过PI3K/Akt通路可以调节细胞凋亡来维持参与皮肤损伤愈合过程的细胞数量的稳定[26]。研究[27]发现,抑制PI3K/Akt信号通路的表达可以抑制促炎因子的释放来抑制炎症的发生,减少痤疮溃破后并发感染。有研究表明FGFR2通路可能参与痤疮的发病过程,FGFR2通路参与皮肤附属物的形成,调控毛囊皮脂腺稳态,在皮脂腺的生成和增殖中起重要作用。过度刺激FGFR2信号并增加IL-1α的表达可以解释Apert综合征和Comedonicus痤疮的发生。雄激素介导的FGFR2信号上调可能是痤疮发病的起始信号[28]。通过MAPK信号通路激活p38 MAPK,从而促进巨噬单核细胞产生IL-1α、IL-6等因子,在炎症反应中作用重大,其中IL-1α能够促进毛囊皮脂腺的角化,加重发病[29]。IL-6对炎症反应和免疫应答发挥重要影响,可诱导痤疮发生炎症反应[30]。NF-κB为经典炎症通路,通过NF-κB通路可以激活多种炎症反应的发生和促进单核巨噬细胞生成多种炎症因子。抑制NF-κB通路的激活可以抑制炎症反应的发生,减轻症状,减少患者痛苦[31]。
本研究结果针对白芷治疗痤疮过程中的抗炎作用进行了进一步的机制探讨,表明其治疗过程涉及了多个活性成分、作用靶标及信号通路,其作用机制复杂多样,并非仅通过单个成分、作用单个靶标或调控单条通路发挥作用,与中药治疗疾病的多靶点特点相吻合。分子对接结果亦验证了本研究结果的可靠性,网络分析所得的结果也与现有研究结果相符。但本研究结果只是一种理论上的分子机制预测探讨,仍需通过进一步实验来验证药物作用的具体机制及临床实践以发掘更多的应用价值。

