腹腔镜经腹经肛低位直肠癌全系膜切除术临床探讨
钟晓华 谢海滨 彭博 胡琛 陈超
直肠癌属于消化道常见的一种恶性肿瘤。近几年,对直肠癌的诊断与治疗已成为临床医学一项重要的研究课题[1]。随着近几年腹腔镜技术的发展,腹腔镜治疗在直肠癌手术中的应用更加广泛。相较之下,腹腔镜经腹经肛门全系膜切除术比腹腔镜直肠全系膜切除术,更能最大限度的保留患者肛门功能,降低局部复发率[2]。对此,回顾性收集我院2018 年1 月—2018 年12 月收治的22 例中低位直肠癌患者的临床资料,分别采取腹腔镜经腹经肛门全系膜切除术与腹腔镜全系膜切除术,对比两组患者的近期治疗效果,现将结果汇报如下。
1 资料与方法
1.1 一般资料
回顾性收集我院于2018 年1 月—2018 年12 月收治的22 例低位直肠癌患者,他们均给予腹腔镜经腹经肛门全系膜切除术,作为观察组;同时随机抽取11 例同时期同组手术医生行腹腔镜直肠癌全系膜切除术的低位直肠癌患者的临床资料,作为对照组。观察组有男7 例,女4 例,年龄39~76 岁,平均年龄(49.17±3.96)岁,平均体质量指数为(15.73±4.28)kg/cm2;对照组有男5 例,女6 例,年龄42~79 岁,平均年龄(48.95±4.16)岁,平均体质量指数为(15.51±4.10)kg/cm2。两组患者的基线资料(年龄、性别、体质量指数)差异没有统计学意义(P>0.05),具有可比性。
1.1.1 纳入标准(1)选取患者均符合临床对直肠癌的诊断标准,肠镜报告提示肿瘤下缘距肛门5 cm 以内,且经常规影像学检查均未显示远处转移[3];(2)患者ASA 分级1~3;(3)此次研究已经伦理委员会批准,两组患者均签署研究知情同意书。
1.1.2 排除标准(1)合并肝转移者;(2)中转开腹手术者;(3)行Mile`s 术式者;(4)术后出现非手术并发症,如肺部感染、心衰、脑血管意外、深静脉血栓者。
1.2 方法
1.2.1 对照组 该组患者采取腹腔镜低位直肠癌全系膜切除治疗术,具体方法如下:该组患者采取腹腔镜直肠系膜切除治疗术。取患者膀胱截石位,行头低脚高姿势,术前建立人工气腹,气腹压力参数13 mmHg,实施5 孔法。行保肛手术,于肿瘤下缘2 cm 将肠管横断,于中下腹出作一5 cm 切口,取出肠段,在肿瘤上方约10 cm 处切断乙状结肠,随即将标本取出。之后可重新建立气腹,采取降结肠直肠吻合术,取出吻合器时需观察切割全是否完整。
1.2.2 观察组 该组患者实施腹腔镜经腹经肛低位直肠癌全系膜切除术,经腹组游离乙状结肠及清扫肠系膜下动脉淋巴结同对照组,游离至腹膜返折水平,经肛组操作方法:会阴区消毒,碘伏溶液冲洗肠腔,经过充分扩肛后置入经肛手术操作平台和手术器械,距肿瘤下缘1~2 cm 处双重荷包缝合,关闭肠腔以隔离肿瘤并建立直肠腔内的操作空间,在荷包缝合的远端环形切开直肠壁全层,进入盆底,循盆筋膜脏层与壁层间的间隙自下向上游离直肠系膜,直到与腹部操作平面会合,完成全直肠系膜的切除。经肛拖出直肠癌TM 手术标本,离断近端的乙状结肠,移除标本,若使用圆形吻合器或手工缝合完成消化道重建。
1.3 观察指标
对比两组患者各项临床指标,包括、平均 手术时间、清扫淋巴结数目、术后并发症发生率、术 中出血及平 均住院时间。详细记录两组患者术后并发症的发生情 况,包括切 口感染、吻合口漏,吻合口出血,腹腔感染。
1.4 统计学方法
文中数据处理采用SPSS 20.0 系统软件,百分率(%)表示计数资料,检验行卡方(χ2)检验;()表示计量资料,进行t检验。用P<0.05 表明差有统计学意义。
2 结果
2.1 各项临床指标对比
两组患者的平均手术时间差异有统计学意义(P<0.05);两组患者的清扫淋巴结数目、术后并发症发生率、术中出血及平均住院时间差异均无统计学意义(P>0.05),详见表1。
2.2 并发症发生率与远端切缘率对比
两组观察手术相关并发症,如吻合口漏、吻合口出血、腹腔感染、切口感染;术后观察组并发症发生率为20.0%,对照组则为18.2%;差异无统计学意义(P>0.05),详见表2。观察组远端切缘率为23.3%(14/60),明显低于对照组的47.3(26/55),差异有统计学意义(P<0.05)。
3 讨论
直肠癌为临床常见的一种恶性消化道肿瘤,该病在近几年呈现年轻化的趋势。据有关研究指出,该病的患者年纪大多在45 岁左右,临床对该病的发病原因仍未有明确的定论,但多数学者认为,该病的出现与患者的饮食习惯有密切关联,特别对于部分饮食中摄入极少植物纤维的患者患病率会有所提高[4]。直肠癌病灶发现时多处于中期,诊断虽较为容易,但治疗却比较棘手。直肠癌早期与中期主要进行根治手术,晚期则多半采取姑息治疗[5]。治疗过程中由于患者肿瘤处于盆腔深处,解剖结构复杂,因此在手术过程中很难完整切除肿瘤组织,这是导致直肠癌复发几率高的主要原因[6]。但随着近几年医学技术与医疗器械的发展,特别是在腹腔镜技术及经肛门全直肠系膜切除术出现后,直肠癌根治术的治疗较前有了明显的提高。
在临床胃肠外科中,腹腔镜手术是其常用的手术治疗方式,该项技术具有切口小、出血量少等诸多优势,亦可有效切除患者的病变组织及清除淋巴结,既避免了传统开腹手术切口大,出血量多等劣势,也可获得与开腹手术治疗相当的效果[7]。但由于中低位直肠癌切除术中,存在盆底视野小与操作空间狭窄等缺陷,而经肛门全直肠系膜切除术则可弥补上述缺陷[8]。若在术中结合患者的实际情况将经腹及经肛路径结合起来运用,优于较单一路径手术的治疗效果[9]。腹腔镜辅助的经肛门直肠癌全直肠系膜切除术不仅具有经肛、经腹的手术优势,还具有良好的操作空间与视野,有助于顺利展开中低位直肠癌的淋巴结清扫与游离肠系膜等操作,在确保手术效果的同时,不增加患者术后并发症的发生率[10]。
本文通过研究结果表明,观察组采取腹腔镜辅助经肛门全直肠系膜切除治疗术,患者的平均手术时间为(110.67±12.83)min,差异均有统计学意义(P<0.05);表明,腹腔镜辅助经肛门全直肠系膜切除术治疗可显著缩短患者手术时间,促进患者预后康复。这与朱雯洁[11]研究结果具有一致性。两组患者的清扫淋巴结数目、术后并发症发生率、术中出血及平均住院时间差异均无统计学意义。提示,腹腔镜辅助经肛门全直肠系膜切除术治疗具有较高的安全性,不增加患者术后并发症风险[12]。
表1 两组患者各项临床指标对比()
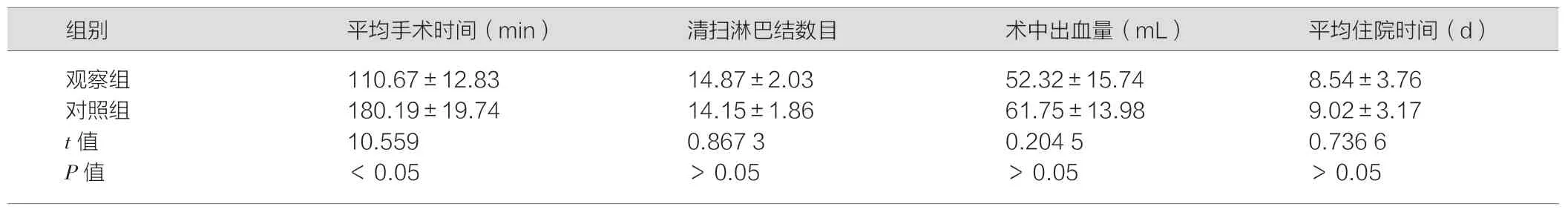
表1 两组患者各项临床指标对比()
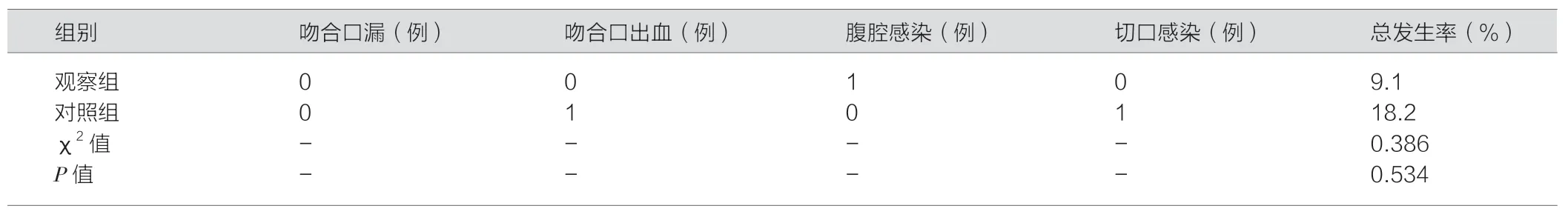
表2 两组患者并发症发生率
综上所述,采取腹腔镜辅助的经肛门直肠癌全直肠系膜切除术,可确保低位直肠癌患者远端阴性切缘,加快手术进度,不增强手术相关并发症,是TME 的一种新手术入路术式。

