金刚烷胺残留化学发光酶免疫法的建立
崔廷婷,冯才伟,吴小胜,王兆芹,焦 强,李 静,张 颖,万宇平,*
(1.北京勤邦生物技术有限公司,北京 102206;2.北京市食品安全免疫快速检测工程技术研究中心,北京 102206;3.河南省口岸食品检验检测所,河南郑州 450003)
金刚烷胺(Amantadine,AMD)为饱和三环癸烷的氨基衍生物,是一类抗病毒药物[1],也能有效缓解帕金森病患者的症状[2]。但近年来由于流感病毒的大范围流行,很多养殖场开始在畜禽饲养过程中非法使用AMD[3],将人用抗病毒药物移植兽用,这不仅容易导致动物中毒和动物性食品中药物残留,还可导致病毒发生变异,使机体产生免疫抑制和耐药性[4-5],而且还具有神经毒性等一系列的副作用[6]。因此,我国农业部2005年第560号公告明确规定,金刚烷胺和金刚乙胺等抗病毒药物在兽医上禁止使用[7]。
目前,检测金刚烷胺主要采用气相色谱法[8]、液相色谱-质谱联用技术[1,3,9]等仪器方法,以及胶体金免疫层析法[6,10]、酶联免疫吸附法(ELISA)[6,11]等免疫分析方法。其中,仪器分析具有较高的灵敏度和准确度,但前处理复杂,检测成本高,无法满足对大量样本进行快速筛查的需求;免疫方法操作简单,速度快,成本低,在兽药残留分析中具有十分广阔的前景。而化学发光酶免疫分析方法(chemiluminescence enzyme immunoassay,CLEIA)是基于高灵敏性的化学发光反应和高特异性的免疫反应而建立的一种测定方法[12],与ELISA相比,灵敏度更高[13],已广泛应用于生物医药科学和临床化学等方面[14-15],未来将成为兽药残留检测发展的一种趋势。本研究基于抗原抗体特异性反应及磁性微球分离技术,建立金刚烷胺残留的化学发光酶免疫分析方法,以实现动物组织、兽药、饲料中金刚烷胺残留的大规模快速检测。
1 材料与方法
1.1 材料与仪器
金刚烷胺半抗原、金刚烷胺单克隆抗体 北京勤邦生物技术有限公司自制,合成方法见文献[16];金刚烷胺标准品(纯度>99%)、2-(N-吗啉代)乙磺酸(MES)、N,N-二甲基甲酰胺(DMF)、碳化二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)、三羟甲基氨基甲烷(TRIS)、牛血清白蛋白(BSA) SIGMA公司;辣根过氧化物酶(HRP) 全式金生物技术有限公司;表面-COOH基团的磁珠 DYNAL公司;Tween-20、NaN3、乙腈 北京化学试剂公司;鲁米诺 阿法埃莎化学有限公司;猪肉、清瘟败毒散、饲料原料、配合料、浓缩料样本 市售;磷酸盐缓冲液(PBS) 0.01 mol/L,pH7.4;磷酸盐吐温缓冲液(PBST) 含0.05% Tween-20的PBS溶液;MES溶液 25 mmol/L 2-(N-吗啉代)乙磺酸缓冲液,pH5.0;MES-吐温溶液(MEST) 含0.05% Tween-20的MES溶液;TRIS溶液 0.01 mol/L TRIS-HCl缓冲液,pH7.4;复溶液 0.02 mol/L PB溶液;底物A液(鲁米诺+对羟基联苯)和B液(过氧化氢) 北京勤邦生物技术有限公司自制。
Opti-plateTM化学发光板 Perkin Elmer公司;DT5-2B离心机 北京时代北利离心机有限公司;YP1000分析天平 上海佑科仪器仪表有限公司;QL-901涡动混合器 其林贝尔仪器制造有限公司;CO2恒温培养箱 Thermo公司;可调微量加样器系列 Eppendort公司;全自动化学发光免疫分析仪 北京勤邦生物技术有限公司。
1.2 实验原理
本方法检测AMD的原理如图1所示,以磁珠为固相载体偶联AMD单克隆抗体形成AMD磁标抗体,然后加入待测样品和HRP标记的AMD抗原,待测样品中的AMD和HRP标记的AMD抗原竞争结合AMD磁标抗体,磁分离后加入化学发光底物A液和B液,HRP催化发光底物液产生化学发光,发光强度与待测样品中AMD含量成反比。
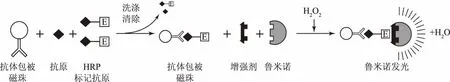
图1 基于磁纳米颗粒的化学发光酶免疫分析的反应过程图Fig.1 The reaction process of CLEIA based on magnetic nanoparticles
1.3 实验方法
1.3.1 金刚烷胺酶标抗原的制备 将金刚烷胺半抗原与HRP进行偶联,其具体操作过程:称取半抗原15 mg溶解于1 mL DMF中,得到半抗原稀释液;称取EDC和NHS各30 mg溶解于0.2 mL水中,然后将其加入半抗原稀释液中,室温环境下磁力搅拌2 h,得到活化半抗原稀释液;称取HRP 50 mg,使其充分溶解在3.8 mL 0.01 mol/L PBS溶液中,将活化半抗原稀释液逐滴缓慢滴加到HRP溶液中,室温环境下磁力搅拌反应24 h,用0.01 mol/L PBS溶液透析,截留分子质量8000~14000 Da,4 ℃透析3 d,每天换3次透析液,制备完成后分装保存于-20 ℃。偶联过程中,采用棕色瓶避光,酶标记物质保存采用棕色管避光保存。
1.3.2 金刚烷胺磁标抗体的制备 活化:取100 μL磁珠,用100 μL MEST溶液洗涤两次,磁分离后移除上清;使用前,用4 ℃贮存的MES溶液分别配制50 mmol/L的EDC、NHS溶液;分别取50 μL新配制的EDC和NHS溶液到装有磁珠的离心管中,涡旋混匀,室温振荡活化30 min;离心管置于磁分离架上磁分离4 min,移除上清,加入100 μL MES溶液,清洗2~3次后即可得表面羧基活化的磁珠。
偶联:将金刚烷胺单克隆抗体溶解到60 μL MES溶液中,并调节总体积至100 μL,轻柔混匀磁珠与抗体;室温条件下偶联30 min,该期间可利用涡旋仪使磁珠保持混匀状态;离心管置于磁分离架上磁分离3~5 min,移除上清。
封闭:加入100 μL TRIS溶液反应15 min封闭磁珠;用100 μL含0.1% BSA及0.1% Tween-20的PBS溶液清洗封闭好的磁珠3~5次。
贮存:将磁珠复溶于含0.1% BSA,0.01% Tween-20,0.02% NaN3的PBS溶液中,2~8 ℃贮存。
1.3.3 金刚烷胺直接竞争CLEIA法操作步骤 向化学发光板中加入梯度稀释的金刚烷胺标准溶液,50 μL/孔,每个浓度做三个平行;每孔加入50 μL酶标抗原和50 μL磁标抗体,25 ℃温育20 min,温育结束后通过磁铁给予磁场以使其沉淀,去掉上清液,用PBST溶液清洗沉淀复合物,并吸干废液,除去未与磁性微粒结合的物质;将底物A液和B液按1∶1混合,摇匀后每孔加入100 μL,室温放置3.5 min,使复合物产生化学发光信号,用化学发光仪测定每孔化学发光强度(RLU值)。
1.3.4 直接竞争CLEIA法条件优化 酶标抗原与磁标抗体的最佳稀释倍数通过方阵法来确定。设置酶标抗原稀释倍数为5000、10000、15000、20000,磁标抗体稀释倍数为1000、2000、4000,竞争药物金刚烷胺的浓度为0.1 μg/L,按照1.3.3的步骤测定RLU值,同时做阴性对照(不加标准品),通过考察添加金刚烷胺标准品的RLU值与不添加金刚烷胺标准品的RLU值的比值(抑制率)确定最佳稀释倍数。
通过单因素实验确定反应时间和底物发光时间。分别设置4组不同的反应时间:10、20、30、60 min(底物发光时间为3.5 min);4组不同的底物发光时间:1、3.5、7、10 min(反应时间为20 min),按照1.3.3的步骤分别测定RLU值,竞争物金刚烷胺系列浓度梯度为0.1、0.3、0.9、2.7、8.1 μg/L。
1.3.5 建立标准曲线 根据上述实验确定的最佳反应条件,按照1.3.3的步骤在浓度梯度为0.1、0.3、0.9、2.7、8.1 μg/L的金刚烷胺溶液下进行操作,测定RLU值,计算相对发光强度(RLU/RLU0)。以标准品相对发光强度为纵坐标,金刚烷胺浓度的对数值(lgC)为横坐标,绘制标准曲线,得出线性方程,计算IC50(RLU/RLU0为50%时相对应的金刚烷胺质量浓度)和线性范围(IC20~IC80)[17]。
1.3.6 CLIEA方法的评价 为了评价CLIEA的可靠性,采用空白样本进行回收率实验,分别对检出限、准确度和精密度各指标进行验证。
1.3.6.1 样本前处理 称取(2.0±0.05) g粉碎的样品至50 mL聚苯乙烯离心管中,加入6 mL乙腈,振荡5 min;室温(20~25 ℃)3000 r/min离心5 min;移取1 mL上清液到玻璃离心管中,于50~60 ℃水浴氮气流下吹干;加入400 μL复溶液,涡动30 s,待检。
1.3.6.2 检测限 取20份空白样品按1.3.6.1的步骤进行前处理后,按1.3.3测定RLU值,通过标准曲线得到待测物浓度,以20份空白样品对应的浓度平均值加3倍标准差作为样本的最低检测限。
1.3.6.3 准确度和精密度 选取猪肉、清瘟败毒散、饲料原料、配合料、浓缩料空白样品进行添加回收测定,设定2个浓度,每个浓度4个平行,用三批不同试剂,统计添加回收率和相对标准偏差。
1.4 数据处理
2 结果与分析
2.1 最优条件的确定
2.1.1 酶标抗原与磁标抗体最佳稀释倍数的确定 酶标抗原稀释倍数为15000倍,磁标抗体稀释倍数为2000倍时,0.1 μg/L金刚烷胺标准品抑制率为73.7%(表1),在70%~85%[18],因此选择其为最佳的稀释倍数。

表1 方阵法确定最优的抗原、抗体工作浓度Table 1 Determination of antigen and antibody concentration by square matrix method
2.1.2 反应时间的确定 由图2中四条曲线的线性方程算出各自的IC50值,进而计算出各自的RLUmax/IC50值,结果如图3。伴随着反应时间的延长,RLUmax/IC50先增大后减小,在反应时间为20 min时,RLUmax/IC50达到最大;而IC50逐步递增。依据RLUmax/IC50大且IC50值尽量低的原则[19],反应时间确定为20 min。
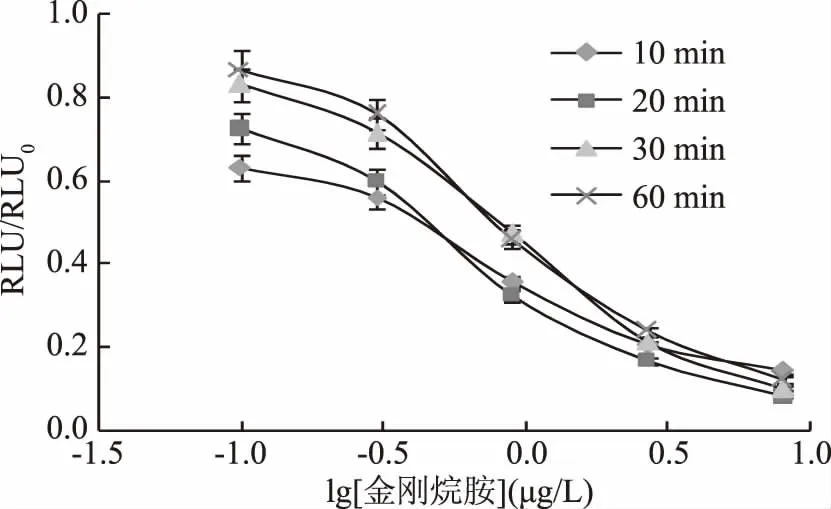
图2 反应时间的优化Fig.2 Optimization of reaction time
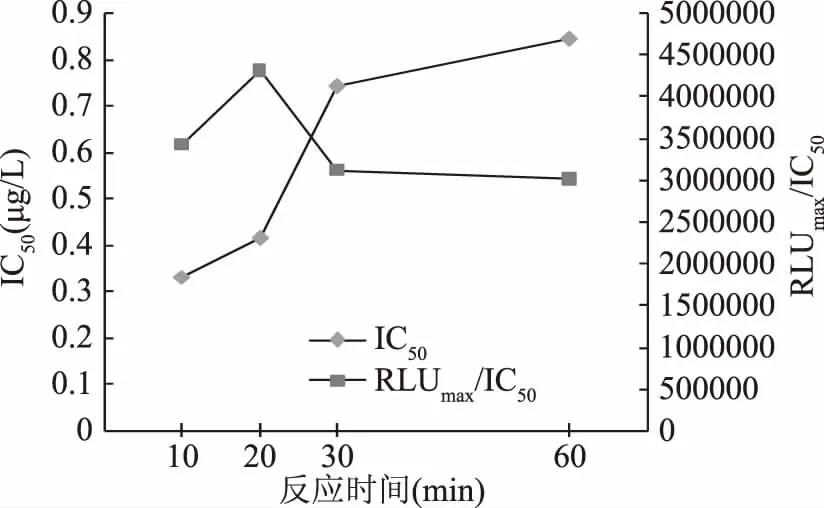
图3 反应时间优化实验IC50与RLUmax/IC50结果Fig.3 The results of IC50 and RLUmax/IC50 in the reaction time optimal experiment
2.1.3 底物发光时间的确定 同理,由图4和图5可知,随着底物发光时间的延长,RLUmax/IC50先减小后增大,在底物发光时间为3.5 min时,RLUmax/IC50最大;而灵敏度IC50先增大后减小,在底物发光时间为3.5 min时,IC50值最低。综合考虑,底物发光时间确定为3.5 min。
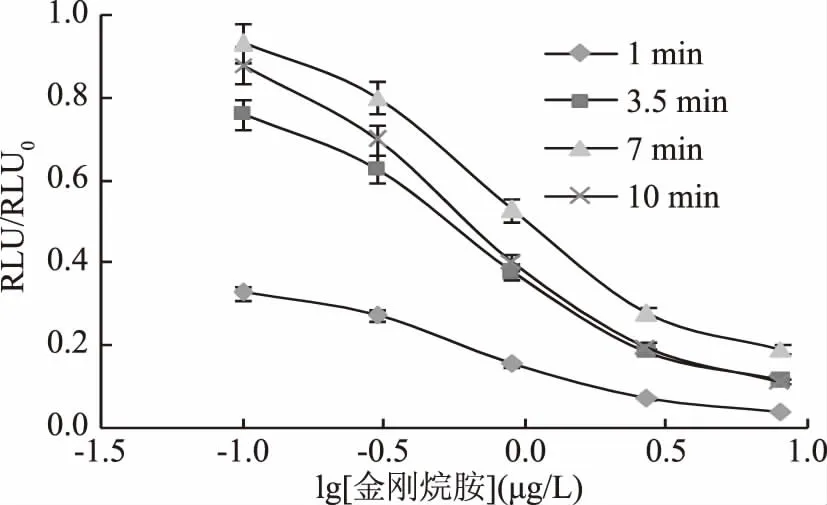
图4 底物发光时间的优化Fig.4 Optimization of substrate luminescence time
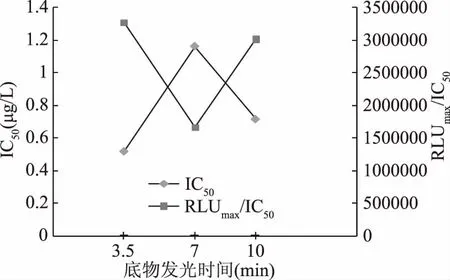
图5 底物发光时间优化实验IC50与RLUmax/IC50结果Fig.5 The results of IC50 and RLUmax/IC50 in the substrate luminescence time optimal experiment
2.2 建立标准曲线
绘制出的标准曲线为免疫法典型的倒“S”曲线,如图6所示,线性方程为y=-0.3980x+0.3735,R2=0.9638,得出的IC50为0.481 μg/L,线性范围是0.085~2.729 μg/L。
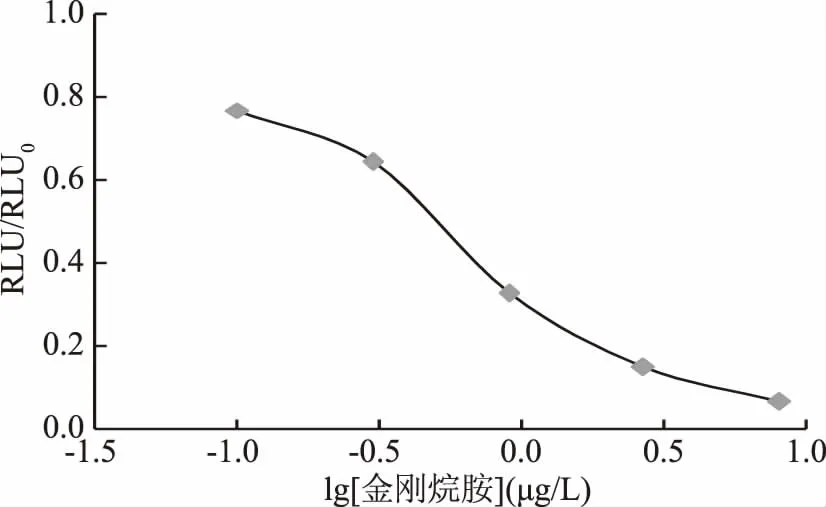
图6 金刚烷胺标准曲线Fig.6 Standard curve of amantadine
2.3 方法学评价
2.3.1 检测限测定结果 由表2可知,金刚烷胺在猪肉、清瘟败毒散、饲料原料、配合料、浓缩料中的检测限分别为0.098、0.098、0.095、0.093、0.100 μg/kg。为保证方法的准确性和产品的稳定性,避免出现假阳性和假阴性的现象[12],选择金刚烷胺CLIEA法在动物组织、兽药、饲料中的检测限为0.1 μg/kg。

表2 检测限测定Table 2 Determination of detection limit
2.3.2 准确度和精密度测定结果 由表3可知,金刚烷胺在猪肉、清瘟败毒散、饲料原料、配合料、浓缩料中的平均添加回收率为80.2%~94.5%,批内、批间相对标准偏差均<10%,说明该方法准确度良好、精密度高。
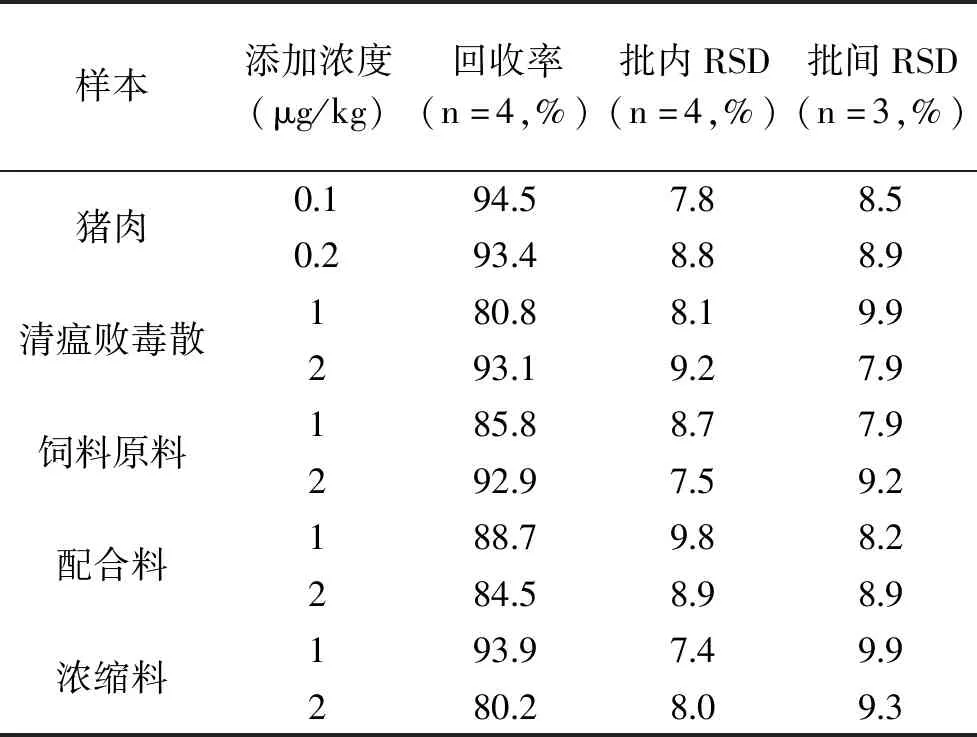
表3 准确度和精密度测定Table 3 Determination of accuracy and precision
3 讨论及结论
目前还没有关于金刚烷胺的化学发光免疫分析方法的报道,仅是开发完单克隆抗体后建立了ELISA检测方法,如吴松松[6]建立了金刚烷胺间接竞争ELISA快速定量检测方法,获得的IC50为11.93 ng/mL,检测限为1.18 ng/mL,线性范围为2.5~100 ng/mL;吴小平等[11]研制的金刚烷胺试剂盒标准曲线线性范围为0.5~40.5 μg/L,IC50浓度值为1.9 μg/L,对鸡肉中金刚烷胺的检出限为0.25 μg/kg,添加回收率范围为76.0%~109.0%,批内、批间变异系数均小于15%。本研究灵敏度(IC50为0.481 μg/L)显著高于ELISA方法,这是因为化学发光免疫分析作为一种液相中的均相反应,比固相酶联免疫反应更加充分,且化学发光把光子接收信号系统放大的倍数更高,使得检测所需的抗原抗体较少,从而得到更好的灵敏度。同时,本方法检测样本丰富,覆盖动物组织、兽药、饲料等,适用性更广;且采用磁性微粒替代传统的酶标板,避免了抗原或抗体扩散脱落而引起的检测结果不准确;增大了固液接触面积,提高了免疫反应速率,使反应更彻底[20]。
本研究建立的方法在动物组织、兽药、饲料中的检测限为0.1 μg/kg,样本添加回收率为80.2%~94.5%,批内、批间相对标准偏差均<10%,准确度良好、精密度高,且样品前处理简单、操作方便,耗时短,可用于大批量样品中金刚烷胺的检测,还有望结合全自动化学发光免疫分析仪,实现检测的自动化,从而降低人工操作带来的误差,进一步提高方法的灵敏度。

