传统豆酱储存过程中品质变化及其防腐体系的抑菌效果
黄小青,朱建鸿
(海天(高明)调味食品股份有限公司,广东佛山 528511)
传统豆酱是以黄豆和小麦粉为原料,通过微生物发酵形成的酱香味浓厚、风味独特的佐餐调味品,深受广大消费者的喜爱[1]。然而,在储存过程中,传统豆酱容易出现色泽变暗、口感变酸等问题。此外,传统豆酱中丰富的营养物质容易滋生微生物,严重影响产品的口感和品质,甚至还会产生食品安全问题。研究表明,食品在货架期储存过程中色泽变化主要与酶促反应、非酶促反应以及色素的降解有关。非酶促褐变是食品加工、储藏过程中一种普遍存在的现象,其中,美拉德反应是众多非酶促反应中最主要的反应之一[2]。美拉德反应主要是氨基化合物(氨基酸和蛋白质)和还原糖类通过一系列复杂的化学反应最终生成棕色或者黑色的大分子物质类黑精的褐变反应。
近年来,微生物挑战试验作为一种测试和评价产品防腐体系性能的有效手段,逐渐被国内外相关的企业接受和推广[3]。微生物挑战试验通过模拟产品在生产和实际使用过程中受到微生物污染,考察产品防腐体系的抑菌效果,从而保证货架期内产品微生物指标的安全性[4]。微生物挑战试验主要分为混合菌种接种法和单菌种接种法,通过在待测样品中接种一种或多种微生物,放置微生物于最适宜的条件下培养,观察待测样品不同时间内微生物菌落总数,评估待测产品防腐体系的抑菌效果[5]。陆凌霞等[6]利用该方法防腐剂对化妆品货架期防腐能力的影响。同时该方法也用于验证灭菌方法的性能[7]。目前对于传统豆酱的研究主要集中在从原材料到产品的发酵阶段的理化指标,风味的变化及微生物群落结果和安全性分析[8-9]。而对于传统豆酱货架理化指标,非酶褐变及其自身的防腐体系能力的研究鲜有报道。
为了更好地评估在货架期内传统豆酱品质变化以及产品防腐体系的抑菌效果,采用恒温加速法探究在不同储存条件下传统豆酱的色泽(褐变指数、色率、红色指数)、总酸、氨基酸态氮、还原糖、感官评分等变化情况。采用不同的单一菌种,探究密封和敞口条件下传统豆酱的防腐体系对不同微生物的抑菌效果,以期为如何有效地控制传统豆酱货架期稳定性提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
传统豆酱(由黄豆,小麦粉,味精,白糖等混合发酵而成) 广州沃尔玛超市;产膜酵母、米曲霉菌和耐盐性乳酸菌 广州菌种保藏与应用重点实验室;麦芽汁培养基、虎红(孟加拉)培养基、5%盐乳酸细菌肉汤培养基 广东环凯微生物科技有限公司;α-淀粉酶(1000 IU/g) 诺维信(中国)生物技术公司;氢氧化钠、甲醛、盐酸、硫酸铜、亚甲基蓝、乙酸锌、冰乙酸、亚铁氰化钾、酒石酸钾钠、葡萄糖、95%乙醇 上海国药集团有限公司,分析纯。
798MPTTitrion型全自动电位滴定仪 瑞士万通中国有限公司;SHP-250型生化恒温培养箱 广东环凯微生物科技有限公司;紫外可见分光光度计 赛默飞世尔科技(中国)有限公司;ZDX-35BI型座式自动电热压力蒸汽灭菌锅 上海申安医疗器械厂。
1.2 实验方法
1.2.1 不同温度条件下传统豆酱储存过程中理化指标的测定 将豆酱样品(500 g瓶装,出厂时间为两个月)分别置于25、38和50 ℃条件下储存28 d,每7d取样进行理化指标检测(3个平行样)。
1.2.1.1 褐变指数、色率及红色指数测定 称将传统豆酱样品50 g,加入α-淀粉酶溶液(最终浓度为20 U/mL)后于60 ℃条件下水解2 h。精确称取1.00 g水解样品,定容至100 mL,经定性滤纸过滤后,参照Ajandouz等[11]方法,以蒸馏水做空白,取滤液于420、610、510 nm波长处测定吸光度。以420 nm处的吸光值代表豆酱褐变程度。根据下面的公式分别计算豆酱的色率和红色指数[12]。


1.2.1.2 总酸测定 参照GB/T 5009.39-2008的方法,精确称取5.00 g研磨后的样品,定容至100 mL,吸取20 mL混合液于200 mL烧杯中,加60 mL水,使用全自动电位滴定仪测定样品总酸的含量。
1.2.1.3 氨基酸态氮测定 参照GB/T 5009.235-2016的方法,采用全自动电位滴定仪测定样品氨基酸态氮的含量。
1.2.1.4 还原糖测定 称取约100 g左右的传统豆酱于捣碎机中,充分捣碎研磨。精确取5.00 g研磨后的样品,加入50 mL去离子水,然后缓慢加入5 mL乙酸锌溶液和5 mL亚铁氰化钾溶液,定容至250 mL,参照GB/T 5009.7-2008食品中还原糖的测定方法中的直接滴定法,测定样品还原糖的含量。
1.2.1.5 感官特性评定 感官特性评定由10名具有多年经验的训练的感官评定人员组成的评价小组对传统豆酱进行感官评定。主要从色泽、香气、体态、口感四个方面对传统豆酱进行打分,每一项为10分,其权重分别为色泽0.2、香气0.25、体态0.25、口感0.3[13]。以平均分作为产品指标的评分。分数越高,产品的品质越好。感官评定标准见表1。

表1 传统豆酱的感官标准Table 1 Sensory standards for traditional soy sauce
1.2.2 微生物挑战测试 随机抽取从市场上购买的2罐传统豆酱,经无菌操作将豆酱分装到60个灭菌玻璃罐中(每瓶100 g),将三种不同的菌(产膜酵母、米曲霉菌、耐盐性乳酸菌)用生理盐水逐步梯度稀释,分别接入1 mL的菌悬液,对照组接入等体积的无菌生理盐水(最终菌液浓度:106CFU/g)[14]。将接入产膜酵母、米曲霉菌和耐盐性乳酸菌的传统豆酱成品(密封和敞口各一批)分别在28、30和37 ℃的恒温培养箱培养,分别于0、7、14、21和28 d对样品取样,参照GB 4789.2-2016食品微生物菌落总数测定方法测定每个样品对应的菌落总数。
1.3 数据处理
数据用平均值±标准偏差表示,每个样品重复操作三次,采用Origin 8.5作图。
2 结果与分析
2.1 储存温度对传统豆酱褐变指数的影响
如图1可知,在25、38和50 ℃温度下储藏28 d后发现,传统豆酱的OD420值分别为0.435、0.478和0.526,表明随着温度的升高,美拉德褐变反应速率加快,传统豆酱的褐变不断加剧。此外,传统豆酱色泽会随着储藏时间的延长而发生明显的变化,传统豆酱0 d的褐变指数是0.426,在25、38和50 ℃下储存28 d褐变指数分别增加了2.1%、12.2%和23.5%。这与Arrhenius方程或Eyring的过渡状态理论的结果是一致的,即随着温度的升高,有效碰撞的绝对次数以及单位时间内碰撞次数增加,反应速率加快[15]。

图1 储存温度对传统豆酱褐变指数的影响Fig.1 Effects of different storage temperatures on the browning index of traditional soybean paste
2.2 储存温度对传统豆酱色率的影响
色率表示颜色深浅的指标,色泽的深浅用色率强度来表示[16]。如图2可知,传统豆酱的色率随着储存时间的增加而不断地提高。储存期内不同温度下传统豆酱的色率随着温度的升高而增加。传统豆酱0 d的色率是921,28 d后,25 ℃储存的传统豆酱的色率仅为0 d的1.14倍,而38和50 ℃储存的传统豆酱的色率为0 d的1.36和1.76倍。这和陈龙等[17]报道的番茄酱储藏期间随着温度和时间的增加色泽加深的结果是一致的。由此可见,储存温度对传统豆酱的色率有明显的有影响,所以低温或常温储存有利于延长豆酱的保质期。
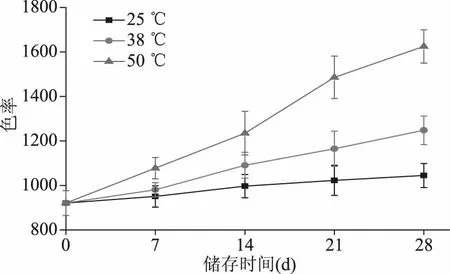
图2 储存温度对传统豆酱色率的影响Fig.2 Effects of different storage temperatures on the colour intensity of traditional soybean paste
2.3 储存温度对传统豆酱红色指数的影响
红色指数是传统豆酱色调两种表征方法之一,反映传统豆酱主要颜色的强弱。红色指数越大,红色色调越深[18]。不同储存温度下传统豆酱红色指数的变化趋势如图3所示,随着储存时间的延长,传统豆酱红色指数不断地降低。同时,储存期内不同温度下传统豆酱的红色指数随着温度的升高而降低。传统豆酱第0 d的红色指数是3.69,储存28 d后,25 ℃储存的传统豆酱红色指数仅降低了1.9%,而38和50 ℃储存的传统豆酱的红色指数分别降低了5.7%和12.5%。红色指数变化的规律和陈敏等[19]报道的结果是一致的。然而孙佳贺等[20]报道白汤酱油在储存前期红色指数不断地增加,而后趋于稳定,可能是白汤酱油前期储存的时间较短,颜色较浅,储存后期随着色率的进一步加深,红色指数会不断地升高。
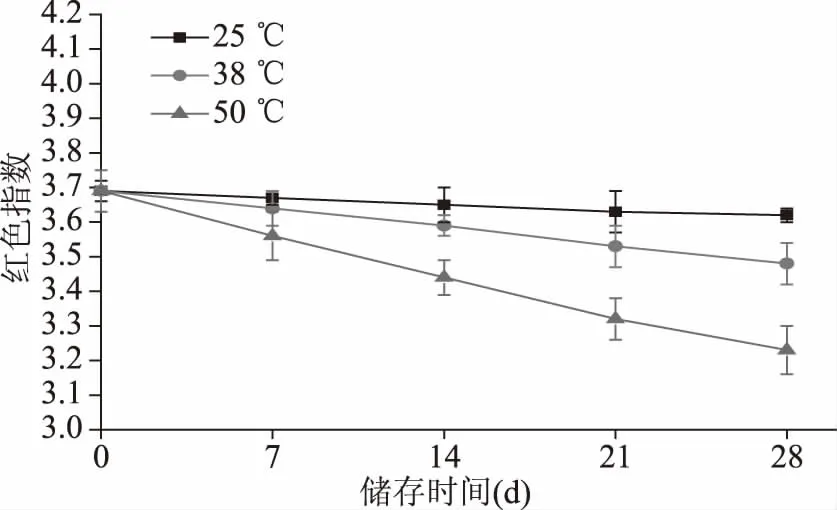
图3 储存温度对传统豆酱红色指数的影响Fig.3 Effects of different storage temperatures on red index of traditional soybean paste
2.4 储存温度对传统豆酱总酸的影响
不同储存温度条件(25、38、50 ℃)下,随着储存时间的延长,传统豆酱总酸含量的变化情况如图4所示。随着储存时间的延长,传统豆酱总酸含量逐步升高。传统豆酱总酸含量的初始值是1.27 g/100 g,在25、38和50 ℃的条件下储存28 d,总酸含量分别升高0.03、0.06和0.18 g/100 g。在三种不同的储存温度条件下,50 ℃的条件下总酸含量升高最快,38 ℃次之,25 ℃变化相对较慢。在储存期内,传统豆酱总酸含量的升高可能和美拉德反应有关。美拉德反应中还原糖可以和羰氨反应的中间产物分解为糖醛酸等酸性物质,此外,美拉德反应可以消耗碱性氨基酸基团,使得传统豆酱中的总酸含量升高[21]。

图4 储存温度对传统豆酱总酸的影响Fig.4 Effects of different storage temperatures on total acidity of traditional soybean paste
2.5 储存温度对传统豆酱氨基酸态氮的影响
氨基酸态氮的含量可用于表征在整个生物发酵过程传统豆酱中蛋白质的水解程度,反映传统豆酱发酵成熟度及其品质变化。此外,氨基酸与盐相互作用的产物是传统豆酱的主要呈鲜物质,对传统豆酱的风味起到非常重要的作用[22]。不同储存温度条件(25、38、50 ℃)下,随着储存时间的延长,传统豆酱氨基酸态氮含量的变化情况如图5所示。传统豆酱氨基酸态氮含量初始值是0.44 g/100 g,38和50 ℃储存28 d含量分别下降了4.54%和11.36%,而25 ℃储存28 d氨基酸态氮含量基本没有变化含量。由于传统豆酱储存过程中,美拉德反应不断地消耗氨基酸,从而导致氨基酸态氮含量不断降低,而当储存温度较低时,美拉德反应程度相应较低,氨基酸的消耗量也会随之降低,其氨基酸态氮含量变化不大,可能与传统豆酱仍然有部分氨基酸不断地生成和溶出有关[20]。

图5 储存温度对发酵酱氨基酸态氮的影响Fig.5 Effects of different storage temperatures on amino acid nitrogen in traditional soybean paste
2.6 储存温度对传统豆酱还原糖的影响
传统豆酱中还原糖主要来源于淀粉原料的降解,其含量的变化可以在一定程度下反映制曲过程中微生物的生长状况。在传统豆酱储存过程中,还原糖还会参与美拉德反应。不同储存温度下传统豆酱还原糖的变化情况如图6所示。传统豆酱在38和50 ℃条件下储存28 d后,其还原糖分别升高了0.3和0.9 g/100 g,这与邓丽[23]报道在货架期内酱的还原糖含量升高的结果一致,但与孙佳贺等[20]白汤酱油在储存过程中还原糖含量不断下降的结果相反。这可能是由于传统豆酱货架期储存过程中大量的白砂糖转化为还原糖,虽然还原糖与氨基酸的美拉德反应会消耗一部分还原糖,但是还原糖的产生速率大于消耗速率,导致货架期内还原糖的含量呈现上升的趋势[23]。

图6 储存温度对发酵酱还原糖的影响Fig.6 Effects of different storage temperatures on reducing sugar in traditional bean paste
2.7 储存温度对传统豆酱感官品质的影响
感官品质是食品品质非常重要的指标。采用表1所述的感官评定方法对产品的色泽、香气、体态、口感进行评估,初步考察不同的储存温度条件下传统豆酱感官品质的变化情况,结果如表2所示。
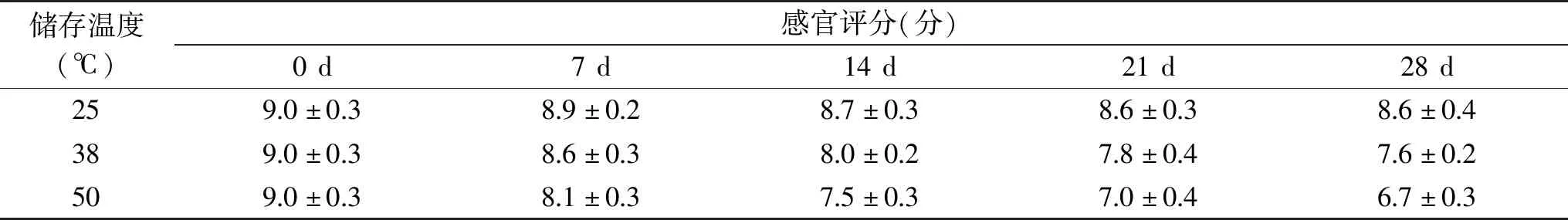
表2 不同储存温度对传统豆酱感官品质的影响Table 2 Effects of different storage temperatures on sensory quality of traditional soybean paste
随着储存时间的延长,传统豆酱的色泽不断地加深,颜色发暗,酱体上表面还会出现氧化变黑现象。储存期内不同温度下传统豆酱的色泽还会随着温度的升高不断地加深,50 ℃条件下传统豆酱的色泽最深,38 ℃次之,25 ℃色泽变化较慢。不同储存温度条件下的传统豆酱的香气随着储存温度的升高,香气会显得稍浓郁,但没有太明显的差异,这可能和储存温度的升高加快美拉德反应的速率,产生更多的香气物质有关。研究表明传统豆酱的香气成分及其复杂,主要包括醇类、醛类、酯类、呋喃类、吡嗪类等化合物,形成传统豆酱特有的酱香和酯香[24]。不同储存温度条件下的传统豆酱的体态之间差异很小,感官特性得分均分布在8~10分。随着储存时间的延长,传统豆酱的口感略带酸涩味,可能和传统豆酱货架期内美拉德反应生成的糖醛酸等物质有关[21]。不同储存温度条件(25、38、50 ℃)下的传统豆酱的口感随着温度的升高,口感酸涩味越明显。在25、38和50 ℃温度下储存28 d后传统豆酱的感官特性得分分别下降了4.4%,15.6%和25.6%。
2.8 传统豆酱密封条件微生物挑战测试
为了评估货架期内传统豆酱防腐体系的抑菌效果,在无菌条件下,分别向等量的传统豆酱中接入产膜酵母、米曲霉菌和耐盐性乳酸菌菌悬液,密封放置,观察不同时期传统豆酱微生物菌落总数变化情况,结果如表3所示。

表3 传统豆酱密封条件微生物菌落总数Table 3 Total number of microbial colonies in sealed preserved traditional soybean paste
由表3可知,与添加无菌水的传统豆酱对照组相比,添加产膜酵母、米曲霉菌和耐盐性乳酸菌传统豆酱第0 d的菌落总数均达到104CFU/g;接菌后第7 d,添加产膜酵母和耐盐性乳酸菌的传统豆酱微生物菌落总数小于102CFU/g,而添加米曲霉菌的传统豆酱微生物菌落总数为2.1×104CFU/g;接菌后的第14 d添加产膜酵母和耐盐性乳酸菌海鲜酱的微生物菌落总数小于10 CFU/g,而添加米曲霉菌的海鲜酱的微生物菌落总数为3.6×103CFU/g。由此可知,密封保存状态下传统豆酱防腐体系对抑制产膜酵母和耐盐性乳酸菌微增殖能力较强,对抑制米曲霉菌增殖能力稍差。
随着培养储存时间延长,菌落总数逐渐降低,储存时间达到第28 d时,添加产膜酵母、米曲霉菌和耐盐性乳酸菌的传统豆酱对应的微生物菌落总数均小于10 CFU/g,低于国家菌落总数标准限值[25]。该结果表明,密封保存条件下,传统豆酱的防腐体系可以有效地抑制产膜酵母、米曲霉菌以及耐盐性乳酸菌微生物的生长。
2.9 传统豆酱敞口条件微生物菌落总数
为了进一步评估货架期内传统豆酱防腐体系的抑菌效果,在无菌条件下,分别向等质量的传统豆酱中接入产膜酵母、米曲霉和耐盐性乳酸菌菌悬液,敞口放置,观察不同时期传统豆酱微生物菌落总数变化情况,结果如表4所示。

表4 传统豆酱敞口条件微生物菌落总数Table 4 Total number of microbial colonies in open state of traditional soybean paste
由表4可知,与添加无菌水传统豆酱的对照组相比,添加产膜酵母、米曲霉菌和耐盐性乳酸菌传统豆酱第0 d的微生物菌落总数均达到104CFU/g,随着培养贮藏时间延长,菌落总数逐渐降低。敞口放置第28 d时,仅添加无菌水和耐盐性乳酸菌的传统豆酱对应的耐盐性乳酸菌微生物菌落总数小于10 CFU/g,其它组微生物菌落总数均大于10 CFU/g,尤其是添加米曲霉菌的传统豆酱微生物菌落总数接近8×102CFU/g,该结果表明敞口环境下传统豆酱防腐体系可以有效抑制耐盐性乳酸菌的生长,对产膜酵母、米曲霉菌和耐盐性乳酸菌微生物的生长也有一定的抑制效果,但是不能完全有效抑制产膜酵母和米曲霉菌的生长。产膜酵母和米曲霉菌均属于真菌微生物,适宜在自然环境下生长繁殖,难以通过现有的传统豆酱防腐体系进行有效抑制。因此,敞口放置的传统豆酱容易受到杂菌的污染,不能确保货架期内微生物的安全。
3 结论
本研究结果表明随着储存时间延长以及储存温度升高,传统豆酱色泽褐变程度加剧,总酸和还原糖含量呈现升高的趋势,氨基酸态氮以及感官特性评分均呈现下降的趋势。密封保存条件下,传统豆酱的防腐体系可以有效地抑制产膜酵母、米曲霉菌以及耐盐性乳酸菌微生物的生长,有效地确保货架期内传统豆酱防腐体系的抑菌效果。敞口保存条件下,传统豆酱中的防腐体系可以一定程度地抑制产膜酵母、米曲霉菌和耐盐性乳酸菌的生长,但是容易受到杂菌的污染,难以通过现有的传统豆酱防腐体系进行有效抑制,不能确保货架期内产品微生物的安全。

