山楂多糖提取工艺优化及其降血糖、降血脂活性
钟丽霞,江震宇,汪嘉妮,李旭枫,徐丽珊
(浙江师范大学化学与生命科学学院,浙江金华 321004)
山楂(CrataeguspinnatifidaBunge),蔷薇科山楂属植物,是我国一种药食两用的果品[1]。其种植面积广,产量可观,民间常用于降血糖、降血脂。据报道,山楂富含多糖、多酚、有机酸、三萜、甾醇、胡萝卜素、氨基酸等化学成分及微量元素[1-3],其中多糖是山楂中一类重要的生物活性物质。多糖又称多聚糖,是由醛糖或酮糖通过脱水形成糖苷键,并以糖苷键线性或分支连接而成的链状聚合物。研究发现,多糖除了可以作为植物的贮藏养料和骨架成分外,还具有降血脂、降血糖、增强免疫力、抑癌、抑菌等一系列重要生物学功能[4-7]。
近年来,已经有学者对枸杞多糖[8]、芦荟多糖[9]进行深入研究,表明多糖具有诱人的开发价值和广阔的市场前景。目前对山楂多糖提取工艺的研究尚少,且现有的研究多是热水浸提、超声提取工艺,关于微波辅助提取山楂多糖工艺的研究很少,鲜有文献对优化提取工艺后提取的山楂多糖进行进一步的活性探究。微波辅助提取技术[10]是国内外常用的植物活性成分提取技术,其主要是依靠微波加速活性成分的溶出。人体内血糖及血脂的代谢过程受多种酶的调控,通常以酶为靶标,研究各类活性物质对血糖、血脂代谢的作用[11]。
因此,本试验采用单因素实验法和响应面法优化微波辅助提取山楂多糖的工艺条件,并通过体外测定山楂粗多糖对α-葡萄糖苷酶、胰脂肪酶的活性及DPPH·清除能力,研究其降血糖、降血脂活性,以期为山楂资源的开发利用及山楂源保健产品的研发奠定基础。
1 材料与方法
1.1 材料与仪器
山楂(山里红) 浙江金华医药公司,新鲜山楂去核后放入60 ℃烘箱中,烘干至恒重,粉碎机粉碎过筛,贮存于干燥环境中待用;1,1-二苯-2-苦肼基(DPPH·)、胰脂肪酶、α-葡萄糖苷酶、4-硝基苯基丁酸酯(PNPB)、4-硝基苯-α-D-吡喃葡萄糖苷(PNPG)、胆酸钠及牛磺胆酸钠 美国Sigma公司;无水乙醇、正丁醇、氯仿等有机试剂 均为国产分析纯。
FW135粉碎机 天津泰斯特仪器有限公司;DHG-9140A电热恒温鼓风干燥箱 上海恒科技有限公司;BSA-224S电子天平 赛多利斯科学仪器有限公司;MDS-8G微波消解仪 上海新仪微波化学科技有限公司。
1.2 实验方法
1.2.1 山楂粗多糖的提取 采用微波辅助提取乙醇沉淀法提取山楂多糖。山楂粉采用石油醚以1∶2 (g/mL)的料液比萃取除去脂溶性物质,每次15 min,重复三次,抽滤烘干。一定质量的山楂粉和去离子水按一定固液比(g/mL)充分混匀后,进行微波辅助提取,提取液于4 ℃,4500 r/min离心10 min,取上清液浓缩、干燥后复溶于一定量的去离子水,按四倍体积的量加入无水乙醇沉淀12 h;4500 r/min离心20 min,沉淀烘干得到山楂多糖提取物。将山楂多糖提取物复溶于去离子水中,以液固比3∶1 (mL/g)用活性炭吸附法除色素;取脱色素后的样品液以样品液与Sevag试剂体积比3∶1在恒温水浴摇床振荡(200 r/min)20~30 min,400 r/min离心20 min,取少量上清液测定蛋白的质量,重复处理5次,除蛋白后冷冻干燥得到山楂粗多糖。
1.2.2 多糖提取物提取量测定及多糖含量测定 多糖提取物提取量计算公式如下:
多糖提取物提取量(mg/g)=a/m
式中:a为山楂多糖提取物的质量,mg;m为除去脂溶性物质后山楂粉的质量,g。
多糖含量测定[12]:取1 mL山楂粗多糖溶液于试管中,浸于冰浴中冷却,再加入4 mL蒽酮试剂,沸水浴10 min,取出用自来水冷却后比色。用不同浓度的标准葡萄糖溶液代替山楂粗多糖溶液制标准曲线,标准曲线公式为:y=10.056x+0.0113,R2=0.997,y为待测液糖质量浓度,x为标准葡萄糖溶液。测得的吸光度值由标准曲线查算出山楂粗多糖溶液的糖含量。多糖含量按照以下方程进行计算:
W(%)=CV/m×100
式中,W为糖的质量分数,C为从标准曲线上查出的糖质量浓度,mg/mL;V为样品稀释后的体积,mL;m为样品的质量,mg。
1.2.3 单因素实验
1.2.3.1 提取功率对山楂多糖提取物提取量的影响 固定提取温度60 ℃,提取时间9 min,固液比1∶30 (g/mL),考察不同微波功率(300、400、500、600、700 W)对山楂多糖提取物提取量的影响。
1.2.3.2 提取时间对山楂多糖提取物提取量的影响 固定提取温度60 ℃,固液比1∶30 (g/mL),固定微波功率500 W,考察不同提取时间(3、6、9、12、15 min)对山楂多糖提取物提取量的影响。
1.2.3.3 提取温度对山楂多糖提取物提取量的影响 固定微波功率500 W,提取时间6 min,固液比1∶30 (g/mL),考察不同提取温度(40、50、60、70、80 ℃)对山楂多糖提取物提取量的影响。
1.2.3.4 固液比对山楂多糖提取物提取量的影响 固定提取温度60 ℃,提取时间6 min,固定微波功率500 W,考察不同固液比(1∶20、1∶25、1∶30、1∶35、1∶40 (g/mL))对山楂多糖提取物提取量的影响。
1.2.4 响应面试验设计 在单因素实验的基础上,利用响应面分析法优化山楂多糖提取物的提取工艺。根据Box-Behnken的中心组合设计原理,并综合单因素实验结果,以提取温度(A)、提取时间(B)、提取功率(C)为3个影响因素,以山楂多糖提取量为响应值。采用统计分析软件Design-Expert 8.0,建立3因素3水平的响应面分析法,进行二次多项回归方程拟合及其优化分析。响应面试验因素与水平设计见表1。

表1 响应面试验因素水平表Table 1 Factors and levels of response surface methodology
1.2.5 山楂粗多糖降血糖、降血脂活性测定
1.2.5.1α-葡萄糖苷酶抑制活性的测定 50 μL山楂粗多糖溶液与50 μLα-葡萄糖苷酶(0.5 U/mL)(以pH6.8磷酸钾缓冲盐配制)混匀后,于37 ℃水浴锅上温浴5 min,再加入100 μL 5 mmol/L 以相同缓冲盐配制的对硝基苯基葡萄糖苷(PNPG)溶液进行反应,于405 nm处测定反应体系的酶动力曲线。以等量的pH6.8磷酸钾缓冲盐溶液代替样品溶液作为空白组,同样操作,测得反应体系的酶动力曲线[13]。以阿卡波糖作为阳性对照。按照以下方程计算α-葡萄糖苷酶活性抑制率。
抑制率(%)=(1-k1/k2)×100
式中,k1和k2分别是样品组和空白组酶动力曲线斜率k值。
1.2.5.2 胰脂肪酶抑制活性的测定 取50 μL山楂粗多糖溶液与100 μL酶液(以pH8.0 Tris-HCl缓冲液配制)混匀后,置于37 ℃恒温箱内预热5 min,然后注入100 μL底物溶液,于405 nm处测定反应体系的酶动力曲线。以等量的Tris-HCl缓冲溶液代替样品溶液作为空白组,同样操作,测得反应体系的酶动力曲线[14]。以奥利司他为阳性对照。按照以下方程计算胰脂肪酶活性抑制率。
抑制率(%)=(1-k1/k2)×100
式中,k1和k2分别是样品组和空白组的酶动力曲线斜率k值。
1.2.5.3 DPPH·自由基清除效果的测定 将不同浓度的山楂粗多糖溶液和VC溶液(阳性对照)各2 mL与0.15 mmol/L 的DPPH自由基溶液(无水乙醇配制,2 mL,混匀避光反应30 min,在517 nm处测吸光度值(Ai);将不同浓度的山楂粗多糖溶液和VC溶液各2 mL与2 mL去离子水混匀后,避光反应30 min,于517 nm处测定吸光值(Ab);2 mL去离子水与2 mL DPPH·溶液混匀后,避光反应30 min,于517 nm处测定吸光值(Ac),重复三次[15]。按照以下方程计算DPPH·自由基清除率。
清除率(%)=[1-(Ai-Ab)/Ac]×100
1.3 数据处理
本实验所有数值均为3次以上测定值,以平均值±标准偏差表示,实验数据采用SPSS软件分析,p<0.01为差异极显著,p<0.05为差异显著,p>0.05为差异不显著。
2 结果与分析
2.1 单因素实验
2.1.1 提取功率对山楂多糖提取物提取量的影响 微波功率对山楂多糖提取物提取量的影响如图1所示。由图1可知,当微波功率由300 W上升到500 W时,山楂多糖提取物提取量随之增加,在500 W时达到最大值(118.63±0.46) mg/g,600 W后含量变化趋于平缓。主要原因是随着微波功率的增加,产生的热效应增加,提高山楂多糖的分子动能,使山楂多糖释放并溶于溶剂中;当功率大于500 W时,山楂多糖提取物的提取量下降,可能是瞬间温度上升,使部分多糖降解,导致提取量降低。因此,选取500 W为最佳微波功率。
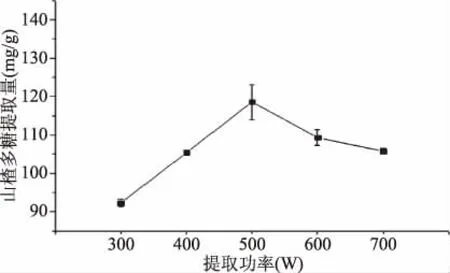
图1 提取功率对山楂多糖提取物提取量的影响Fig.1 Effect of extraction power on extraction yield of polysaccharide extract from hawthorn
2.1.2 提取时间对山楂多糖提取物提取量的影响 提取时间对山楂多糖提取物提取量的影响如图2所示。由图2可知,山楂多糖提取量随着提取时间的增加先增加后降低,在6 min时达到最大值(136.50±0.07) mg/g。这是因为微波时间较短时,山楂多糖析出不充分,提取率降低;但时间过长,在微波的作用下部分山楂多糖结构被破坏,从而对提取量造成影响。因此,最佳的提取时间为6 min。

图2 提取时间对山楂多糖提取物提取量的影响Fig.2 Effect of extraction time on the extraction yield of polysaccharide extract from hawthorn
2.1.3 提取温度对山楂多糖提取物提取量的影响 提取温度对山楂多糖提取物提取量的影响如图3所示。由图3可知,随着提取温度的增加,山楂多糖提取物提取量先增加后减小,在60 ℃达到最大值(117.94±0.09) mg/g,之后便开始下降。这可能是因为在温度过高的情况下,其他物质溶出,增加了溶液的粘稠度,阻碍了多糖的溶出,从而降低了提取量。因此,选取60 ℃为最佳提取温度。

图3 提取温度对山楂多糖提取物提取量的影响Fig.3 Effect of extraction temperature on the extraction yield of polysaccharide extract from hawthorn
2.1.4 固液比对山楂多糖提取物提取量提取的影响 固液比对山楂多糖提取物提取量的影响如图4所示。由图4可知,山楂多糖提取物提取量随着固液比的下降先上升后下降再小幅度上升。随着固液比的下降,溶液的黏度下降,有利于多糖的扩散和溶出;当固液比为1∶30 (g/mL)时,山楂多糖提取物提取量最高。因固液比对山楂多糖提取物提取量的影响相较于其他三个因素影响较弱,故不作为响应因子进行进一步优化。综上实际情况等因素,选择固液比为1∶30 (g/mL)。
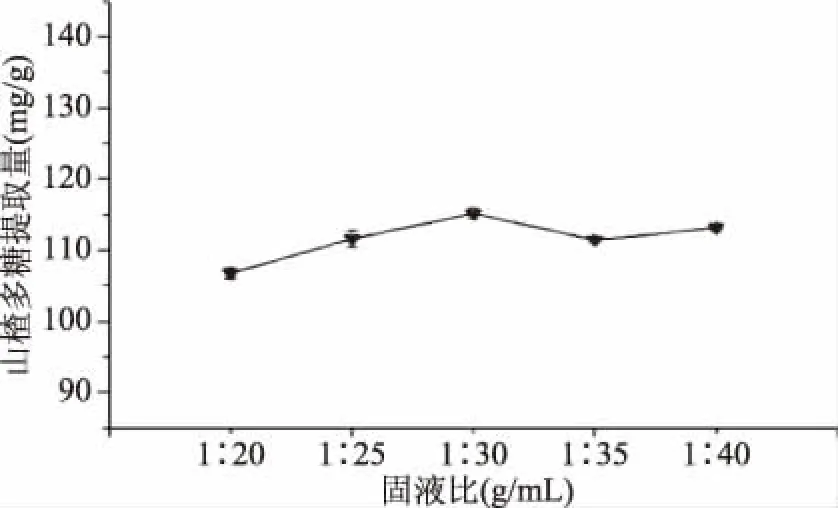
图4 固液比对山楂多糖提取物提取量的影响Fig.4 Effect of solid-liquid ratio on the extraction yield of polysaccharide extract from hawthorn
2.2 响应面优化山楂多糖提取工艺
2.2.1 响应面试验设计及结果 以山楂多糖提取物提取量为试验指标,根据Box-Behnken中心组合设计原理,设计三因素三水平分析实验,试验设计及结果见表2。

表2 响应面试验设计及结果Table 2 Design and results of response surface experiment
2.2.2 回归模型显著性检验及方差分析 通过Design-Expert 8.05b响应面分析软件分析,方差分析如表3所示。得到山楂多糖提取物提取量(Y),提取温度(A)、提取时间(B)、提取功率(C)的二次多项回归方程为:Y=143.65+14.44A+11.75B-2.46C+3.15AB-7.03AC+5.58BC-22.81A2-18.17B2-24.34C2。F检验显示,模型具有很高的F值和极低的p值(p<0.01),说明模型高度显著。失拟项为0.3279,没有达到显著水平,表明所建立的回归模型可以用来分析该工艺条件。在一次项中的A、B以及二次项中的A2、B2、C2、AC、BC对山楂多糖提取物提取量的影响达到极显著水平(p<0.01),一次项中的C以及二次项中的AB达到显著水平(p<0.05),这表明这3个因素与山楂多糖提取物提取量有直接的关系,是影响提取率的主要因子。

表3 回归模型的方差分析Table 3 Variance analysis of regression model
2.2.3 交互作用分析 响应面图形是控制其中一个因素在0水平,响应值对应其余两个因素所做的三维曲面图和等高线图,其可以直观地反映出各因素及其两两之间的交互作用对响应值的影响[16-17]。由图5(a)可以看出,提取时间和提取温度具有明显的交互作用,响应面坡度都比较陡峭,说明响应值受提取时间和提取温度的影响均较大。当提取功率一定时,山楂多糖提取物提取量随着提取时间的增长而增大,达到最大值后变为下降,而温度对响应值的影响也与其相类似;图5(b)显示,提取功率与提取时间也具有明显的交互作用,固定提取温度不变,随着提取功率的增大,山楂多糖提取物提取量先升高后降低,微波功率在300~500 W的区间内提取量上升较快,提取时间对山楂多糖提取物提取量的影响也呈现此规律;图5(c)显示,提取功率与提取温度之间具有明显的交互作用,当提取时间一定时,山楂多糖提取物提取量随着提取功率的增大而增多,达到最大值后随即降低,提取温度对山楂多糖提取物提取量的影响也与之相类似。

图5 各因素交互作用对山楂多糖提取物提取量的影响Fig.5 Effects of interaction of various factors on the yield of polysaccharide extract from hawthorn
2.2.4 最佳工艺条件确定与验证 通过Design-Expert 8.05b软件分析,山楂多糖提取物提取的最佳条件是功率493.81 W,提取时间7.03 min,提取温度63.49 ℃。在最佳提取条件下预测山楂多糖提取物提取量的最大值为148.28 mg/g。综合考虑实际,确定最后修正的最佳工艺条件为:功率500 W,提取时间7 min,提取温度63 ℃,在修正条件下验证试验,结果显示山楂多糖提取物提取量为(147.10±0.32) mg/g,与模型预期值差异不显著。说明该优化结果可靠,可以用于山楂多糖的提取工艺。
通过上述最优条件得到的山楂多糖提取物,其中多糖含量达39.32%±0.80%。
2.3 山楂粗多糖降血糖、降血脂活性测定
2.3.1 山楂粗多糖对α-葡萄糖苷酶抑制率 山楂粗多糖对α-葡萄糖苷酶抑制率的结果如表3所示。由表3可以看出,在试验范围内随着山楂粗多糖质量浓度的升高,α-葡萄糖苷酶抑制率呈逐渐上升趋势,经测定山楂粗多糖对α-葡萄糖苷酶抑制率的IC50值为(99.22±0.89) μg/mL。以阿卡波糖为阳性对照,测得其对α-葡萄糖苷酶抑制率的IC50值为0.16 μg/mL。可见山楂粗多糖对α-葡萄糖苷酶具有较好的抑制作用,说明山楂粗多糖具有降血糖的功效。

图6 不同浓度山楂粗多糖对α-葡萄糖苷酶的抑制率Fig.6 Inhibition rate of hawthorn crude polysaccharides with different concentrations on α-glucosidase
2.3.2 山楂粗多糖对胰脂肪酶抑制率 山楂粗多糖对胰脂肪酶的抑制率结果如表4所示。由表4可以看出,在试验范围内随着山楂粗多糖质量浓度的升高,胰脂肪酶抑制率呈逐渐上升趋势,经测定山楂粗多糖对胰脂肪酶抑制率的IC50值为(22.50±0.79) mg/mL。以奥利司他为阳性对照,测得其对胰脂肪抑制率的IC50值为0.91 mg/mL。说明山楂粗多糖具有较好的降血脂作用。
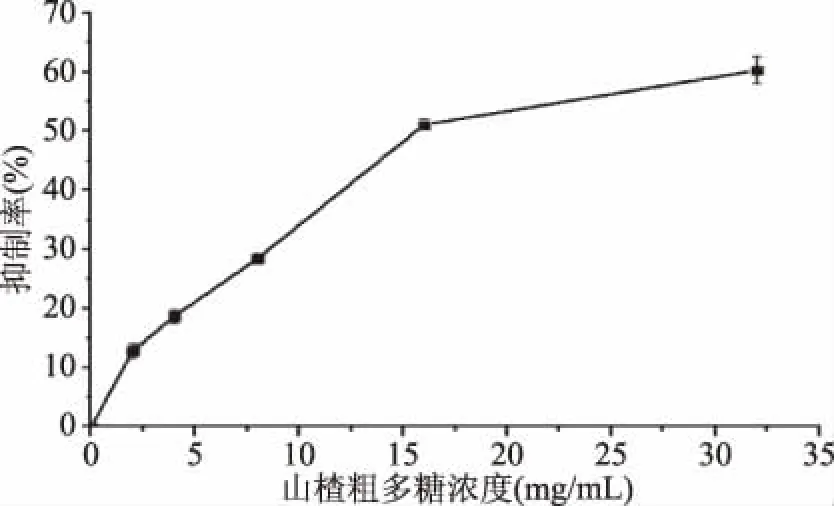
图7 不同浓度山楂粗多糖对胰脂肪酶的抑制率Fig.7 Inhibition rate of hawthorn crude polysaccharides with different concentrations on pancreatic lipase
2.3.3 山楂粗多糖对DPPH·的清除能力 山楂粗多糖对DPPH·的清除能力结果如表5所示。由表5可以看出,在试验范围内随着山楂粗多糖质量浓度的升高,DPPH·清除率呈上升趋势,经测定山楂粗多糖对DPPH·清除率的IC50值为(185.80±0.64) μg/mL。以VC阳性对照,测得其对DPPH·清除率的IC50值为8.81 μg/mL。说明山楂粗多糖具有较好的抗氧化作用,山楂粗多糖是山楂具有良好抗氧化功能的主要物质。在正常情况下体内含有一定的自由基,当体内的自由基超过一定额度以后对人体造成一定的伤害,引起一系列慢性疾病,如高血糖、高血脂,故测定DPPH自由基清除率对山楂粗多糖降血糖、降血脂的研究具有一定的指导意义。
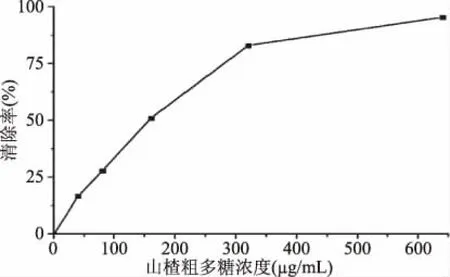
图8 不同浓度山楂粗多糖对DPPH·清除率Fig.8 DPPH· scavenging rate of hawthorn crude polysaccharides with different concentrations
3 结论
在单因素实验的基础上,通过响应面法对微波提取山楂提取物进行工艺优化,得到其最佳工艺条件为:提取温度63 ℃,微波功率500 W,提取时间7 min,在此条件下山楂多糖提取量为(147.10±0.32) mg/g。山楂粗多糖对α-葡萄糖苷酶、胰脂肪酶具有较好的抑制作用,对DPPH·具有良好的清除能力,其IC50分别为(99.22±0.89)、(22.50±0.79)、(185.80±0.64) μg/mL,说明山楂粗多糖中具有降血糖、降血脂的活性成分,为山楂的进一步开发利用提供依据。

