无机固态锂离子电池电解质的研究进展
杨建锋,李林艳,吴振岳,王开学
(1深圳斯诺实业发展有限公司,广东 深圳 518057;2上海交通大学,上海 200240)
自20世纪90年代锂离子二次电池商业化广泛应用以来,电解质主要以液态形式存在,以碳酸乙烯酯、碳酸二甲酯、碳酸二乙酯和碳酸甲乙酯等有机溶剂作为溶剂,LiPF6或LiBF4等锂盐为电解质盐。液态电解质存在诸多安全问题,如溶剂易燃、有毒、热稳定性差、电极界面副反应多导致发热甚至爆炸等[1-2]。相比液体电解质,无机固态电解质除了安全性高的优势明显外,还具有较好的储能稳定性、高循环寿命等特点[3]。
理想的无机固态电解质应该满足以下条件[4-5]:①较高的总(包括本体+晶界)锂离子电导率,能接近10-2S/cm,在正负极活性材料之间的锂离子迁移率接近1.0;②电化学窗口较宽,高电压环境下的化学稳定性良好;③在电化学反应过程中与正负极保持惰性,在电极的固体接触面不发生额外的副反应;④与电极之间界面阻抗小;⑤在制备成薄膜电极时经济性高、环境友好。
目前,LiPON型、Perovskite型、GARNET型和LISICON型四种电解质受到研究者的广泛关注(图1)[6]。其中,LiPON的离子电导率较低,但可以做成薄膜电池电解质材料,且化学和电化学性质稳定;钙钛矿型固体电解质电导率较高,可达10-3S/cm,但其电化学及化学稳定性较差;GARNET型无机电解质优点多,如离子电导率优良、电子电导率低、化学稳定性好、与电极材料相容性好、耐高压和工作温度范围宽;LISICON型电解质在结构上与γ-Li3PO4相似,通过离子掺杂可以获得优异的离子电导率。
1 无机固态锂离子电池电解质的研究进展
1.1 LiPON型电解质
1992年,BATES等[7]首次报道了薄膜LiPON电解质。在纯N2气氛中,通过溅射法把N原子成功引入Li3PO4靶材,两配位氮(-N=)和三配位氮(-N<)取代锂磷酸盐中的桥氧(-O-)和非桥氧(=O),制得锂离子电导率较高的无定形LiPON薄膜电解质,电解质的离子电导率从7×10-8S/cm提高到了2×10-6S/cm。LiPON型电解质是一种无定形固体电解质,具有化学稳定性高、与负极金属锂相容性佳和电化学窗口较宽(vs.Li/Li+,0~5.5 V)的优点,但是离子电导率相对较低。
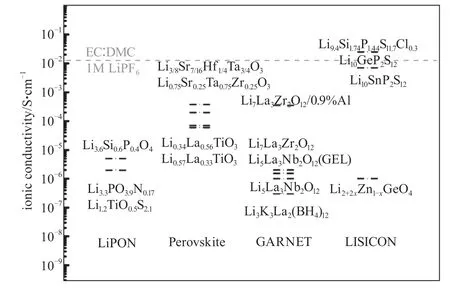
图1 近年报道的部分固态锂离子电池在室温下的离子电导率[6],包括 LiPON[7-9]、GARNET[10-13]、LISICON[14-17]、Perovskite[18-21]Fig.1 Reported ionic conductivity of solid-state lithiumion conductors at room temperature [5],including LiPON[7-9],GARNET[10-13],LISICON[14-17]],Perovskite[18-21]
制备薄膜电解质是提高其离子电导率的一个主要研究方向,使用薄膜作为电解质层,可缩短正极与负极之间的距离,从而降低固体电解质的内阻,以此来补偿离子电导率不高的问题。NOWAK等[26]首次利用离子束溅射的方法制备了厚度低达12 nm的LiPON电解质薄膜,该膜表面粗糙度低于3 nm,室温锂离子电导率约为2×10-7S/cm。由于超薄的厚度,使电解质的绝对电导率达到了0.2 S/cm2。利用该超薄LiPON电解质薄膜组装成Ag/LiPON/Pt电池,经过100次充放电循环后,透射电镜观察发现电解质层没有发生明显变化,表明超薄LiPON电解质层稳定性较强。
有些报道则从改变实验条件方面研究LiPON离子电导率。XIAO等[27]通过采用富锂Li3.3PO4替代传统Li3PO4靶材,在射频测控溅射法下沉积Li-补偿LiPON电解质,将锂离子导电率从2.4×10-6S/cm提高到3.2×10-6S/cm。且在相同条件下组装的电池,采用Li-补偿LiPON比普通LiPON具有更优异的倍率性能和容量保持率。作者认为Li-补偿LiPON可以降低Li离子缺陷引起的空间电荷层效应。VAN-JODIN等[8]则采用射频溅射法分别在不含磁控(非标准)和含磁控(标准)两种条件下沉积得到LiPON电解质薄膜。测试结果表明,在24 ℃下,非标准LiPON电解质薄膜的离子电导率为6.7×10-6S/cm,远高于标准LiPON电解质薄膜(1.4×10-6S/cm)。原因是在标准LiPON中只存在一种磷酸盐基团,而非标准LiPON中还存在磷酸盐基团。这些不同的磷酸盐基团使得非标准LiPON结构处于无序状态,所以Li+迁移速率更高。
虽然LiPON型电解质离子电导率不高,但是其化学性质和电化学性质稳定,且与很多正极材料如LiNi0.5Mn1.5O4、V2O5、LiCoO2[22-24]等相容性好,可应用于薄膜锂离子电池中。LI等[22]制备了Li/LiPON/LiNi0.5Mn1.5O4的薄膜电池,设定起止电压为3.5~5.1 V,电池在5 C倍率下进行充放电,循环10000次后容量保持率达到90%,库仑效率高达99.98%。
韩国科学技术院LEE教授等[25]通过常规的转移方法制备了LiCoO2/LiPON/Li柔性薄膜锂离子电池,使得多样灵活的锂离子电池成为可能。对该柔性薄膜锂离子电池进行不同程度的弯折,结果显示弯折会导致电池容量一定程度的衰减,但对比100次循环充放电容量保持率和倍率性能测试,变化趋势基本与未弯折的电池保持一致。对电池进行疲劳试验,如图2(c)所示经过20000次反复弯折(0.2 m/s),电压较稳定,综上试验可知弯折对电池性能影响较小。

图2 可弯曲LiPON便携式薄膜电池示意图(a,b),及在不同弯曲次数下的电压(c)[25]Fig.2 Bendable thin-film LiPON electrolyte for lithium-ion battery(a,b) and voltage retention during fatigue tests(c)[25]

图3 Li1.2TiO0.5S2.1/LiPON/Si薄膜封装锂离子电池横截面FIB-SEM(a,b),放电曲线(c)[9]Fig.3 FIB/SEM cross section of a thin film encapsulated lithium-ion microbattery comprising the Li1.2TiO0.5S2.1/LiPON/Si active layers and titanium current collector(a,b),discharge curves(c)[9]
FRÉDÉRIC等[9]利用磁控溅射法制备了以LiPON为电解质的2 V固态锂离子电池(图3),负极为非晶硅纳米薄膜(50~200 nm)、正极为新型Li1.2TiO0.5S2.1。电化学测试结果表明该固态薄膜电池具有优异的循环性能(-0.006%圈-1)以及极快的充电速度(10 min可充到80%的容量)。
LI等[28]通过磁控溅射法制备了(Ti/ZnO/LiPON/LiMn2O4/Ti)LiPON全固态薄膜锂离子电池,整个电池厚度约2.5μm,其中Ti、ZnO、LiPON、LiMn2O4和外表LiPON保护层的厚度分别为250 nm、800 nm、500 nm、450 nm和250 nm。由于LiPON膜的保护,该电池可曝露在空气中,在24 ℃下对其进行电化学性能测试,设定电压范围0.5~5 V,当充放电电流密度为5 μA/cm2时,电池可逆比容量达到22 μA∙h/cm2。
由于LiPON电解质薄膜电池还存在很多问题,如容量有限、制造成本较高、工艺复杂且对空气中的水和氧气较敏感,制约了其进一步大规模应用和发展。
1.2 Perovskite型电解质
理想的钙钛矿结构可以用分子式ABO3来表示,属于立方晶系,空间群为Pm3m。A离子通常是碱土金属或者是稀有元素,占据着立方晶胞的顶点,B离子通常是一些过渡金属元素,占据着晶胞的体心,O原子位于面心,A点通常是12配位的,B点通常是6配位的。锂可以通过异价掺杂的方式进入到钙钛矿结构当中进入A位点,形成比如Li3xLa2/3-x□1/3-2xTiO3型化合物[29]。研究表明,Li原子的引入,可以影响Li位点和空穴的数量以及空穴与Li的相互作用,从而能显著的影响锂离子电导率。如钙钛矿型Li3xLa2/3-xTiO3(LLTO)(当x=0.11,激活能Ea=0.3~0.4 eV)电解质在室温下的离子电导率高达10-3S/cm[18,30]。
LLTO固体电解质的高离子电导率吸引了广泛的关注,目前报道了一系列的研究,包括锂含量、烧结温度、掺杂效果、合成方法和无定形LLTO固体电解质等。YU等[31]通过固相反应法在较低温度1200 ℃下烧结6 h制备了LiO2-SiO2-B2O3(LBS)玻璃掺杂的Li0.5La0.5TiO3(LLTO)陶瓷固体电解质。结果表明,样品主要呈四方钙钛矿结构,晶粒尺寸随玻璃含量的增加而增加。当玻璃LBS掺杂量为1.0%(质量分数)时,通过等效电路计算得到最大离子电导率1.12×10-3S/cm,几乎是室温下纯LLTO的1.7倍。JIMÉNEZ等[19]通过溶胶-凝胶法制备La0.57Li0.33TiO3(LLTO)纳米粒子,再采用流延成型法制备LLTO电解质薄膜,总离子电导率为5.0×10-8S/cm。HUANG等[20]通过简单的固相反应制备了钙钛矿类的固态电解质Li3/8Sr7/16Hf1/4Ta3/4O3(LSHT),在室温25 ℃下,该电解质的离子电导率可达3.8×10-4S/cm,在298~430 K之间具有0.39 eV的低活化能(图4)。
KIMURA等[21]通过固相反应合成了Li2x-ySr1-xTayZr1-yO3(x=0.75)化合物,研究了不同含量的Ta对合成的化合物离子电导率的影响。在y=0.60-0.75之间,该化合物为单相的钙钛矿型,随着y的增加,其晶格常数逐渐增加,表明Sr2+和Zr4+都被Li+和Ta5+所代替,从而使该化合物的离子电导率逐渐上升,当y=0.75时,达2.0×10-4S/cm。而当y=0.77和0.80时,其化合物包含了如LiTaO3、SrTa2O6和Sr2Ta2O7等杂相,致使离子电导率降低。
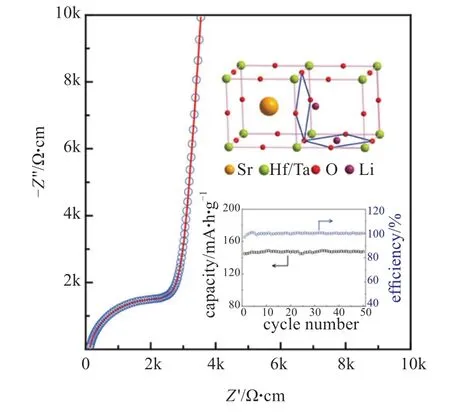
图4 Li3/8Sr7/16Hf1/4Ta3/4O3电化学性能及晶体结构示意图[20]Fig.4 Unit cell structure and electrical performance of LiSrHfTaO[20]3/87/161/43/43
1.3 GARNET型电解质
GARNET氧化物型电解质来源于理想的石榴石结构A3B2(XO4)3(A=Ca、Mg、Y、La 或其他稀有元素;B=Al、Fe、Ga、Ge、Mn、Ni或V;X=Si、Ge、Al),其中A,B,C分别是8,6,4配位的阳离子[4]。该类电解质具有离子电导率高、电子电导率低、化学稳定性好、与电极材料相容性优、电化学分解电压较高和工作温度范围较宽等特点,是目前无机固体电解质研究的一个热点。
2003年,THANGADURAI等[10]最先报道了富Li的GARNET型的电解质Li5La3M2O12(M=Nb、Ta),在25 ℃条件下,电解质的离子电导率约为10-6S/cm。Li5La3Nb2O12和Li5La3Ta2O12的活化能分别为0.43 eV和0.56 eV,但是Li5La3Nb2O12比Li5La3Ta2O12的离子电导率稍高一些,这些化合物是各向同性导体,并且Li+可以在三维框架中扩散。研究发现Li5La3Ta2O12与熔融锂可稳定存在,因为Ta比其他过渡金属(包括Ti、Nb)的还原性差。从目前对富Li的GARNET型电解质的研究得到,GARNET型结构的化合物每个化学式可以至少容纳3个锂离子,最多可接近7个,其离子电导率随着Li在GARNET型结构中的浓度增加而增加,实验优化后的结果认为,Li浓度最佳含量在6.5~7.0之间。
GAO等[12]采用溶胶凝胶法制得了Li5La3Nb2O12粉末晶体前驱体,然后将前驱体焙烧,得到了100~200 nm的颗粒,室温下Li5La3Nb2O12的总离子电导率为1.54×10-6S/cm,与高温固相法的实验结果相近,而使用这种方法比高温固相法的操作温度降低了近250 K,从而避免了锂在高温下的挥发。
GARNET型电解质Li5La3M2O12(M=Zr),简称LLZO,拥有较高的室温离子电导率(10-3~10-4S/cm),激活能仅为0.3 eV,是一种有应用前景的全固态锂离子电池材料[32]。ZHAO等[33]通过冷静压法制备了 Li7La3Zr2O12(LLZO)固体电解质隔膜,烧结温度为1150 ℃时,得到的样品为纯立方相,表面致密、无明显气孔存在,30 ℃下的总离子导电率为 1.07×10-4S/cm,电子导电率为2.39×10-8S/cm,表现为良好的离子导体、电子绝缘体。
通过在LLZO电解质中复合少量第二相材料可改善锂离子电导率。BUSCHMANN等[13]制备了2种GARNET型结构的固态电解质:Li7La3Zr2O12和Li7La3Zr2O12/0.9%Al,研究发现只需要少量的Al,便能十分有效的起到稳定骨架的作用,因为Al可以进入GARNET在四方24d位置上Li的空穴,从而起到稳定Li7La3Zr2O12的骨架作用(图5)。Li7La3Zr2O12和Li7La3Zr2O12/0.9%Al在室温下的锂离子电导率可分别达到2.0×10-6S/cm和3.55×10-4S/cm,可以看到,在GARNET型电解质引入Al,对提高离子电导率起到十分明显的作用。

图5 (a)Li7La3Zr2O12/0.9%Al高分辨透射显微镜图;(b)在(a)中局部放大图;(c)Li7La3Zr2O12/0.9%Al根据Li7La3Zr2O12/0.9%Al结构计算机模拟高分辨透射图[13]Fig.5 (a) experimental HRTEM micrograph of Li7La3Zr2O12/0.9%Al; (b) fourier-filtered HRTE-M image of the region marked in (a); (c) simulated HRTEM image based on the crystal structure model of Li7La3Zr2O12/0.9%Al[13]
SHIN等[34]采用Li3BO3玻璃陶瓷作为烧结添加剂,通过低温烧结制备石榴石型Li7La3Zr2O12固体电解质。研究结果表明,Li3BO3能够有效降低烧结温度(700 ℃),稳定其立方相。当烧结温度高于850 ℃时,发生Li7La3Zr2O12晶粒重排以及掺杂了Li3BO3的Li7La3Zr2O12的固态烧结。如在1100 ℃下烧结8 h得到的Li7La3Zr2O12-8%Li3BO3复合电解质锂离子电导率达到1.9×10-4S/cm。研究表明熔融的Li3BO3渗进Li7La3Zr2O12晶粒间隙,能够减小晶粒间的界面电阻,提高离子电导率,改善其电化学性能。
掺杂也是提高LLZO离子导电率的一种常用方法。BERNUY-LOPEZ等[35]用Ga掺杂代替了部分Li,合成了Li6.55La3Zr2Ga0.15□0.3O12。他们采用MAS-NMR研究发现,用Ga掺杂取代部分Li会生成Li空穴,Ga原子占据着四面体的位点,使Li原子更加随机的分布在空余的位点上,从而提高了锂离子电导率,室温条件下(24 ℃)锂离子电导率达到了1.3×10-3S/cm(结构示意图见图6)。
目前,Li位和Zr位的掺杂改性是提高LLZO离子电导率的研究热点,La位对 LLZO的整个晶体结构影响较大,且决定了锂离子传输的瓶颈尺寸,故针对La位掺杂改性研究较少。研究表明,采用碱土金属( Ca,Sr,Ba) 对 La 位进行取代能有效提高锂离子电导率,原因是碱土金属元素掺杂能够有效增加 LLZO 结构中的 Li2位置上锂含量,同时减少 Li1位置上的锂含量。Li2位置的锂离子要比Li1位置的更容易迁移[36]。
硼氢化物类GARNET电解质由于[BH4]-的还原性,在电池组件中形成钝化层而不易与电极发生反应,目前已在全固态电池中得到应用。BRIGHI等[10]合成的两种电解质Li3K3Ce2(BH4)12和Li3K3La2(BH4)12,室温下的离子电导率分别为3×10-7S/cm和6×10-7S/cm,相比于同构型的GARNET氧化物型的电解质高。通过掺杂Sr、Eu可有效提高离子电导率,分别可提高至9×10-7S/cm、1.1×10-6S/cm。
GARNET型电解质的高离子电导率使其成为全固态锂离子电池的优选材料,然而它在空气中不稳定,会与水蒸气和CO2发生反应[37],因此有必要在提高其在空气中的稳定性方面进行研究。

图6 Li6.55La3Zr2Ga0.15□0.3O12结构示意图[35]Fig.6 The Garnet structure of LiLaZrGa□O[35]6.55320.150.312
1.4 LISICON型电解质
LISICON[38-39]和thio-LISICON型[17,40]电解质在结构上都与γ-Li3PO4相似,属于斜方晶系Pnma空间群,要想提高材料的离子导电率,必须想办法降低迁移离子与主骨架间的作用力,以得到足够大的离子迁移通道。HONG等[41]首次报道了LISICON固体电解质Li14Zn(GeO4)4,在300 ℃下离子电导率达到1.25×10-1S/cm。
得益于计算机科学和信息技术的发展,通过高通量的计算,使得模拟那些可能具有较好性能的固态电解质成为可行。FUJIMURA等[42]通过第一性原理计算以及机器学习算法模拟计算LISICON型电解质在高温下的离子电导率(图7),结合理论和实验数据来预测不同组成的电解质在特定温度下的锂离子电导率。经过优化得到的化合物其锂离子电导率均不低于10-4S/cm。
DENG等[43]通过实验和模拟研究了Li4SiO4,Li3.75Si0.75P0.25O4, Li4.25Si0.75Al0.25O4,Li4Al0.33Si0.33P0.33O4和Li4Al1/3Si1/6Ge1/6P1/3O4几种材料。研究发现,从低温到高温的过程中有三种Li+传输机理:局部振荡、分离跳频和超离子运动。采用P、Al或者Ge替换Li4SiO4中的Si会引起混合聚阴离子效应,从而降低扩散机制之间的过渡温度,提高离子电导率。通过MD模拟,计算Li4Al1/3Si1/6Ge1/6P1/3O4在室温下的离子电导率为9×10-4S/cm,远高于Li4SiO4。
2011年,LISICON型电解质的研究取得了重大突破。KAMAYA等[14]通过引入Ge元素,利用高温固相法合成出了一种新型结构的固体电解质Li10GeP2S12(LGPS)。这种固体电解质具有非常高的锂离子电导率,达到了1.2×10-2S/cm,几乎接近有机电解液的电导率。LiCoO2/Li10GeP2S12/Li全固态锂电池在14 mA/g的电流密度下,首次充放电比容量分别为135 mA∙h/g和124 mA∙h/g,效率为91.85%,超高的离子电导率引起广泛的关注。
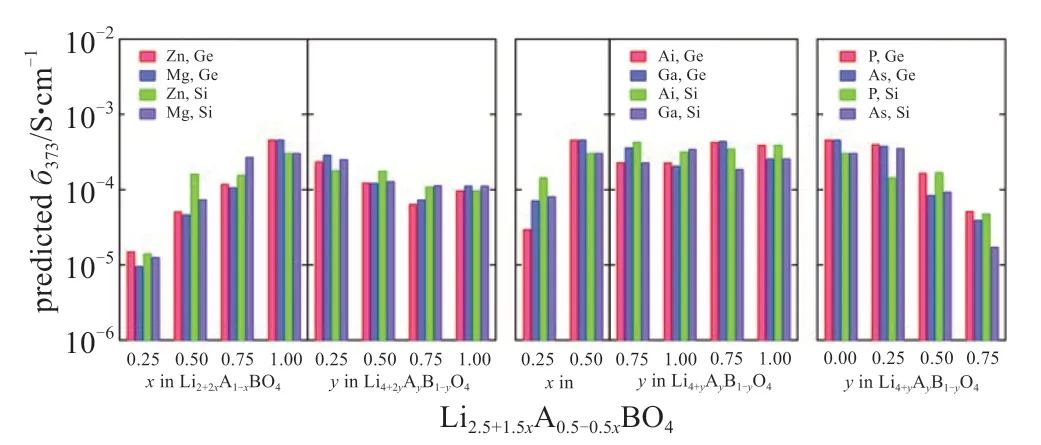
图7 计算机模拟在373 K下在Li8-cAaBbO4系统中72个位点放置不同原子的离子电导率,其中Am+=Zn、Mg、Al、Ga、P 或 As,Bn+= Ge、Si,c=ma+nb[42]Fig.7 Predicted ionic conductivities at 373 K,for 72 compositions in the system Li8-cAaBbO4,where Am+= Zn,Mg,Al,Ga,P or As,and Bn+=Ge or Si,and c=ma+nb[42]
受KAMAYA等[14]研究的启发,ONG等[42]利用第一性原理计算研究了Li10±1MP2X12(M=Ge、Si、Sn、Al、P,X=O、S、Se)系列的电化学稳定性以及离子电导率。他们发现对具有较小晶格常数的化合物来说,晶格常数越小,离子电导率越低,但是对大晶格常数的化合物,晶格常数的影响就很小了。计算表明,对Ge采用同价元素Si、P进行替换,材料具有相似的相稳定性、电化学稳定性和锂离子电导率。但当O对S进行替换时,稳定性和电导率都变差了。
BRON等[15]用廉价的Sn代替Ge,采用Li2S、P2S5和Li4[SnS4]为原材料合成了Li10SnP2S12固态电解质,其结构见图8。尽管该化合物的离子电导率比Li10GeP2S12低得多,只有4×10-3S/cm,但是其原料成本低,下降约3倍,经济性高。
2016年,KATO等[16]在原有的Li10GeP2S12工作基础之上,引入Si原子,制备了一种新型的快离子导体Li9.4Si1.74P1.44S11.7Cl0.3,其室温下离子电导率高达2.5×10-2S/cm,比Li10GeP2S12高出了2倍,同时原料成本也得到降低。他们将这种新型的快离子导体作为固体电解质组装高电压高功率的全固态锂离子电池,表现出了优越的功率密度,在电流密度为18 C进行充放电时电化学性能佳,如图9所示,优于当前的液态电解质电池。此外,电池具有较宽的工作温度范围(-30~100 ℃)。
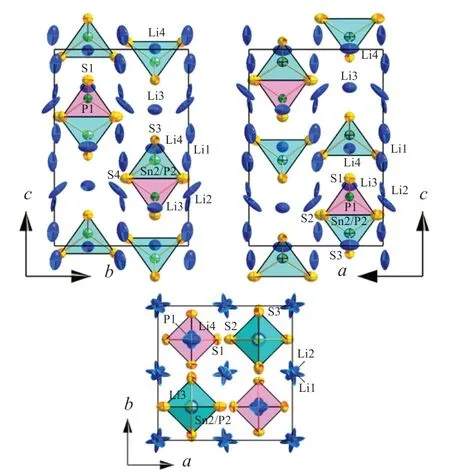
图8 Li10SnP2S12不同角度的X射线单晶衍射模拟图[15]Fig.8 Different views of the single-crystal X-ray structure of LiSnPS[15]10212
卤化物(F、Cl、Br)可以用来部分替换O2-调整尺寸瓶颈和结合能量,从而改善LISICON型电解质离子电导率及其稳定性。SONG等[45]用Cl-部分替换O2-得到LISICON型电解质Li10.42Si1.5P1.5Cl0.08O11.92和Li10.42Ge1.5P1.5Cl0.08O11.92,离子电导率分别为1.03×10-5S/cm和3.7×10-5S/cm(27 ℃),比原材料Li3PO4高13个数量级,比Li10.5Si1.5P1.5O12高一个数量级。研究认为这是由于Cl-半径大于O2-,所以Cl-部分替换 O2-可以增大晶格常数和锂离子扩散瓶颈的大小。同时Cl-电负性小于O2-,Li+与Cl-之间的键合作用比O2-之间Li+要弱。同时,Cl-替换LISICON电解质在电压高达9 V(vs.Li+/Li)的情况下都与金属锂能稳定存在,是目前报道的电化学窗口最宽的固体电解质。
LISICON型电解质热稳定性高且蒸气压接近0,能应用于高温条件下,且在水和水性电极中能稳定存在。但是与其它固体电解质相比,LISICON型电解质报道较少,可能是因为其锂离子导电率相当低(室温下10-7S/cm),并且与锂和空气接触时稳定性差[46]。
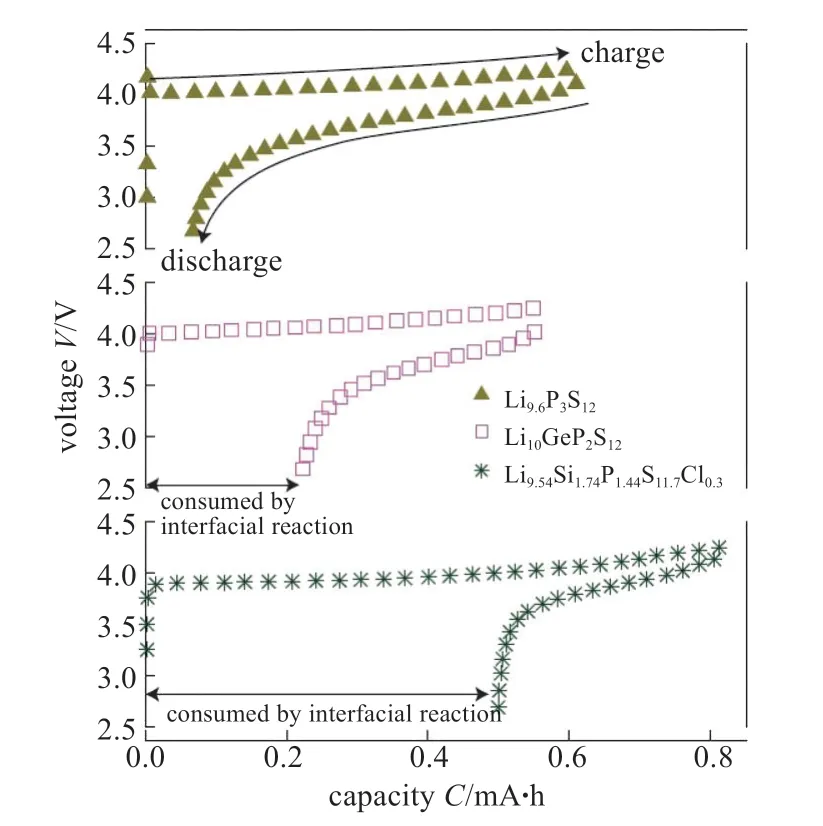
图9 LGPS系列固态电解质电化学翁稳定性图(组装成LiCoO2/LGPS/Li 电池测试)[16]Fig.9 Electrochemical stability of the LGPS family.Electrochemical stabilities of the electrolytes with the LGPS-type structure,characterized by the LiCoO2/solid electrolyte/Li cell[16]
2 结 语
为了实现全固态锂电池的广泛应用,科研工作者们在关键材料固态电解质方面做了很多研究。尤其在提升无机固态电解质离子电导率方面取得了很大进展,部分固体电解质已经达到了与液体电解质相媲美的离子电导率。LiPON的离子电导率较低,可以做成薄膜电池电解质材料;钙钛矿型固体电解质离子电导率较高,稳定性还待提高;GARNET型无机电解质优点多,如离子电导率优良、电子电导率低和化学稳定性好等,但是在空气中不稳定;LISICON型电解质在结构上γ-Li3PO4相似,通过离子掺杂可以获得优异的离子电导率,与空气和锂电极接触时稳定性还需要改善。
只有兼顾力学性能、离子电导率、电化学窗口和稳定性的无机物复合型固态电解质,才能组装安全、性能佳的全固态电解质。此外,需要进一步努力来改善固体电解质的性质和固体电解质与电极之间的相容性,随着界面和界面电阻的改善,全固态电池可以表现出更好的性能。

