菜籽抗氧化肽WDHHAPQLR的环境稳定性研究
姚轶俊 张 晶 鞠兴荣 王立峰
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心1,南京 210023)(江南大学食品学院2,无锡 214122)
众多研究认为食物蛋白来源的抗氧化肽类物质是一类安全性较高的抗氧化剂。目前,国内外学者从不同来源的蛋白质中制备出了具有各种活性的肽类物质,但这些研究主要集中在制备工艺、分离纯化、功能鉴定及构效关系等方面[1-3],而有关加工储藏条件对多肽活性的影响却研究较少[4]。多肽作为蛋白质的降解衍生物,性质与蛋白质类似,都很容易受到环境因素的影响,如在生产、加工及储藏过程中可能会因氧化、脱酰胺、水解或环化等作用而发生降解,导致其活性下降甚至完全丧失,这将影响到肽类产品的开发应用,所以研究多肽类物质稳定性存在的环境条件可以为多肽的生产加工提供参考[4]。
刘丹[5]分析了大豆多肽的稳定性,结果显示高温、金属离子和强碱性环境不利于多肽活性的保持,同时添加的少量的柠檬酸可以使此多肽羟基自由基清除活性增强。此外,在胃肠道消化过程中多肽很可能会受到胃肠液中的胃蛋白酶、胰蛋白酶以及食物消化过程中产生的Fe、Cu、H2O2、NO、血红素、脂质过氧化物等物质的影响,使其结构发生变化而失活。朱淑云等[6]考察了水飞蓟粕蛋白酶解物的稳定性,结果表明添加食盐、蔗糖、葡萄糖等对DPPH自由基清除活性影响不大,但经胃液消化后DPPH自由基清除活性明显降低,经肠液消化后后DPPH自由基清除活性增强。陈亮等[7]研究了温度、pH及肠胃环境对玉米低聚肽稳定性的影响,结果显示温度及pH对多肽的稳定性影响较小,基本上不受肠胃消化环境的影响,能保持较高的生物活性。贾俊强等[8]考察了温度、pH、干燥方式和体外肠道酶消化对蚕蛹源 ACE 抑制肽稳定性的影响,分析发现此多肽在高温、酸性和碱性环境下不稳定,易失活,冷冻和喷雾两种干燥方式对多肽的活性影响很小,同时此多肽具有较强的耐蛋白酶消化的能力。因此,研究多肽在加工、储藏及胃肠道中的稳定性,对于理论和实践方面有重要意义。
本研究以Alcalase 2.4L酶解“双低”油菜籽宁杂19号得到的菜籽蛋白酶解物(rapeseed protein hydrolysate,RPH)为原料,通过超滤和凝胶色谱分离其活性肽组分,对酶解液及各分离组分进行抗氧化活性研究及多肽序列鉴定,发现抗氧化肽WDHHAPQLR具有较高的抗氧化活性,可作为一种天然抗氧化剂应用于食品加工中,同时还可以作为功能性食品添加剂[9]。然而作为食品添加剂,其在食品储藏过程及其在人体内环境中的稳定性研究都显得尤为重要。因此在前期研究的基础上,研究食品环境如pH、食品配料成分、金属离子、防腐剂以及模拟利用过程中体外胃肠消化等因素对菜籽抗氧化肽WDHHAPQLR稳定性的影响,旨在为菜籽抗氧化肽作为抗氧化剂在后续试验、生产、储藏及功能性利用方面提供参考。
1 材料与方法
1.1 材料与试剂
菜籽肽WDHHAPQLR由实验室利用Alcalase 2.4 L水解菜籽蛋白后得到菜籽蛋白水解物,并经过超滤膜分离、凝胶色谱(Sephadex G-15)和RP-HPLC分离纯化制得[9]。
菲洛嗪、DPPH、蔗糖、柠檬酸、苯甲酸钠、山梨酸钾、胃蛋白酶、胰蛋白酶;NaCl、CuSO4、MgSO4、ZnSO4、CaCl2、KCl、NaOH、HCl等试剂均为分析纯。
1.2 仪器与设备
HH-4数显恒温水浴锅、PHS-3C雷磁pH计、Milli-Q纯水机、SpectraMax M2e酶标仪、QL-861漩涡振荡器。
1.3 实验方法
1.3.1 DPPH·自由基清除活性的测定
用无水乙醇配制0.04 mg/mL的DPPH溶液。分别取2 mL不同浓度(2,4,6,8 mg/mL)的样品溶液,加入2 mL DPPH溶液,混合均匀,室温放置30 min后,5 000 r/min离心10 min。取上清液于517 nm处测吸光值。用VC作为阳性对照。样品对DPPH自由基的清除率按照式(1)计算:
(1)
式中:A0表示2 mL无水乙醇+ 2 mL DPPH溶液的吸光值;A1表示2 mL样品溶液+ 2 mL DPPH溶液的吸光值;A2表示样品溶液+ 2 mL无水乙醇的吸光值。
1.3.2 Fe2+-螯合金属离子能力的测定
实验方法参照Dinis的相关文献[10],并进行了一定的修改。用蒸馏水分别配制浓度为2 mmol/L的FeCl2溶液和5 mmol/L ferrozine溶液;将1 mL待测溶液与0.05 mL FeCl2溶液、0.2 mL ferrozine溶液混合均匀,室温下放置10 min,测定溶液在562 nm下的吸光值。对照组以去离子水代替样品,同时每组设置5个平行。Fe2+-螯合金属离子能力按照式(2)计算:
Fe2+-螯合金属离子能力=(A0-A1)/A0×100%
(2)
式中:A0表示对照组的光密度值;A1表示样品的光密度值。
1.3.3 抗氧化肽活性保持率计算
分别测定菜籽抗氧化肽处理前的DPPH·自由基清除活性和Fe2+-螯合金属离子能力A0,然后测定经不同处理后的DPPH·自由基清除活性和Fe2+-螯合金属离子能力A1,按式(3)计算:
活性保持率=A1/A0×100%
(3)
1.3.4 温度对抗氧化肽稳定性的影响
配制1 mg/mL的菜籽抗氧化肽(WDHHAPQLR)溶液,分别放置于20、40、60、80、100 ℃的水浴锅中保存1 h后冷却至室温分别测定其DPPH·自由基清除活性、Fe2+-螯合金属离子能力。
1.3.5 pH对抗氧化肽稳定性的影响
配制1 mg/mL的菜籽抗氧化肽(WDHHAPQLR)溶液,分别调pH值为2、4、6、8、10、12,在室温下放置1 h后测定其DPPH·自由基清除活性、Fe2+-螯合金属离子能力。
1.3.6 食品配料成分对抗氧化肽稳定性的影响
配制1 mg/mL的菜籽抗氧化肽(WDHHAPQLR)溶液,在溶液分别添加NaCl、柠檬酸、蔗糖。其中,NaCl的质量分数为1.0%、2.0%、4.0%、6.0%、8.0%;柠檬酸的质量分数为0.02%、0.04%、0.08%、0.12%、0.16%;蔗糖的质量分数为2.0%、4.0%、6.0%、8.0%、10.0%;室温下放置1 h后测定其DPPH·自由基清除活性、Fe2+-螯合金属离子能力。
1.3.7 金属离子对抗氧化肽稳定性的影响
配制1 mg/mL的菜籽抗氧化肽(WDHHAPQLR)溶液,分别添加50、100、150、200、250 μg/mL的K+、Ca2+、Mg2+、Zn2+、Cu2+,室温下放置1 h后测定其DPPH·自由基清除活性、Fe2+-螯合金属离子能力。
1.3.8 防腐剂对抗氧化肽稳定性的影响
配制1 mg/mL的菜籽抗氧化肽(WDHHAPQLR)溶液,在溶液中分别添加苯甲酸钠和山梨酸钾,使其质量分数为0.02%、0.04%、0.08%、0.12%、0.16%,室温下放置1 h后测定其DPPH·自由基清除活性、Fe2+-螯合金属离子能力。
1.3.9 胃-肠道蛋白酶对抗氧化肽稳定性的影响
配制1 mg/mL的菜籽抗氧化肽(WDHHAPQLR)溶液。实验方法参照文献[11],并进行了一定的修改。胃蛋白酶消化:用1 mol/LHCl将肽液的pH值调至2.0,加入4%的胃蛋白酶在37 ℃下水浴2 h后,煮沸10 min终止消化,冷却至室温后离心(10 000 g,10 min),将上清液分为2份,一份测定其DPPH·自由基清除活性、Fe2+-螯合金属离子能力,另一份继续用胰蛋白酶消化。胰蛋白酶消化:将胃蛋白酶消化后的上清液的pH值调至7.5,加入4%的胰蛋白酶在37 ℃下水浴2 h后,煮沸10 min终止消化,冷却至室温后离心(10 000 g,10 min),收集上清液,测定其DPPH·自由基清除活性、Fe2+-螯合金属离子能力。
1.4 数据处理
每组试验均重复3 次,结果表示为平均值±标准偏差。利用SPSS17.0 统计软件进行方差分析,显著性水平为P<0.05。
2 结果与讨论
2.1 温度对抗氧化肽稳定性的影响
温度对菜籽抗氧化肽(WDHHAPQLR)活性变化的影响如图1所示,在20~60 ℃时,DPPH·自由基清除活性和Fe2+-螯合金属离子能力的保持率先上升后下降,但是变化幅度不大,活性保持在较为稳定的状态;在60~80 ℃时,活性保持率急剧下降,在温度达到100 ℃时,Fe2+-螯合金属离子能力活性保持率仅在30%左右。只有一些分子质量大于等于50 ku的蛋白质可以形成四级结构,所以分子质量较小的一些短肽不具备三级和四级结构[12],但是这些短肽仍然可以形成二级结构,这也是抗氧化肽具有活性的重要影响因素。处理温度过高、时间过长可能会使抗氧化肽的二级结构发生变化,导致活性大幅度下降。
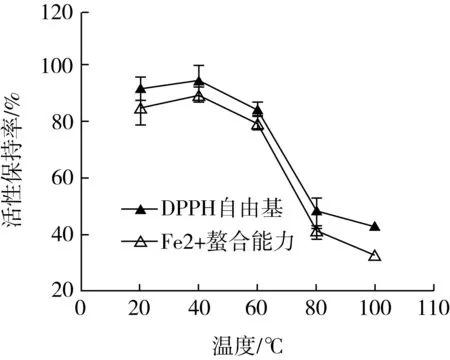
图1 温度对菜籽抗氧化肽(WDHHAPQLR)活性的影响
2.2 pH对抗氧化肽稳定性的影响
pH对菜籽抗氧化肽(WDHHAPQLR)活性变化的影响如图2所示,抗氧化肽在中性环境(pH为6~8)时,具有较高的DPPH·自由基清除活性和Fe2+-螯合金属离子能力保持率。在酸性和碱性环境中都会使得抗氧化肽的活性大幅度降低,从下降的趋势中可以看出碱性环境的影响更为明显。一般来说,每一个多肽都有其最适的酸碱范围,在此范围内抗氧化肽的活性和结构可以保持相对稳定[13],这表明该抗氧化在应用时应避免过酸或过碱的环境。
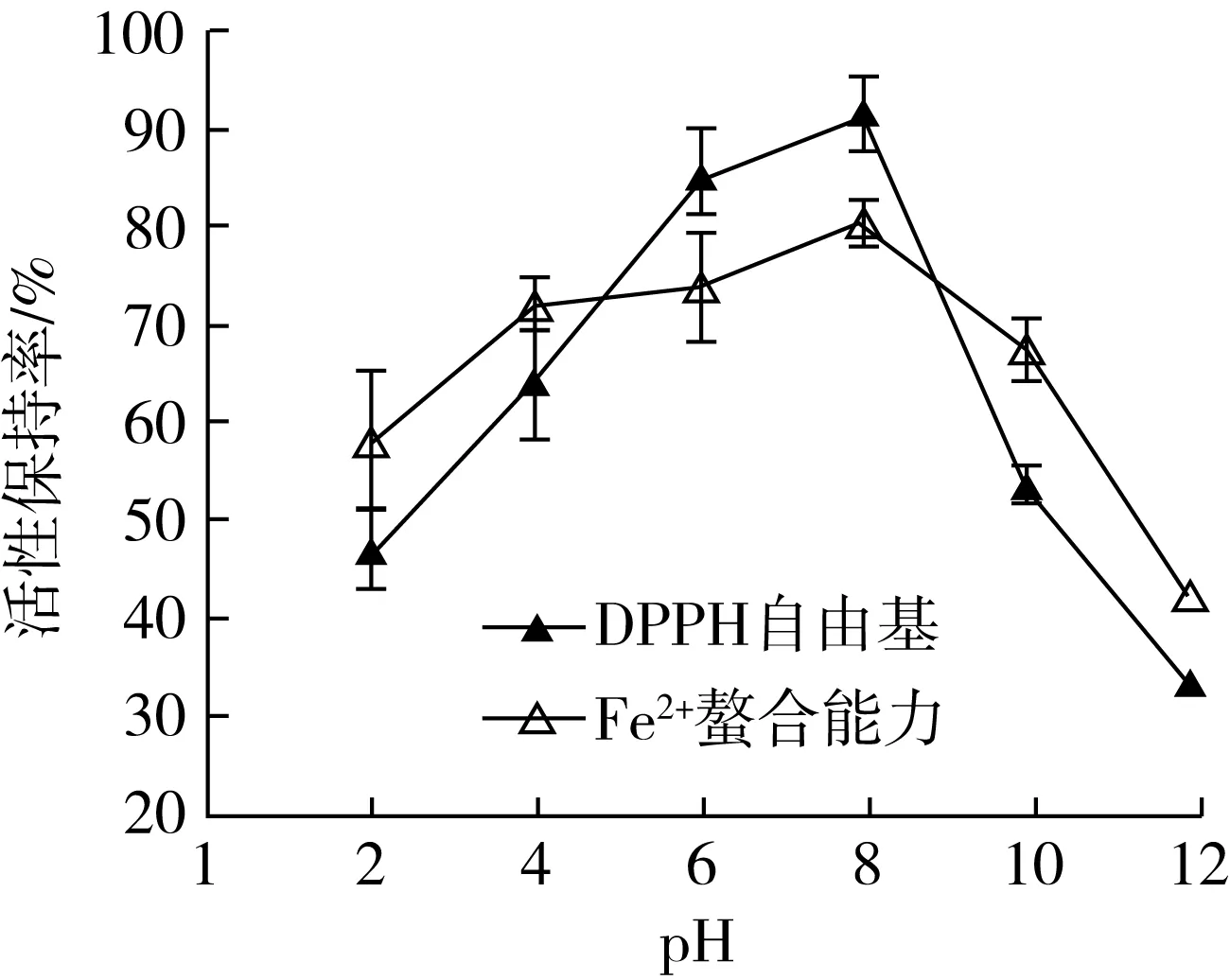
图2 pH值对菜籽抗氧化肽(WDHHAPQLR)活性的影响
2.3 食品配料成分对抗氧化肽稳定性的影响
NaCl、蔗糖和柠檬酸对菜籽抗氧化肽(WDHHAPQLR)活性变化的影响如表1所示。从表1中可以看出,在NaCl质量分数在1%~6%范围内时,DPPH自由基清除活性保持率先上升后下降,但是变化幅度较小,在NaCl质量分数达到6%时,活性保持率较高为93.89%,在NaCl质量分数达到8%时,活性明显下降,保持率为86.33%;在实验浓度范围内,NaCl含量对Fe2+-螯合能力影响不明显,活性保持率均在90%以上;因此,可以推断在NaCl质量分数低于6%时,对菜籽抗氧化肽的稳定性无显著影响。原因可能是中性盐NaCl在水溶液中电离的Na+和Cl-能中和菜籽肽表面的大量电荷,破坏水化膜从而影响其抗氧化活性[14-16]。在蔗糖质量分数在2%~10%范围内时,菜籽抗氧化肽的DPPH自由基清除活性随着质量分数的增加而大幅度下降,在蔗糖的质量分数达到10%时,活性保持率仅为70.27%;而蔗糖质量分数在2%~8%范围内时,Fe2+-螯合能力的也随着质量分数的增加而显著下降,但是当质量分数在8%~10%时,活性保持率则趋于稳定。原因可能是蔗糖不属于还原性糖,而且常温条件下蔗糖也无法水解。因此,蔗糖与菜籽肽无法发生美拉德反应而使肽的结构发生改变,因而对抗氧化活性没有明显影响[17-19]。在柠檬酸质量分数在0.02%~0.16%范围内时,对DPPH自由基清除活性和Fe2+-螯合能力的影响均不明显,其活性保持率始终在90%以上。
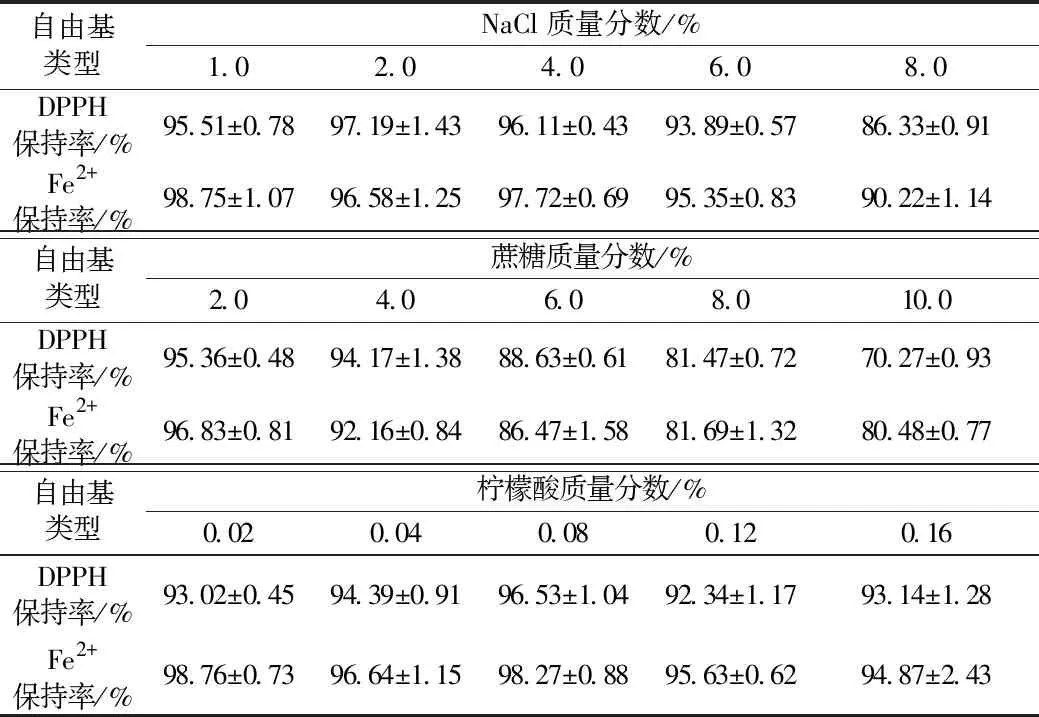
表1 食品配料对菜籽抗氧化肽(WDHHAPQLR)活性的影响
2.4 金属离子对抗氧化肽稳定性的影响
金属离子(K+、Ca2+、Mg2+、Zn2+和Cu2+)对菜籽抗氧化肽(WDHHAPQLR)活性变化的影响如图3所示,从图中可以看出不同金属离子对菜籽抗氧化肽的活性作用效果不同。其中,对DPPH自由基清除活性的的影响顺序为Zn2+>Cu2+>Ca2+>Mg2+>K+(图3a)。当金属离子浓度为250 μg/mL时,K+、Ca2+、Mg2+、Zn2+和Cu2+溶液的活性保持率分别为(83.91±1.70)%、(58.42±0.86)%、(80.68±2.35)%、(51.93±1.46)%和(55.17±1.62)%,表明金属离子会显著地降低菜籽抗氧化肽的DPPH自由基清除活性,同时发现K+和Mg2+对菜籽抗氧化肽活性的影响效果较小。同理,图(3b)中金属离子对Fe2+-螯合金属离子能力的影响顺序为Cu2+> Zn2+> Mg2+>Ca2+> K+。当金属离子浓度为250 μg/mL时,K+、Ca2+、Mg2+、Zn2+和Cu2+溶液的活性保持率分别为(85.37±0.86)%、(80.54±2.37)%、(63.44±1.67)%、(46.02±1.24)%和(41.72±0.74)%,表明Zn2+和Cu2+对菜籽抗氧化肽的Fe2+-螯合金属离子影响较大。因此,菜籽抗氧化肽的加工和保存过程中要减少与富含Zn2+和Cu2+的材料的接触。
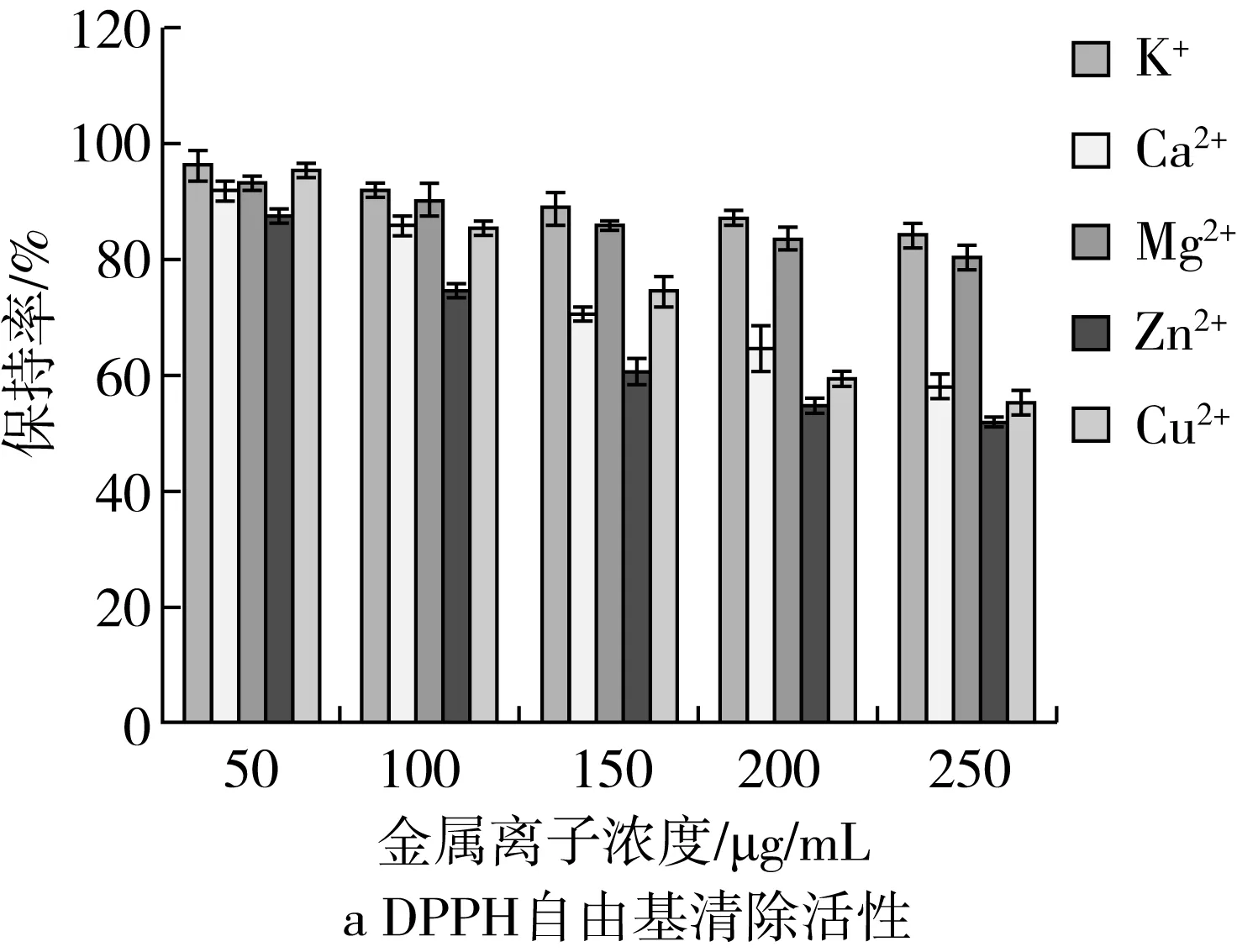
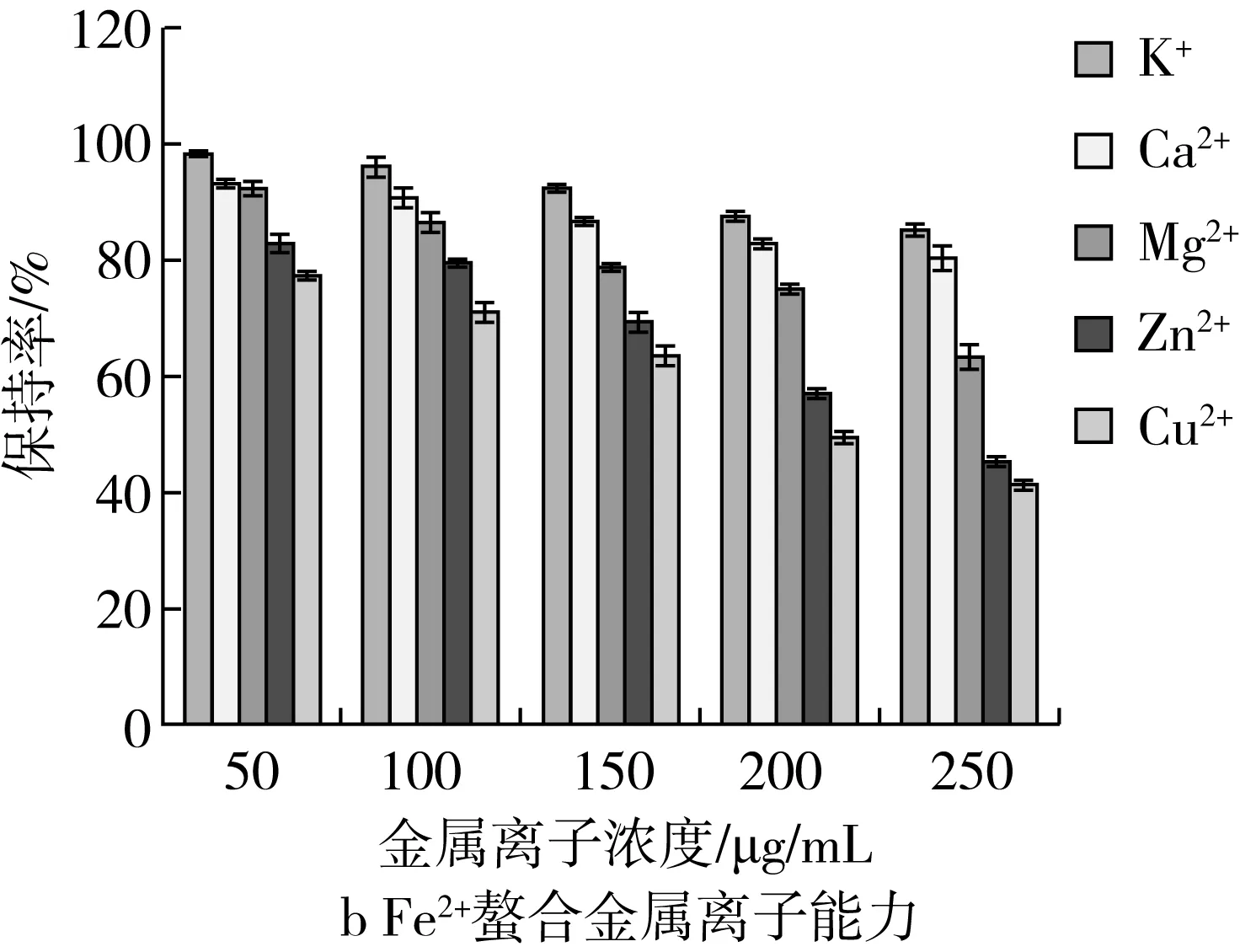
图3 金属离子对菜籽抗氧化肽(WDHHAPQLR)活性的影响
2.5 防腐剂对抗氧化肽稳定性的影响
苯甲酸钠和山梨酸钾是食品中常用的防腐剂,其对菜籽抗氧化肽(WDHHAPQLR)活性变化的影响如图4、5所示。在我国食品添加剂使用标准规定的使用量范围内,苯甲酸钠和山梨酸钾对菜籽抗氧化肽(WDHHAPQLR)的活性保持率影响作用均不明显;当防腐剂的质量分数达到0.16%时,活性保持率在90%以上,这说明菜籽抗氧化肽(WDHHAPQLR)活性对苯甲酸钠和山梨酸钾稳定,在该产品生产中可用作防腐剂。
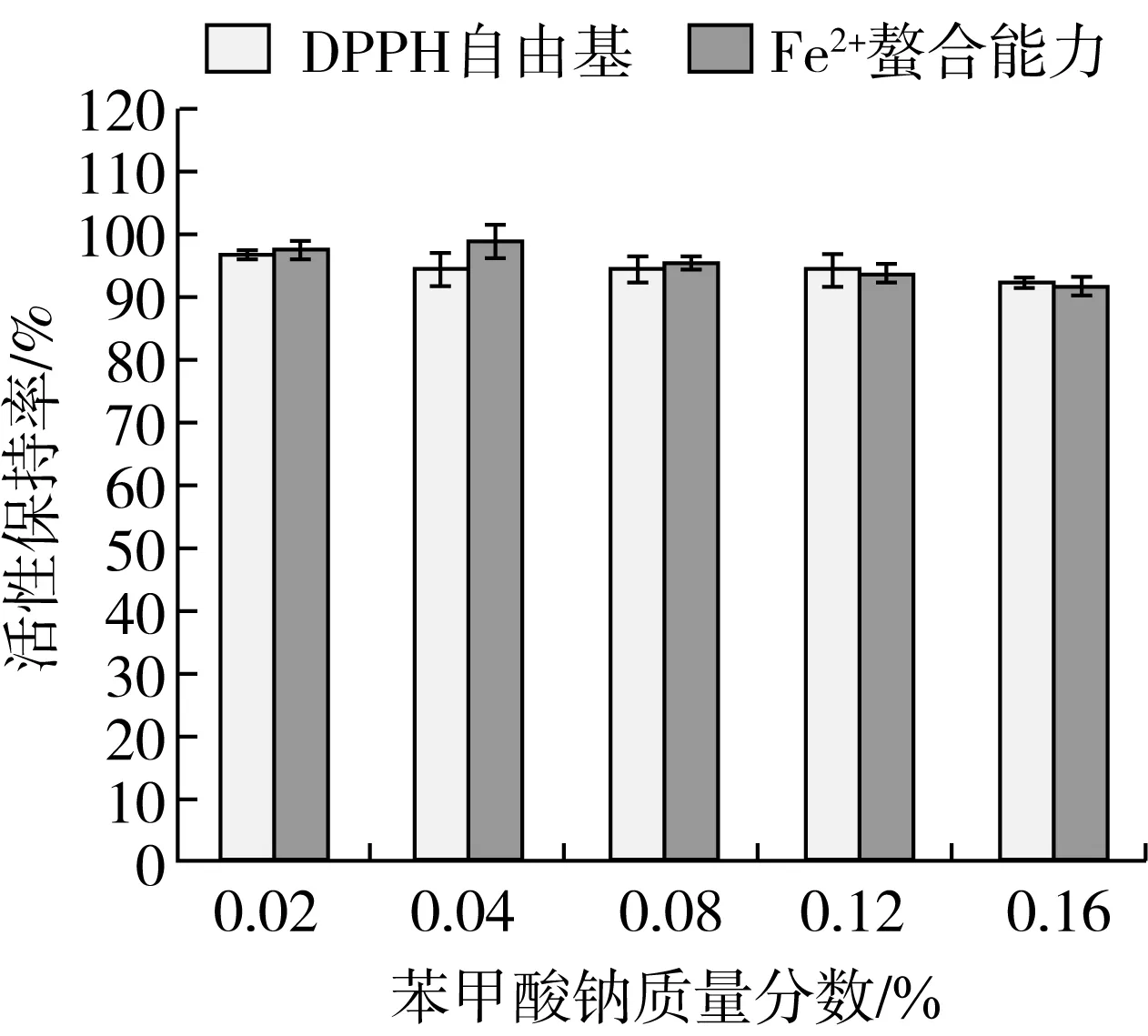
图4 苯甲酸钠对菜籽抗氧化肽(WDHHAPQLR)活性的影响
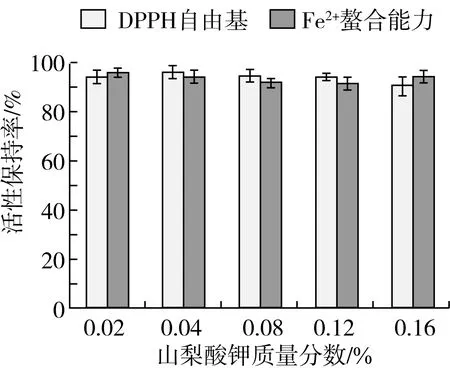
图5 山梨酸钾对菜籽抗氧化肽(WDHHAPQLR)活性的影响
2.6 胃-肠道蛋白酶对菜籽抗氧化肽稳定性的影响
胃蛋白酶、胰蛋白酶对菜籽抗氧化肽(WDHHAPQLR)活性变化的影响如表2所示,在经过2 h的胃蛋白酶消化后,抗氧化肽液的活性明显增强,这可能是因为胃蛋白酶将肽段水解成小片段,使得肽段的一些内部基团暴露出来,例如一些疏水性基团,而疏水性基团可以显著的增强抗氧化肽和不饱和脂肪酸之间的反应,提高抗氧化肽的活性[19-20]。然而,在使用胰蛋白酶进一步水解后,抗氧化肽液的活性明显下降。由于抗氧化肽的结构较为复杂,目前还无法确定在水解过程中有哪些结构被改变,因此还需要后续实验进一步的探究。

表2 胃肠道蛋白酶对菜籽抗氧化肽(WDHHAPQLR)活性的影响
3 结论
以DPPH·自由基清除活性、Fe2+-螯合金属离子能力为指标来考察温度、酸碱度、食品配料成分、金属离子、防腐剂和人工胃肠液等环境因素对菜籽抗氧化肽(WDHHAPQLR)稳定性的影响。结果表明:随着温度的升高,抗氧化肽的活性逐渐降低,但还是保持在较高水平,但是当温度高于60 ℃时,菜籽抗氧化肽的活性显著降低,温度为100 ℃时,Fe2+-螯合金属离子能力活性保持率仅在30%左右。强酸和强碱环境对抗氧化肽的稳定性影响较大,当溶液的pH在6.0~8.0范围内时,活性较为稳定。抗氧化肽溶液的活性随着食盐浓度的增大而有所降低,当食盐的浓度达到8%时,抗氧化肽的活性保持率为86.33%。蔗糖质量分数在2%~8%范围内时,菜籽抗氧化肽的活性随蔗糖含量的增加而显著下降,在蔗糖质量分数达到8%,活性保持率在80%以上。在0.02%~0.16%范围内,柠檬酸对菜籽抗氧化肽的活性影响不大,其活性保持率均在90%以上。常见的金属离子对菜籽抗氧化肽的稳定性影响不一,Cu2+和Zn+对菜籽抗氧化肽的DPPH·自由基清除活性和亚铁离子螯合能力的影响最为显著。苯甲酸钠和山梨酸钾对抗氧化肽的稳定性影响不明显,可以在多肽产品中作为防腐剂使用;菜籽抗氧化肽溶液经过胃蛋白酶消化后抗氧化活性显著增加,再经过胰蛋白酶消化后活性大幅度下降。然而由于抗氧化肽的结构较为复杂,目前还无法确定在水解过程中有哪些结构被改变,因此还需要后续实验从模拟消化、小肠上皮细胞转运等方面进一步的探究。

