青岛地区HBV DNA阳性献血者的血清学和分子生物学特征
马维娟 杨忠思 冯秋霞 王云
[摘要]目的调查青岛地区HBV DNA阳性献血者病毒载量和血清学特征,并分析其HBV基因型。方法无偿献血样本HBsAg-/HBV-DNA+32例,HBsAg+/HBV-DNA+7例,行高精度病毒载量检测和补充血清学试验,并通过S区扩增测序结合多对型特异性引物巢式PCR法分析HBV基因型。结果32例HBsAg-/HBV-DNA+样本中,HBcAb+30例(93.75%),HBV DNA定量阴性17例,定量阳性15例;测序分型确定基因型4例为B型,其中1例發现两处突变,分别为126位苏氨酸/异亮氨酸(T/I)突变为丙氨酸(A)、175位亮氨酸(L)突变为丝氨酸(S)。7例HBsAg+/HBV-DNA+样本HBV DNA均定量阳性,确定基因型2例为B型,3例为C型。结论大部分HBsAg-/HBV-DNA+献血者的HBcAb为阳性,HBV DNA呈低浓度,感染的HBV主要基因型为B型和C型。
[关键词]供血者;乙型肝炎病毒;血清学试验;遗传学
[中图分类号]R446.6[文献标志码]A[文章编号]2096-5532(2019)03-0338-05
[ABSTRACT]ObjectiveTo investigate the viral load, serological characteristics, and hepatitis B virus (HBV) genotype of HBV DNA-positive donors in Qingdao, China. MethodsA total of 32 HBsAg-/HBV-DNA+ blood samples and 7 HBsAg+/HBV-DNA+ samples were selected. High-precision viral load measurement and supplementary serological test were performed, and S-region sequencing combined with specific-primer nested PCR was used to analyze HBV genotype. ResultsAmong the 32 HBsAg-/HBV-DNA+ samples, 30 (93.75%) were HBcAb+; 15 had negative HBV DNA, and 17 had positive HBV DNA; sequencing and genotyping showed that 4 samples had genotype B, among which 1 was found to have two mutations, i.e., 126 threonine/isoleucine (T/I) to alanine (A) and 175 leucine (L) to serine (S). All 7 HBsAg+/HBV-DNA+ samples were positive for HBV DNA, among which 2 had genotype B and 3 had genotype C. ConclusionMost of the HBsAg-/HBV-DNA+ donors are positive for HBcAb, with a low concentration of HBV DNA, and genotypes B and C are the main genotypes for HBV infection.
[KEY WORDS]blood donors; hepatitis B virus; serologic tests; genetics
HBV是经输血传播疾病的病原体,乙肝表面抗原(HBsAg)是WHO认定的判断HBV感染的关键指标[1-2]。目前,我国采供血机构主要采用酶联免疫吸附试验(ELISA)和核酸扩增技术(NAT)方法对献血者血液进行检测,但由于HBV的复制特点以及疫苗和抗病毒治疗的广泛应用导致HBsAg突变率高,献血者血液HBsAg检测阴性却存在低水平HBV DNA[3]。我国部分地区流行的HBV基因型主要为C型和B型,其次为D、E和A型[4-5]。但青岛地区无偿献血者的HBV基因型分布未见报道。本文研究旨在了解青岛地区HBsAg-/HBV-DNA+献血者的病毒载量和血清学状况,调查本地区HBV基因型和S基因突变情况,以期为青岛地区HBV的认知和防控提供地域性的指导性意见。
1材料与方法
1.1血液样本
根据青岛市中心血站常规血液筛查模式,共筛选出无偿献血样本39例纳入实验,样本血清量均为3 mL以上,无明显溶血和脂血。其中HBsAg-/HBV-DNA+样本32例,HBsAg+/HBV-DNA+样本7例。
1.2主要仪器
盖立复Procleix TIGRIS核酸检测系统(西班牙盖立复公司);Roche COBAS S201AmpliPre全自动核酸提取系统,Gene-Amp PCR system 9700型(美国ABI公司生产),CTM核酸扩增检测系统,雅培Architect i2000SR化学发光分析仪,CG1-96型PCR仪(澳大利亚corbett公司),wide mini-sub cell GT电泳仪(美国Bio-Rad公司),Thermo LEGEND Micro 17型离心机,SORVALL Biofuge stratos 型离心机,ImageQuant350凝胶成像系统(美国GE公司生产)。
1.3主要试剂
AmpliPrep/COBAS TaqMan HBV定量检测试剂(第二代),雅培ARCHITECT HBsAg检测试剂盒,雅培ARCHITECT HBsAg确认试剂盒(中和实验),雅培ARCHITECT HBeAg检测试剂盒,雅培ARCHITECT anti-HBe检测试剂盒,雅培ARCHITECT anti-HBc检测试剂盒,DNA聚合酶:KOD FX(TOYOBO),2×Taq PCR Master Mix(含染料)预混体系(天根公司),Expand High Fidelity PCR System(Roche Applied Science),血清/血浆病毒DNA提取试剂盒为QIAamp DNA blood mini kit (Qiagen, Hilden, Germany)。
1.4研究方法
常规筛查采用2次ELISA、1次NAT的筛查模式,各试剂均经中国药品生物制品鉴定所鉴定批间合格并严格按照试剂盒说明书操作。对血清学任一试剂呈阳性反应的标本采用原试剂作双孔检验(原血样1孔,血袋小辫样1孔),复检1孔或2孔阳性者判为阳性。两个核酸检测平台中,罗氏Cobas S201核酸检测系统结果以CT值表示,Procleix Tigris核酸检测系统(Grifol)结果以S/CO表示。
1.4.1高精度病毒載量检测采用AmpliPrep/COBAS TaqMan HBV定量检测试剂进行HBV DNA病毒载量检测,每份标本取1 mL,使用COBAS AmpliPrep仪器进行自动样品制备,使用COBAS TaqMan分析仪进行自动扩增和检测。
1.4.2补充血清学试验采用雅培微粒子化学发光法进行HBsAg、乙肝表面抗体(HBsAb)、e抗原(HBeAg)、e抗体(HBeAb)、核心抗体(HBcAb)检测。采用HBV HBsAg确认试剂盒(中和法)进行HBsAg确认检测。
1.4.3HBV病毒DNA的提取应用QIAamp DNA blood mini kit进行DNA提取,提取的样本量为200 μL,采用微量核酸含量测定仪测定DNA浓度,控制浓度为30~150 μg/L。
1.4.4PreS/S区基因的扩增根据HBV PreS/S基因区域内的保守序列设计半巢式PCR的引物S2812、S1194和B1051,引物由上海英俊公司合成。提取病毒核酸后PCR扩增PreS/S区,扩增时设置两个阴性对照以避免出现假阳性,结束后取5 μL产物,经30 g/L琼脂糖凝胶电泳,溴化乙锭染色,应用凝胶成像系统观察结果。
1.4.5PCR扩增产物纯化及测序将PCR扩增产物进行切胶纯化,应用第二轮扩增引物作为测序引物进行双向测序,用PreS/S区扩增产物来设计中间引物双向测通。将测序结果存在杂合的样本进行TA克隆,然后挑选单克隆进行测序。测序交由上海英俊公司使用ABI 3730 Genetic Analyzer测序仪(Applied Biosystems 公司)完成。测序结果用CLUSTAL_X(version 1.83)软件进行序列比对,分析PreS区是否存在片段缺失以及T31C和T53C突变;分析S区是否存在与免疫逃逸、HBsAg检测、anti-HBs和HBsAg结合能力改变相关的突变。
1.4.6HBV基因型和亚型系统发育分析分别应用MEGA 4(43)、Neighbor-joining计算法绘制进化树,最适合模型采用MrModeltest 2.2(Nylander 2004)进行似然比检验。在进化模型检验的同时,还考虑了参数I和G,其中I是假设的不变位点的比例;G是Gamma分布;G+I指检测数据集中有些位点是不变的,而可变位点的变异遵循Gamma分布速率模型。
2结果
2.1HBV DNA高精度病毒定量检测
HBV DNA病毒载量检测结果显示,本文32例HBsAg-/HBV-DNA+样本中,17例样本为阴性,15例定量阳性,其中8例样本HBV DNA<20 kU/L,7例>20 kU/L;7例HBsAg+/HBV-DNA+样本均定量阳性,1例样本HBV DNA<20 kU/L,6例>20 kU/L。
2.2乙肝补充血清学试验
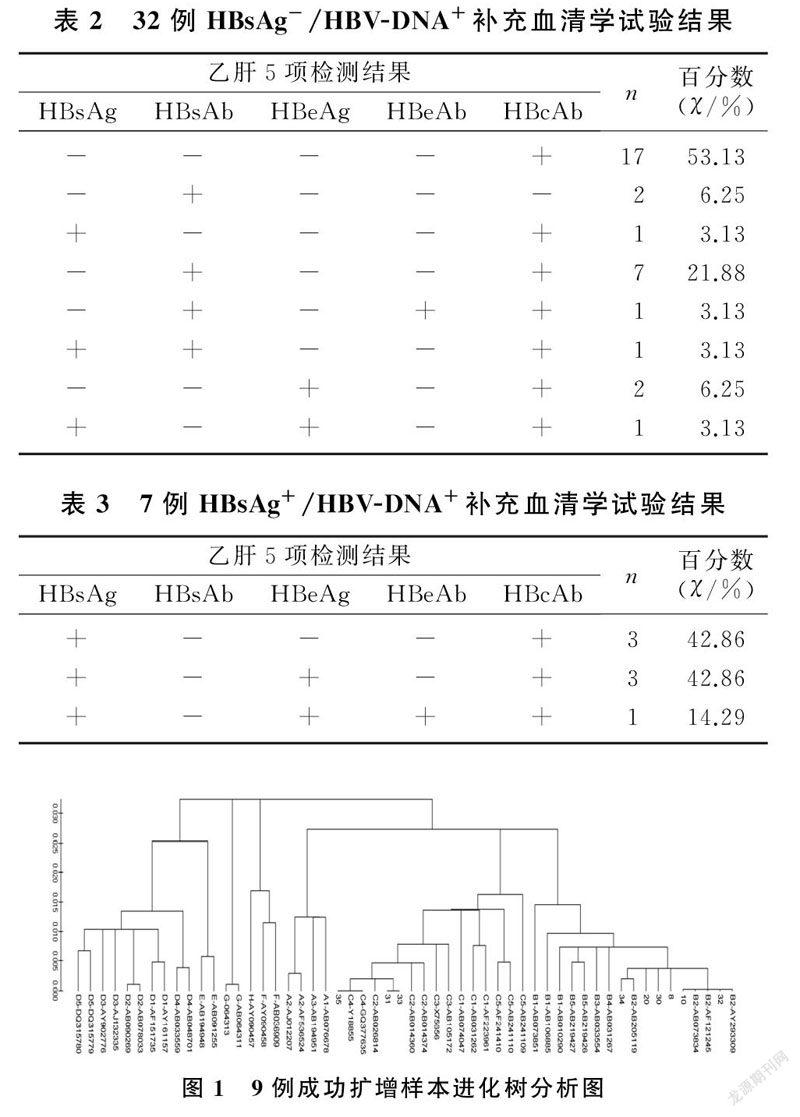
本文32例HBsAg-/HBV-DNA+样本血清学检测结果显示,HBcAb+30例(93.75%),其中单独HBcAb+ 者17例(53.13%),合并HBsAb+ 者7例(21.88%),HBsAg阳性者3例(9.38%);而在7例HBsAg+/HBV-DNA+样本中,HBsAg和HBcAb均阳性。见表2、3。
2.3HBV序列分析
经核酸提取和扩增,有9例样本成功扩增和测序,6例为B型,3例为C型,其中4例为HBsAg-/HBV-DNA+样本,经进化树分析均为B型,其中2例血清学指标全阴性,1例HBsAb、HBcAb阳性,1例HBeAb阳性;5例为HBsAg+/HBV-DNA+样本,经进化树分析2例B型,3例C型。其中1例HBsAg-/HBV-DNA+样本(8号)发现两处突变,126位苏氨酸/异亮氨酸(T/I)突变为丙氨酸(A),175位亮氨酸(L)突变为丝氨酸(S)。见表4、图1。
3讨论
NAT能显著缩短病毒检测的窗口期,提高病毒的检出率,降低输血传播病毒的残余危险度[6-10],2010年开始逐步应用于国内献血者血液标本的筛查,大大降低了经输血途径传播病毒的风险。本文采用罗氏核酸检测系统和Grifol严格筛查青岛市无偿献血者血液标本,32例被确证为HBsAg-/HBV-DNA+,DNA精确病毒载量检测显示17例定量阴性,15例定量阳性,其中8例HBV DNA<20 kU/L,7例>20 kU/L;而7例HBsAg+/HBV-DNA+样本均定量阳性。原因可能是:①定量检测标本经过低温冷冻保存,复融的方法和速度以及运输环节都可能影响病毒核酸的检出;②现用的血液筛查系统是定性检测系统,这与定量检测系统的引物设计及检测灵敏度不同,可能会导致检测结果不一致;③血浆中的病毒颗粒呈泊松分布,加样的随机性可能导致结果的不同;④病毒载量太低或者核酸检测假阳性[11]。本文结果显示,HBsAg-/HBV-DNA+样本的病毒载量显著低于HBsAg+/HBV-DNA+样本,而HBsAg-/HBV-DNA+献血人员的HBV DNA均呈低浓度,大部分感染者的病毒载量均小于20 kU/L甚至检测不出。
本研究补充血清学试验显示,32例HBsAg-/HBV-DNA+样本中,HBsAg阳性3例(9.38%),说明现用ELISA试剂的灵敏度有待提高,或HBsAg区域的基因突变导致HBsAg的漏检。除此之外,本文32例HBsAg-/HBV-DNA+样本中,HBcAb+占93.75%,这部分献血者处于感染窗口期或属于隐匿性HBV感染,7例(21.88%)献血者仅表现为HBsAb+,此类献血者可能之前注射过疫苗但仍被病毒感染[12]。
根据HBV全基因组序列差异≥8%或S基因序列差异≥4%将HBV分为不同的基因型[13],目前至少可以分为A~J等10种基因型,不同基因型的病毒复制以及逃逸宿主免疫力的能力不同,感染途径和疾病进程也有所差异,从而导致不同地区HBV感染率和基因型分布的差异,基因型分布呈一定的地域性[5,14]。我国的HBV基因型主要是B型和C型,另外有少量的A型、D型及I型。本研究39例样本中,有9例成功进行了测序分型,包括5例血清學阳性的标本(2例B型,3例C型)和4例HBV DNA单独阳性的标本(4例B型)。4例HBV DNA单独阳性的标本中,有3例HBcAb阳性,因此判定属于隐匿性HBV感染(OBI),剩下的1例样本为HBcAb阴性,但抗HBs为阳性,也属于OBI的定义。杨爱莲等[15]研究发现,10例OBI和3例窗口期全部属于B型;叶贤林等[16]报道OBI感染者也以B型为主。林红等[17]进行的研究发现,江苏地区HBsAg-/HBV-DNA+献血者的基因型以B型为主,其次是C型;而在乙肝血清学阳性的样本中则B型、C型都有,是否提示B亚型的病毒更容易导致OBI?这可能还需要更大的样本量来进行验证。国外有研究表明,不同基因型HBV感染后病人的临
HBV S基因主要编码HBsAg,包括T细胞和B细胞表位,是诱导机体产生中和抗体的蛋白基因。HBsAg的第124~147位氨基酸被称为a决定簇,是最常见的变异发生部位,其诱导产生的HBsAb均可结合HBsAg并具有中和作用,是一种保护性抗体,其变异会使HBsAg的构型改变,导致病毒抗原性和免疫原性改变[21],接种疫苗后不会产生保护性抗体[22];同时,变异株也会造成常规检测方法的漏检。本文39例血样本经核酸提取和扩增,有9例成功扩增和测序,其中1例样本126位T/I突变为A,175位L突变为S。编码S基因的126位氨基酸突变可导致HBsAg的a决定簇发生改变,因此改变了抗原结构而造成HBV的漏检,此突变与乙肝疫苗逃逸相关,说明该献血者接种过乙肝疫苗,但由于感染的这个突变株病毒具有可以逃避疫苗的保护作用的突变,因此导致其仍然感染了HBV,而175位氨基酸突变的意义目前还不明确。KOYANAGI等[23]研究发现,氨基酸第129位天门冬氨酸和第145位丙氨酸的置换可以导致HBsAg检测阴性,而X基因的突变可以对HBsAg的表达产生影响[24],如果HBVa的决定簇及近邻的位点发生变异,也会减弱抗体识别,从而导致常规试剂检测阴性[25]。
虽然本文两种方法的互补应用大大降低了输血者感染HBV的风险,但由于部分HBV感染者的DNA水平非常低[26-29],对现用核酸检测系统的灵敏度提出了较高的要求,对输血安全提出了挑战[30]。日常检测工作中,要加强检测方法结果间的比较,对结果特殊的献血者做进一步的追踪随访。青岛地区HBV感染以B和C型为主,但由于样本量较小,今后要扩大研究范围,对青岛地区无偿献血者的HBV感染情况做更详尽的调查研究。
[参考文献]
[1]张苏晗,杨秀惠,陈致飞,等. 福建省2013年乙型肝炎病毒高流行区育龄期妇女感染状况[J]. 中国热带医学, 2017,17(1):59-63.
[2]黄梅,文秀琼,曹汝安,等. 绵阳地区无偿献血者中HBsAg真实流行情况调查:献血前快检以及献血后筛查确证试验结果联合分析[J]. 中国输血杂志, 2017,30(5):451-453.
[3]ANVARI F A, ALAVIAN S M, NOROUZI M, et al. Prevalence and molecular analysis of occult hepatitis B virus infection isolated in a sample of cryptogenic cirrhosis patients in Iran[J]. Oman Medical Journal, 2014,29(2):92-96.
[4]ZENG G, WANG Z, WEN S, et al. Geographic distribution, virologic and clinical characteristics of hepatitis B virus genotypes in China[J]. Journal of Viral Hepatitis, 2005,12(6):609-617.
[5]刘鱼,王憬惺,曾沛斌,等. 中国部分地区献血者中乙型肝炎病毒的基因型和亚型分布特征[J]. 中国输血杂志, 2013,26(11):1061-1067.
[6]黄小珍,曾宾,刘佳霖. 核酸检测技术在无偿献血者血液筛查中的应用[J]. 海南医学, 2018,29(10):1465-1467.
[7]王志宏,余东娟. 血清学与核酸检测对献血者血液筛查结果的对比分析[J]. 广西医科大学学报, 2017,34(3):452-454.
[8]吴洪明. 核酸检测技术在基层血站血液筛查中的应用[J]. 医学理论与实践, 2018,31(1):111-112.
[9]程卫芳,张浩,周学勇,等. 核酸检测在合肥地区献血者血液筛查中的应用[J]. 临床输血与检验, 2016,18(5):471-474.
[10]冯秋霞,张龙穆,潘海平,等. 青岛地区63 846份无偿献血者血液标本筛查结果分析[J]. 中国输血杂志, 2014,27(7):733-735.
[11]张妍,朱海峰,孙波,等. 核酸检测技术在血液筛查中的应用及分析[J]. 中国输血杂志, 2012,25(12):1298-1300.
[12]何水珍,苏成豪,沈理通,等. 厦门市自然人群中乙型肝炎病毒隐匿性感染状况调査[J]. 中华预防医学杂志, 2015,49(2):132-136.
[13]董菲,王憬惺,杨通汉,等. 昆明、洛阳两地献血者人群HBV携带者的HBV基因型分布[J]. 中国输血杂志, 2009,22(7):552-555.
[14]PALUMBO E. Hepatitis B genotypes and response to antiviral therapy:a review[J]. American Journal of Therapeutics, 2007,14(3):306-309.
[15]杨爱莲,曾劲峰,邬旭群,等. 献血者HBV DNA存在的确认与S蛋白变异特征分析[J]. 中国输血杂志, 2015,28(4):379-383.
[16]叶贤林,李彤,孙淑君,等. 核心抗体阳性合格献血者隐匿性乙肝病毒感染分子生物学特性及追踪结果的研究[J]. 中国输血杂志, 2016,29(9):890-894.
[17]林红,蒋昵真,汤心怡,等. 江苏地区HBsAg-/HBV-DNA+献血者血清学和分子生物学特点分析[J]. 中国输血杂志, 2016,29(3):264-268.
[18]LI X D, WANG L, LIU Y, et al. Characterization of hepatitis B virus genotypes/subgenotypes in 1301 patients with chronic hepatitis B in North China[J]. Chinese Medical Journal, 2011,124(24):4178-4183.
[19]SCOTTO G, FAZIO V. Hepatitis B genotypes and response to adefovir treatment in patients with HBV chronic infection[J]. Journal of Infection, 2010,60(5):399-401.
[20]KAO J H, CHEN P J, LAI M Y, et al. Hepatitis B genotypes correlate with clinical outcomes in patients with chronic hepatitis B[J]. Gastroenterology, 2000,118(3):554-559.
[21]ZHU Huilan, LI Xu, LI Jun, et al. Genetic variation of occult hepatitis B virus infection[J]. World Journal of Gastroentero-logy, 2016,22(13):3531-3546.
[22]WU Chunchen, ZHANG Xiaoyong, TIAN Yongjun, et al. Biological significance of amino acid substitutions in hepatitis B surface antigen (HBsAg) for glycosylation, secretion, antigenicity and immunogenicity of HBsAg and hepatitis B virus replication[J]. The Journal of General Virology, 2010,91(Pt 2):483-492.
[23]KOYANAGI T, NAKAMUTA M, SAKAI H, et al. Analysis of HBs antigen negative variant of hepatitis B virus:unique substitutions. Glu129 to Aap and Gly145 to Ala in the surface antigen gene[J]. Med Ser Monit, 2000,6(6):1165-1169.
[24]TAKAGUCHI K, SATOU A, ANDO M, et al. Detection of hepatitis B virus DNA in the liver and serum of patients with hepatitis B surface antigen and hepatitis C virus negative chronic liver disease[J]. Hepatology Research, 2002,22(2):139-144.
[25]HOU Jinlin, WANG Zhanghui, CHENG Jinjun, et al. Prevalence of naturally occurring surface gene variants of hepatitis B virus in nonimmunized surface antigen-negative Chinese car-riers[J]. Hepatology (Baltimore, Md.), 2001,34(5):1027-1034.
[26]張涛,廖红梅,张春红,等. 重庆地区无偿献血人群隐匿性乙型肝炎病毒感染的特征[J]. 传染病信息, 2017,30(1):44-47.
[27]姚凤兰,汪德海,査祎,等. 核酸检测单反应性无偿献血者HBV感染状态分析[J]. 国际检验医学杂志, 2017,38(11):1513-1516,1519.
[28]李仲平,王淏,郑优荣,等. 广州地区HBsAg阴性无偿献血血液输血传播HBV残余风险评估[J]. 广东医学, 2014,35(3):442-445.
[29]KHAKOO S I, LING R, SCOTT I, et al. Cytotoxic T lymphocyte responses and CTL epitope escape mutation in HBsAg, anti-HBe positive individuals[J]. Gut, 2000,47(1):137-143.
[30]涂东晋,郭永建,赵亮. 隐匿型乙型肝炎病毒感染对输血安全的挑战及其应对策略[J]. 中国输血杂志, 2009,22(12):1031-1036.
(本文编辑 黄建乡)

