吹扫捕集-气相色谱-质谱法测定土壤中挥发酚的方法研究
刘娇 吴淑琪 贾静 佟玲


摘要: 文章研究了吹扫捕集-气相色谱-质谱法测定土壤中挥发酚的方法,分析了吹扫捕集各参数对挥发酚测定的影响,优化了吹扫捕集条件和气相色谱-质谱条件。通过与索氏提取技术对比,证明吹扫捕集-气相色谱-质谱法在实际样品检测中具有操作简便、分析周期短、试剂用量少、干扰小等优点,适用于测定沸点较低、溶解度较小的挥发酚,推荐选择经典的索氏提取技术测定沸点较高、溶解度较大的挥发酚。
关键词: 吹扫捕集;气相色谱-质谱;挥发酚;土壤
中图分类号:X131.3 文献标识码:A 文章编号:2096-1871(2019)04-309-08
挥发酚指沸点在230 ℃以下的酚类化合物,具有致畸、致癌、致突变的生物毒性,已被多个国家列为优先控制污染物。目前,常用的挥发酚检测方法有气相色谱法[1-2]、液相色谱法[3-4]和气相色谱质谱法[5-9]等,其中气相色谱质谱可提供化合物质谱信息,避免出現靠保留时间定性的假阳性结果,在选择性和准确度方面具有一定优势。在土壤样品前处理中,常用的索氏提取[10]、超声提取[11-12]、微波萃取[13]和加速溶剂提取[14]等离线分离技术,步骤繁琐,耗时长,溶剂消耗量大,且长期与有毒有机溶剂接触,对人体健康和生态环境造成的危害较大。此外,在多步骤离线分离过程中,不仅会引入新的杂质,干扰检测,且极易造成被测组分损失,降低准确度。为了更加准确和全面地了解土壤样品中痕量挥发酚的污染状况,需建立一种快速、灵敏、准确、无污染的在线分析方法。吹扫捕集[15-17]作为一种自动化、全封闭的在线分离技术,快速简单,无污染,更适合测定挥发性化合物。近年来,吹扫捕集主要用于检测土壤中的苯系物、烷烃类和卤代烃类等化合物[18-19],对挥发酚在线分离测定技术研究较少。土壤样品基质复杂,挥发酚残留溶度低、挥发性强、易受干扰,因此,吹扫捕集-气相色谱-质谱测定土壤中的挥发酚具有一定的应用前景。
本文利用吹扫捕集在线分离技术,根据挥发酚亲水性和挥发性强等特点,系统分析了吹扫捕集各参数对目标化合物测定的影响,优化了分析条件;结合气相色谱质谱定性和定量方面的优点,建立了吹扫捕集-气相色谱-质谱法测定土壤中挥发酚(含苯酚、硝基酚类、甲酚类和氯酚类等优先控制污染物)的分析方法。此外,分别利用吹扫捕集技术与索氏提取技术对实际样品进行对比检测,证实吹扫捕集技术在自动化程度、分析效率、实验成本和绿色环保等方面具有优势,而索氏提取技术可弥补吹扫捕集在测定实际土壤中部分挥发酚的不足。该方法研究可为探索土壤挥发酚检测方法提供借鉴。
1 实验部分
1.1 仪器与试剂
QP2010气相色谱质谱联用仪(日本岛津公司);DM-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm),VF-1701毛细管色谱柱(30 m×0.25 mm×0.25 μm),DB-FFAP毛细管色谱柱(30 m×0.32 mm×0.50 μm);吹扫捕集浓缩仪及自动进样装置(美国O.I公司);VOCARB 3000捕集阱,TENAX/硅胶/碳分子筛捕集阱;搅拌磁转子;恒温水浴氮吹仪;旋转蒸发仪;索氏提取装置。
挥发酚标准溶液(苯酚、2-氯苯酚、2-甲基苯酚、4-甲基苯酚、3-甲基苯酚、2-硝基苯酚、2,4-二甲基苯酚、2,4-二氯苯酚、4-氯苯酚、3-硝基苯酚,浓度为 5 000 mg/L,2-氟苯酚和2,4,6-三溴苯酚替代物,浓度为 2 000 mg/L,以上试剂均为单标,溶剂为甲醇,美国AccuStandard公司);试剂水(在通入高纯氮气条件下将纯净水煮沸15 min冷却至室温);甲醇、二氯甲烷、乙酸乙酯、正己烷(均为色谱级)。
无水Na2SO4(分析纯,在400 ℃马弗炉中烘烤5 h后置于干燥器中冷却至室温);NaCl(分析纯,在600 ℃马弗炉中烘烤5 h后置于干燥器中冷却至室温);石英砂(用甲醇索氏提取10 h后置于400 ℃的马弗炉中烘烤5 h,转至干燥器中冷却至室温);浓H2SO4(色谱级);HCl溶液(用二次蒸馏水将浓HCl稀释至3 mol/L);NaOH溶液(称取一定量固体NaOH于二次蒸馏水中,溶解并稀释至5 mol/L)。
1.2 仪器条件
(1)吹扫捕集条件。捕集阱为VOCARB 3 000,吹扫气流量40 mL/min,吹扫温度55 ℃,预热时间0.8 min,吹扫时间25 min,室温下捕集;解吸温度230 ℃,解吸时间10 min;烘焙温度240 ℃,烘焙时间15 min。
(2)气相色谱条件。进样口温度250 ℃;程序升温为初始温度40 ℃,以8 ℃/min升至100 ℃,保持1 min,以8 ℃/min升至130 ℃,再以12 ℃/min升至210 ℃,保持3 min;载气为高纯He(99.999%),恒压模式;流速为1.5 mL/min,分流比为10∶1。
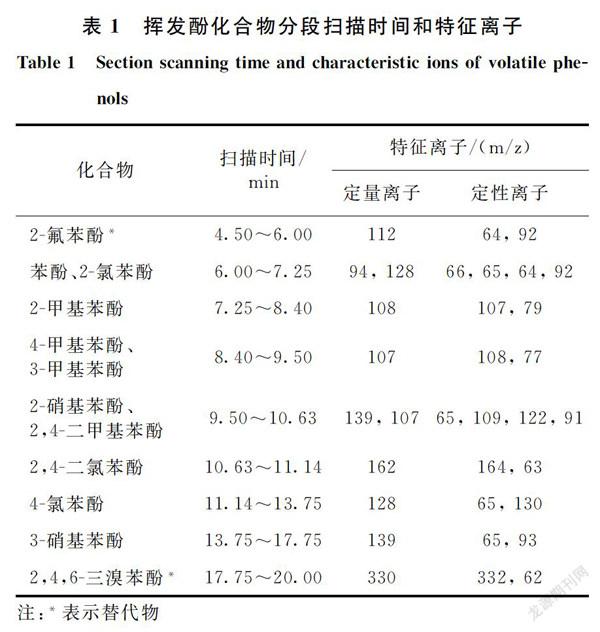
(3)质谱条件。电子轰击离子源(EI),电子轰击能量70 eV;离子源温度210 ℃;接口温度210 ℃;溶剂切除时间2.5 min;SIM扫描模式,扫描时间段和特征离子见表1。
1.3 实验方法
1.3.1 标准样品制备
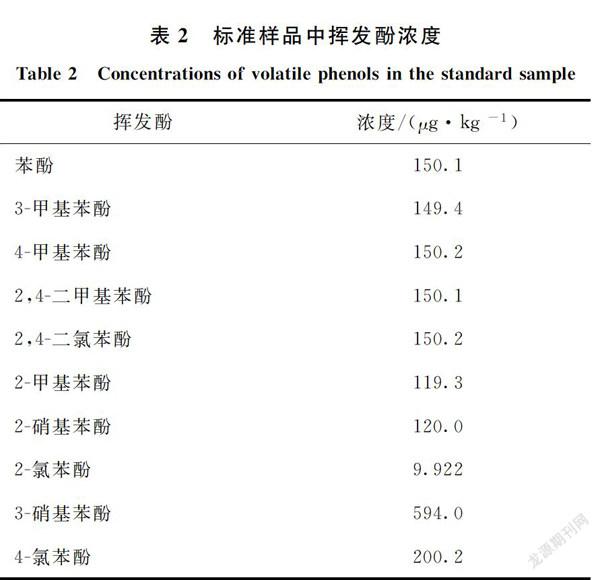
准确称取石英砂基质土5.00 g置于40 mL样品瓶,依次加入5 mL试剂水、1.75 g NaCl、10 μL浓H2SO4,放入磁转子,再加入挥发酚标准溶液,密封静置1 h,上机待测。标准样品中挥发酚浓度见表2。
1.3.2 样品制备
将采自某工厂的土壤样品于阴凉处自然晾干,研磨后过100目筛。准确称取土壤样品5.00 g于40 mL样品瓶中,依次加入5 mL试剂水、1.75 g NaCl、10 μL浓硫酸和磁转子,平行制备两份,将样品密封静置1 h,上机待测。
2 结果与讨论
2.1 气相色谱-质谱条件优化
选择苯酚、2-氯苯酚、2-甲基苯酚、4-甲基苯酚、3-甲基苯酚、2-硝基苯酚、2,4-二甲基苯酚、2,4-二氯苯酚、4-氯苯酚和3-硝基苯酚作为初始目标化合物,涵盖我国环境优先控制的全部挥发酚(苯酚、3-甲基苯酚、2,4-二氯苯酚)和美国环保署(EPA)优先控制的5种挥发酚(苯酚、2-氯苯酚、2,4-二氯苯酚、2-硝基苯酚、2,4-二甲基苯酚)。由于挥发酚分子具有一定极性,因此对不同极性的色谱柱(极性柱DB-FFAP、中等极性柱VF-1701、非极性柱DM-5MS)进行筛选。极性柱受使用温度限制,即使在最高柱温下,3-硝基苯酚亦未出峰;中等极性柱在较高温度下可保证所有组分出峰,然而高温会增加柱流失,掩盖低浓度挥发酚的响应,降低检测灵敏度;非极性柱具有耐高温、低柱流失的特性,10种挥发酚在非极性柱上分离效果最好,因此最终选择DB-5MS非极性柱作为检测用色谱柱。
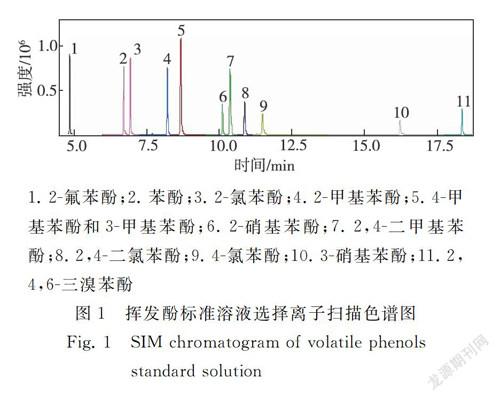
对进样口温度、程序升温、载气流速等气相色谱条件和离子源温度、特征离子选择等质谱条件进行了优化,确定进样口温度为250 ℃;程序升温为初始温度40 ℃,以8℃/min升至100 ℃,保持1 min,以8 ℃/min升至130 ℃,再以12 ℃/min升至210 ℃,保持3 min;载气流速为1.5 mL/min,分流比为10∶1;离子源温度为210 ℃,定量离子、定性离子及扫描时间见表1。在该条件下,挥发酚标准溶液色谱见图1,各组分色谱峰分布均匀,分离度好,满足分析要求。
2.2 捕集阱选择
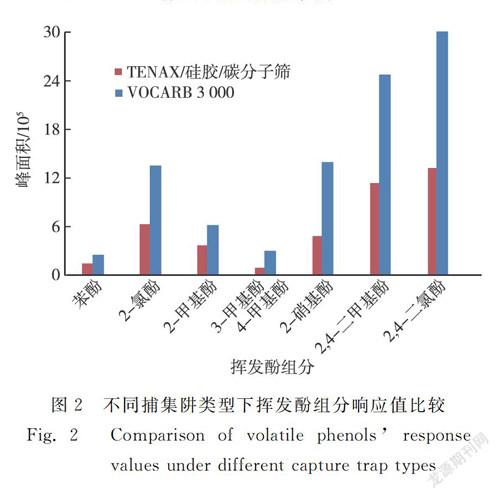
实验考察了VOCARB 3 000和TENAX/硅胶/碳分子筛两种不同类型捕集阱对挥发酚捕集效果的影响。将制备的标准样品上机检测,两种捕集阱均未检出4-氯苯酚和3-硝基苯酚,只检出其余8种挥发酚。原因可能为:在10种挥发酚中,4-氯苯酚沸点(220 ℃)最高,溶解度(2.7 g/100 g水)较大,难以被吹出;3-硝基苯酚的硝基位于间位,可形成分子间氢键,与硝基位于邻位、自身易形成分子内氢键的2-硝基苯酚(沸点为100 ℃,溶解度为0.2 g/100 g水)相比,3-硝基苯酚的沸点(194 ℃)和溶解度(1.4 g/100 g水)较高[20],故更难被吹出。因此,将能够检出的8种挥发酚列为本文最终研究的目标化合物。两种捕集阱中8种挥发酚响应值见图2,VOCARB 3 000捕集阱下每种挥发酚峰面积均大于TENAX/硅胶/碳分子筛,最终选择VOCARB 3 000作为实验用捕集阱。
2.3 吹扫温度和吹扫时间选择
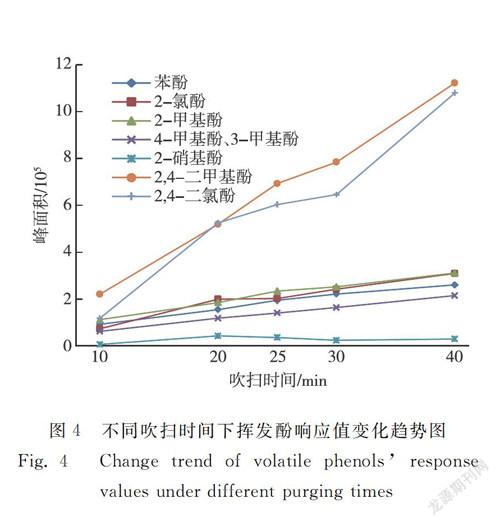
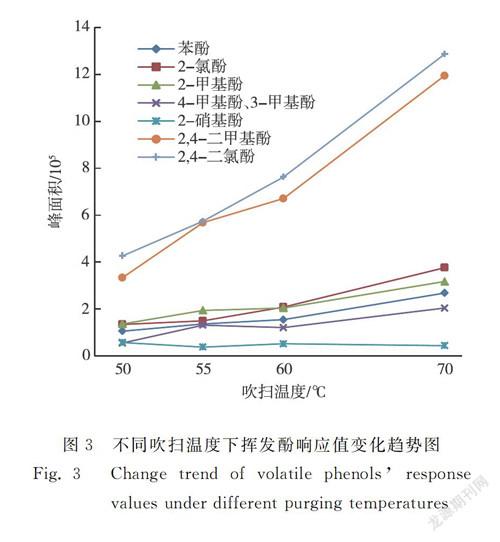
分别对50 ℃、55 ℃、60 ℃、70 ℃的吹扫温度和10 min、20 min、25 min、30 min、40 min的吹扫时间进行研究,结果见图3和图4。随着吹扫温度的升高或吹扫时间的增加,2-硝基苯酚的响应值基本无变化,其他7种挥发酚的响应值均逐渐增加。其中2,4-二甲基苯酚和2,4-二氯苯酚的响应值变化最大,由于二者出峰时间较晚,当吹扫温度越高或吹扫时间越长时,其色谱峰拖尾程度越严重,使分离度降低。长时间高温吹掃会将更多的水蒸气引入气相色谱和质谱中,导致色谱基线显著升高,长期如此,还会大大降低质谱灯丝的使用寿命。综合考虑吹扫效率、色谱峰型和水蒸气的影响,将吹扫温度设定为55 ℃,吹扫时间设定为25 min。
2.4 解吸温度和解吸时间选择
2.4.1 解吸温度
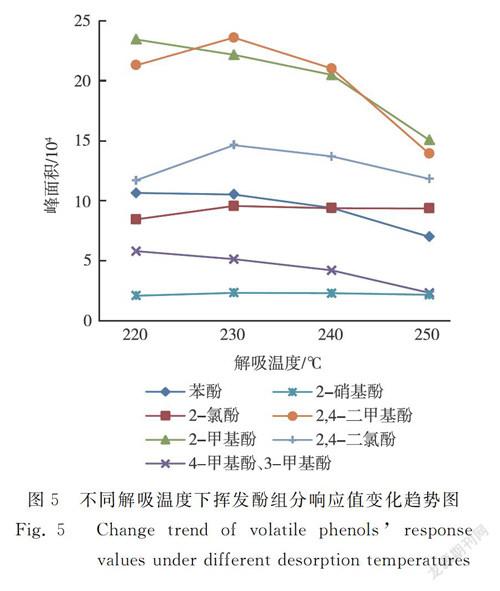
对220 ℃、230 ℃、240 ℃、250 ℃的解吸温度进行研究,结果见图5。随着解吸温度的升高,2-硝基苯酚的响应值基本无变化;苯酚、2-甲基苯酚、3-甲基苯酚和4-甲基苯酚的响应值逐渐下降;2-氯苯酚、2,4-二甲基苯酚和2,4-二氯苯酚的响应值先增加后下降,在230 ℃时响应值达到最大。可知,解吸温度过低,组分脱附不完全,残留在捕集阱中,使测定结果偏低;解吸温度越高,越有利于组分快速脱附到气相色谱中,得到较窄的色谱峰;解吸温度过高,易造成组分分解损失。因此,综合所有化合物的响应值,选择的解吸温度为230 ℃。
2.4.2 解吸时间
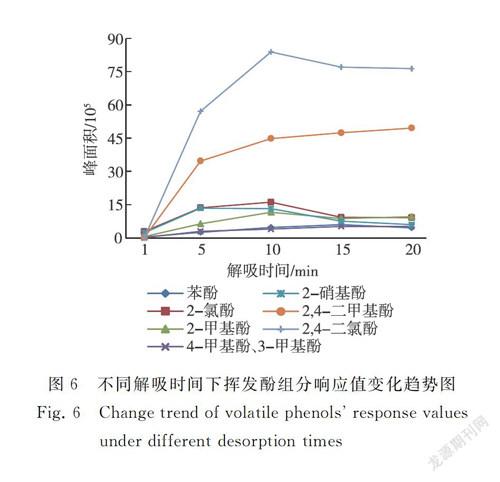
对1 min、5 min、10 min、15 min、20 min的解吸时间进行研究,结果见图6。解吸时间为1 min时,除沸点较低的2-氯苯酚、2-甲基苯酚和2-硝基苯酚外,其他沸点较高的挥发酚响应值均较低,仅为检出限水平。随着解吸时间增加,3-甲基苯酚、4-甲基苯酚和2,4-二甲基苯酚脱附含量逐渐增加,其他5种挥发酚脱附含量均先增加后下降,在10 min时脱附含量达到最大。因持续进样使各组分色谱峰型均有不同程度的拖尾,其中出峰较晚的2,4-二甲基苯酚和2,4-二氯苯酚拖尾最为严重。因此,解吸时间的长短对挥发酚脱附效果影响较大。解吸时间太短,脱附不完全,残留量大,降低解吸效率;解吸时间太长,持续进样易造成色谱峰拖尾,降低分离度。综合考虑解吸效率和色谱峰型,选择的解吸时间为10 min。
2.5 NaCl浓度选择
挥发酚溶解度越大,吹扫捕集效率越低,加入NaCl可增加离子强度,增强盐析效应,降低液体基质对挥发酚分子的束缚,从而降低其溶解度,增加逸出活度,提高吹扫捕集效率。
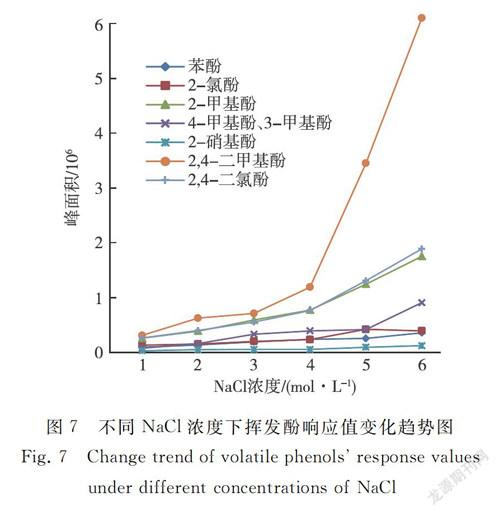
对1 mol/L、2 mol /L、3 mol/L、4 mol/L、5 mol/L、6 mol /L(已接近饱和)的NaCl浓度进行研究,结果见图7。随着NaCl浓度的增加,2-硝基苯酚响应值基本无变化,其他7种挥发酚均逐渐增加,其中2,4-二甲基苯酚响应值受NaCl浓度影响最大,2-氯苯酚在5 mol/L时响应值最高,之后逐渐下降,但下降趋势不大。综合考虑所有化合物,选择6 mol/L(对应NaCl加入量为1.75 g)作为样品中NaCl的添加浓度。需要注意的是,NaCl浓度过高可能会导致盐体析出,为避免管路堵塞,检测结束后,必须用纯水对吹扫捕集系统进行清洗。
2.6 线性范围
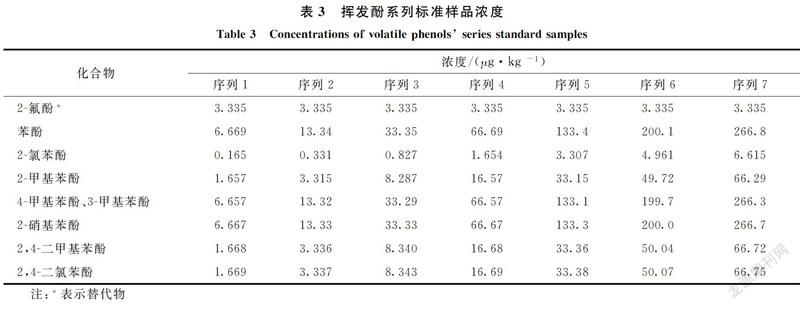
按标准样品制备方法制备不同浓度的挥发酚系列标准样品(表3),在优化的仪器条件下上机检测。8种挥发酚线性范围和相关系数见表4,各组分相关系数均≥0.995 8。
2.7 准确度、精密度和检出限
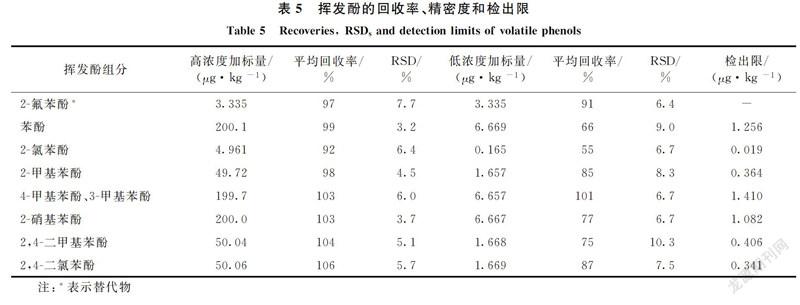
在空白土壤样品中分别添加高浓度和低浓度挥发酚标准溶液,平行配制7份,进行精密度和准确度实验。加标回收率和方法检出限见表5,检出限计算公式为MDL=s×t(n-1,1-α=0.99),式中s为加标样品测试结果标准偏差;n为平行样品个数;t(n-1,1-α=0.99)为在自由度n-1、置信度1-α=0.99时的研究值,当n=7时,t(6,0.99)值为3.142 7)。计算结果表明,挥发酚各组分平均回收率为55%~106%,相对标准偏差为3.2%~10.3%,检出限为0.019~1.410 μg/kg。
2.8 样品分析
将采自某工厂的土壤样品分别按吹扫捕集和索氏提取[21]两种方法进行前处理。表6列出了两种方法的检测结果,对比可知:(1)挥发酚检测方面,吹扫捕集-气相色谱-质谱法只检出1种挥发酚(2-硝基苯酚),测定的挥发酚总量为56.52 μg/kg,其他7种挥发酚未检出,2-氟苯酚的平均回收率为46%;索氏提取-气相色谱-质谱法共检出4种挥发酚(苯酚、3-甲基苯酚和4-甲基苯酚、2-硝基苯酚),测定的挥发酚总量为139.66 μg/kg,其他4种挥发酚未检出,2-氟苯酚、2,4,6-三溴苯酚的平均回收率分别为44%、98%。(2)试剂用量方面,吹扫捕集-气相色谱-质谱法仅需5 ml水,而索氏提取-气相色谱-质谱法需要100 ml水和150 ml有机溶剂。(3)时间方面,从样品制备到检测结束,吹扫捕集-气相色谱-质谱法需要50.80 min,索氏提取-气相色谱-质谱法则需要1 126.92 min(约18.5 h)。(4)人员参与方面,吹扫捕集-气相色谱-质谱法,实验人员仅参与样品制备,操作简单;索氏提取-气相色谱-质谱法,实验人员要参与整个前处理过程,操作繁琐。
两种方法检测结果存在差异。在实际样品分析中,吹扫捕集-气相色谱-质谱法未能正常检出苯酚、3-甲基苯酚和4-甲基苯酚,原因可能为:在土壤加水吹扫时,2-硝基苯酚溶解度(仅0.2 g/100 g水)最小,很容易被吹出,而苯酚(9.3 g/100 g)、3-甲基苯酚(2.6 g/100 g)、4-甲基苯酚(2.3 g/100 g)溶解度较大,在相同条件下难以被吹出。此外,未正常检出的挥发酚与土壤基质的相互作用可能大于与水的相互作用,导致其从土壤基质进入水介质相对困难,很难被吹出,也是目前该方法仍较少用于土壤等复杂基质样品中挥发酚测定的原因之一。索氏提取可保证将样品中实际存在的挥发酚全部提取,仍然是经典的土壤样品前处理方法。因此,该工厂土壤中含有苯酚、3-甲基苯酚和4-甲基苯酚、2-硝基苯酚,挥发酚总量为139.66 μg /kg;不含2-氯苯酚、2-甲基苯酚、2,4-二甲基苯酚和2,4-二氯苯酚。
3 结 论
(1)吹掃捕集-气相色谱-质谱法测定挥发酚具有快速简单、绿色环保、自动化在线分析、无污染、适于批量样品检测的优点。
(2)鉴于挥发酚与土壤基质相互作用的复杂性,目前吹扫捕集-气相色谱-质谱法仅适用于挥发性强和溶解度较小挥发酚的测定,如2-硝基苯酚;对于其他溶解度较大或沸点较高的挥发酚仍需要用经典的索氏提取方法进行分析。
参考文献
[1]BACIOCCHI R, ATTINA M, LOMBARDI G, et al. Fast determination of phenols in contaminated soils[J]. Journal of Chromatography A, 2001, 911(1): 135-141.
[2]张月琴, 吴淑琪, 涂圣军, 等. 不同气相色谱固定相对酚类和苯系物的分离[J]. 分析测试学报, 2002, 21(2): 61-63.
[3]BARANOWSKA I, PIESZKO C. Determination of selected herbicides and phenols in water and soils by solid-phase extraction and high-performance liquid chromatography[J]. Journal of Chromatographic Science, 2000, 38(5): 211-218.
[4]SIRVENG G, SANCHZ J M, HIDALGO M, et al. A simple and efficient method for the determination of pollutant phenols in soils with high levels of organic matter[J]. International Journal of Environmental Analytical Chemistry, 2009, 89(4): 293-304.
[5]ES-HAGHI A, BAGHERNEJAD M, BAGHERI H. In situ solid-phase microextraction and post on-fiber derivatization combined with gas chromatography-mass spectrometry for determination of phenol in occupational air[J]. Analytica Chimica Acta, 2012, 742: 17-21.
[6]WENNRICH L, POPP P, MODER M. Determination of chlorophenols in soils using accelerated solvent extraction combined with solid-phase microextraction[J]. Analytical Chemistry, 2000, 72(3): 546-551.
[7]LLOMPART M, BLANCO B, CELA R. Determina-tion of phenols in soils by in situ acetylation headspace solid-phase microextraction[J]. Journal of Microcolumn Separations, 2000, 12(1): 25-32.
[8]LEE M R, YAH Y C, HSIANG W S, et al. Solid-phase microextraction and gas chromatography-mass spectrometryfor determining chlorophenols from landfill leaches and soil[J]. Journal of Chromatography A, 1998, 806: 317-324.
[9]杨丽莉, 胡恩宇, 母应锋, 等. Tenax采样管富集气相色谱-质谱法测定空气中的痕量酚类化合物[J]. 色谱, 2007, 25(1): 48-52.
[10]张永兵, 杨文武, 张钧. 土壤中6种酚类化合物的索氏提取-气相色谱测定法[J]. 环境与健康杂志, 2014, 31(4): 334-336.
[11]KORENMAN Y I, GRUZDEV I V, KONDRATENOK B M. Extraction and gas-chromatographic determination of phenol and cresols in soil[J]. Journal of Analytical Che mistry, 2001, 56(2): 166-169.
[12]楊丽莉, 王美飞, 胡恩宇, 等. 超声波提取-气相色谱法测定土壤中21种酚类化合物[J]. 色谱, 2013, 31(11): 1081-1086.
[13]EGIZABAL A, ZULOAGA O, ETXEBARRIA N, et al. Comparison of microwave-assisted extraction and soxhlet extraction for phenols in soil samples using experimental designs[J]. Analyst, 1998, 123(8): 1679-1684.
[14]桂建业, 张莉, 陈宗宇, 等. 加速溶剂萃取-气相色谱-质谱法测定固体废物中酚类化合物[J]. 理化检验(化学分册), 2012, 48(4): 423-426.
[15]ZULOAGA O, ETXEBARRIA N, FERNANDEZ L A, et al. Multisimplex optimization of purge-and-trap extraction of phenols in soil samples[J]. Journal of Chromatography A, 1999, 849: 225-234.
[16]ZHAO R S, CHENG C G, YUAN J P, et al. Sensitive measurement of ultratrace phenols in natural water by purge-and-trap with in situ acetylation coupled with gas chromatography-mass spectrome-try[J]. Analytical and Bioanalytical Chemistry, 2007, 387(2): 687-694.
[17]LARREDA J, BILBAO U, VALLEJO A, et al. Multisimplex optimization of the purge-and-trap preconcentration of volatile fatty acid, phenols and indoles in cow slurries[J]. Chromatographia, 2008, 67(1/2): 93-99.
[18]ZULOAGA O, ETXEBARRIA N, FERNANDEZ L A, et al. Multisimplex optimisation and comparison of different purge-and-trap extractions of volatile organic compounds in soil samples[J]. Analytica Chimica Acta, 2000, 416(1): 43-53.
[19]贾静, 刘艳. 吹扫捕集气相色谱-质谱法测定土壤中54种挥发性有机物[J]. 分析试验室, 2011, 30(10): 92-97.
[20]曾昭琼, 李景宁. 有机化学·上册[M]. 4版. 北京: 高等教育出版社, 2004: 291.
[21]中华人民共和国环境保护部. HJ 703-2014国家环境保护标准, 土壤和沉积物-酚类化合物的测定-气相色谱法[S]. 北京: 中国环境科学出版社, 2014.
Purge and trap gas chromatography mass spectrometry for determination of volatile phenols in soil
LIU Jiao1, WU Shu-qi2, JIA Jing2, TONG Ling2
(1. Nanjing Center, China Geological Survey, Nanjing 210016,China;
2. National Research Center for Geoanalysis, Beijing 100037,China)
Abstract:A purge and trap gas chromatography mass spectrometry method was evaluated for the determination of volatile phenols in soil. The conditions of purge and trap gas chromatography mass spectrometry was optimized by analyzing the effects of purge and trap parameters on measurment of volatile phenols. Compared with soxhlet extraction technology, the purge and trap gas chromatography mass spectrometry has been verified in the actual samples that it has the advantages of simple operation, short analysis period, less reagent dosage and small disturbance, and will be suitable for the determination of volatile phenols with low boiling point and low solubility. And the classic soxhlet extraction technology is recommended to determine for those with high boiling point or high solubility.
Key words:purge and trap; gas chromatography mass spectrometry; volatile phenols; soil
*收稿日期:2018-08-29 修訂日期:2018-11-26 责任编辑:谭桂丽
基金项目:国土资源部公益性行业科研专项“地矿实验测试仪器设备的使用与维护技术方法研究(编号:201311081)”项目资助。
第一作者简介:刘娇,1989年生,女,助理工程师,主要从事有机分析检测工作。

