大花杓兰亲环素基因的克隆及生物信息学分
付亚娟 张剑 刘欢 侯晓强

摘 要:親环素是一个多基因家族,在植物生命活动中发挥着重要的作用。该研究以大花杓兰(Cypripedium macranthum)为材料,采用RT-PCR技术克隆到1个亲环素基因(CyP),并对其进行生物信息学分析。结果表明:大花杓兰CyP基因的开放阅读框序列为525 bp,命名为CmCyP(GenBank登录号为MH411125),编码174个氨基酸。预测CmCyP蛋白是一个位于细胞质、相对分子量约为18 kD、理论pI为8.73、无信号肽、跨膜结构域的亲水性蛋白质。磷酸化和糖基化位点预测分析发现,CmCyP蛋白存在18个潜在的磷酸化位点和2个潜在的糖基化位点。蛋白保守结构域预测分析发现,CmCyP蛋白包含一个高度保守的肽脯氨酰顺反异构酶结构域,属于单结构域亲环素。对二级结构进行预测分析发现,CmCyP蛋白中存在无规卷曲70个、延伸链56个、α-螺旋23个、β-折叠25个,这4种结构元件在三级结构中也有体现。系统进化树结果显示,大花杓兰CmCyP蛋白与铁皮石斛(Dendrobium catenatum)和万带兰(Vanda hybrid cultivar)的CyP蛋白的亲缘关系较近。该研究首次克隆了大花杓兰亲环素基因(CmCyP),为进一步探讨CmCyP基因的生物学功能奠定了基础。
关键词: 大花杓兰, RT-PCR, 基因克隆, 系统发育树, 序列分析
中图分类号:Q949.95
文献标识码:A
文章编号:1000-3142(2019)05-0633-08
Cloning and bioinformatics analysis of cyclophilin gene(CmCyP) from Cypripedium macranthum
FU Yajuan1,2, ZHANG Jian3, LIU Huan1, HOU Xiaoqiang1,2*
( 1. College of Life Sciences, Langfang Normal University, Langfang 065000, Hebei, China; 2. Edible and MedicinalFungi Research and Development Center of Hebei Universities, Langfang 065000, Hebei, China;3. Langfang Polytechnic Institute,Langfang 065000, Hebei, China )
Abstract:Cyclophilin is a multi-gene family that plays an important role in plant biology. A cyclophilin gene in Cypripedium macranthumnamed as CmCyP (GenBank Accession No. MH411125), was successfully cloned by RT-PCR, and then bioinformatics analysis were carried out. The results were as follows: CmCyP protein was predicted as a stable hydrophilic protein composed of 174 amino acids, without signal peptide and transmembrane domain. Its relative molecular mass was approximately 18 kD, and a predicated isoelectric point (pI) was 8.73.
Phosphorylation and glycosylation site prediction analysis revealed that eighteenpotential phosphorylation sites and two potential glycosylation sites were found in CmCyP protein. Protein domain prediction revealed that CmCyP contained a highly conserved peptide prolyl cis-trans isomerase domain, belonging to single domain of cyclophilin. The secondary structure of CmCyP was abundant in random coils (70) and extension chains (56), while was less in α-helices (23) and β-turns (25). Phylogenetic tree analysis indicates that the genetic relationship of CmCyP in C. macranthumwith CyPs from Dendrobium catenatumand Vanda hybrid cultivar is relatively close. In conclusion, the CmCyPgene was firstly cloned fromCypripedium macranthum, which provides for further study on biology function of CmCyPgene.
Key words: Cypripedium macranthum, RT-PCR, gene cloning, phylogenetic tree, sequence analysis
亲环素(Cyclophilin, CyP)是一类普遍存在于原核和真核生物体内、在进化上非常保守的多功能蛋白质(Galat,1999;王保明和谭晓风,2008)。Gasser et al.(1990)首次从番茄(Lycopersicon esculentum)、玉米(Zea mays)和油菜(Brassica napus)中分离到亲环素蛋白cDNA序列,并在大肠杆菌中成功表达。随后,亲环素基因相继在拟南芥(Arabidopsis thaliana)(Chou & Gasser,1997)、水稻(Oryza sativa)(Lee et al.,2015)、小麦(Triticum aestivum)(Kaur et al.,2016)、棉花(Gossypium hirsutum)(吴莉等,2012)等多种植物中被鉴定和分离。亲环素除一般生物学功能,如作为分子伴侣发挥肽脯氨酰顺反异构酶活性、参与DNA降解的调控及植物叶绿体的氧化还原调节等(童惠姗等,2017),还在植物激素信号转导(Cheong et al.,2017;Liebthal et al.,2016;Ma et al.,2013)、逆境胁迫应答(Ahn et al.,2010;Kumari et al.,2009,2013;赵丽等,2018)、抗病原菌的防御反应(Kumari et al.,2001;Ye & Ng,2002)等过程中发挥重要作用。
大花杓兰(Cypripedium macranthum)为兰科杓兰属多年生草本植物。除了较高的观赏价值,大花杓兰还具有一定的药用价值,可用于全身浮肿、风湿腰腿痛、跌打损伤等疾病的治疗(陈心启和吉占和,2003)。基于本课题组前期大花杓兰转录组数据分析,发现了一条与植物亲环素基因有较高同源性的序列,但有关大花杓兰亲环素的相关研究目前尚未见有报道。因此,本研究采用RT-PCR首次克隆了大花杓兰亲环素基因(CmCyP),并对其编码的蛋白质序列进行生物信息学分析,旨在为CmCyP基因的生物学功能的研究奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 材料 本研究所用的材料为大花杓兰(Cypripedium macranthum)的根;大肠杆菌(Escherichia coli)TOP10为本实验室保存。
1.1.2 试剂及试剂盒 植物RNA提取试剂盒(Omega,USA)购自上海索宝生物科技有限公司;BeyoRTTMcDNA第一链合成试剂盒购自上海碧云天生物技术有限公司;即用型PCR扩增试剂盒、SanPrep柱式PCR产物纯化试剂盒、LB Broth Agar和LB Broth购自生工生物工程(上海)股份有限公司(简称上海生工);pGM-T克隆试剂盒、DNA Marker购自天根生化科技(北京)有限公司;IPTG、X-Gal购自北京华越洋生物科技有限公司。
1.2 方法
1.2.1 大花杓兰RNA的提取及cDNA第一链的合成 采用植物RNA提取试剂盒(Omega,USA)提取大花杓兰根总RNA,其操作按照试剂盒说明书进行,RNA的完整性通过1%琼脂糖凝胶电泳进行检测。利用BeyoRTTMcDNA第一链合成试剂盒(碧云天,上海)合成cDNA。RT-PCR反应体系:Recation Buffer (5X) 4 μL,RNA模板1 μL,引物Oligo(dT)18 (0.5 μg·μL<SUP>-1</SUP>)1 μL,RNase Inhibitor (20 U·μL<SUP>-1</SUP>) 1 μL,dNTP Mix (10 mmol·L<SUP>-1</SUP>) 1 μL,M-MLV反轉录酶(200 U·μL<SUP>-1</SUP>)1 μL;加ddH2O至20 μL。RT-PCR反应程序为42 ℃,60 min;80 ℃,10 min。将cDNA第一链置于-20 ℃冰箱中保存备用。
1.2.2 大花杓兰CmCyP基因的克隆和测序 基于课题组前期获得的大花杓兰转录组数据,采用Oligo 6软件设计一对特异性引物用于CmCyP基因的PCR扩增,正向引物CmCyPF(5′-CCGGAATTCATGGCAGCGACCA-3′,加粗的核苷酸序列为保护碱基,下划线的核苷酸为EcoRⅠ酶切位点)和反向引物CmCyPR(5′-CACCGCTCGAGCTAAGAGAGCTG-3′,加粗的核苷酸序列为保护碱基,下划线的核苷酸为XhoⅠ酶切位点)。PCR反应体系:2×PCR Master mix 12.5 μL,cDNA 2 μL,正向和反向引物(10 μmol·L<SUP>-1</SUP>)各1 μL;加ddH2O至25 μL。PCR程序:94 ℃预变性3 min;94 ℃变性30 s,57 ℃复性30 s,72 ℃延伸40 s,共30个循环;72 ℃最后延伸7 min。PCR产物经1.0%琼脂糖凝胶电泳检测后,利用PCR产物纯化试剂盒对其进行纯化。纯化的PCR产物与克隆载体pGM-T进行连接,并转化E. coliTOP10感受态细胞。通过蓝白斑筛选和菌落PCR鉴定出的阳性重组子送至上海生工进行测序,测序引物为载体通用引物T7。
1.2.3 大花杓兰CmCyP蛋白系统发育分析 测序结果用Chromas软件打开,观察峰图,排除双峰序列,获得良好DNA序列;采用DNAstar去除载体冗余序列;应用NCBI的Blastn与GenBank中已有序列进行同源性分析,初步确定分离的序列即为大花杓兰CyP基因。基于在线基因预测软件ORF Finder对CmCyP基因编码的氨基酸序列进行推测,并通过NCBI的Blastp程序在氨基酸水平上对大花杓兰CmCyP蛋白序列进行同源性分析。用Clustal X2软件对大花杓兰CmCyP蛋白及与其相似性较高的其它植物亲环蛋白进行多序列比对分析,并使用Mega 5.1中的邻接法来构建系统发育树。
1.2.4 大花杓兰CmCyP的生物信息学分析 用在线软件ProtParam(http://web.expasy.org/protparam/)对CmCyP理化性质进行预测;SignaIP4.1 Server(http://www.cbs.dtu. dk/services/SignalP/)分析CmCyP信号肽;Psort(http://www.genscript.com/psort.html)对CmCyP蛋白进行亚细胞定位;TMpred(https://embnet.vital-it.ch/software/TMPRED_form.html)预测跨膜结构域;Protscale(http://web.expasy.org/protscale/)对其进行亲水性和疏水性分析;用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)预测CmCyP蛋白潜在的磷酸化位点;用NetOGlyc 4.0(http://www.cbs.dtu.dk/services/NetOGlyc/)进行CmCyP蛋白糖基化位点预测;通过InterProScan(http://www.ebi.ac.uk/interpro/search/sequence-search)预测大花杓兰CmCyP蛋白的保守結构域及功能位点。用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.htm)对大花杓兰CmCyP的二级结构进行预测;用在线软件SWISS-MODEL(http://swissmodel.expasy.org/),基于同源建模法对该蛋白的三级结构进行预测。
2 结果与分析
2.1 CmCyP基因的RT-PCR扩增
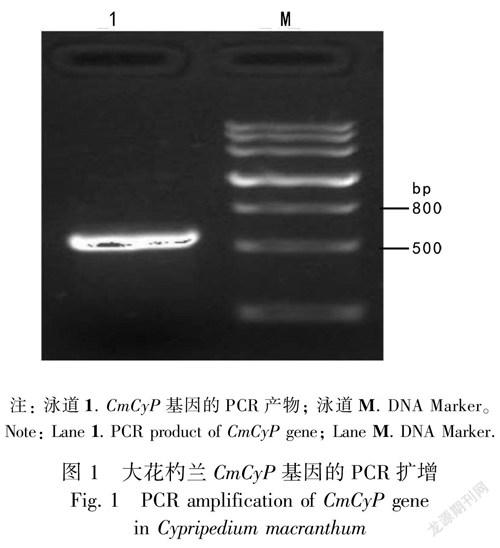
以大花杓兰根总RNA反转录获得的cDNA为模板,CmCyPF和CmCyPR为特异性引物,进行PCR扩增。PCR产物经1.0%琼脂糖凝胶电泳检测(图1)。从图1可以看出,PCR扩增得到1条清晰明亮、约500 bp的条带,其大小与CmCyP目的基因理论值基本相符。
2.2 CmCyP基因的克隆及测序
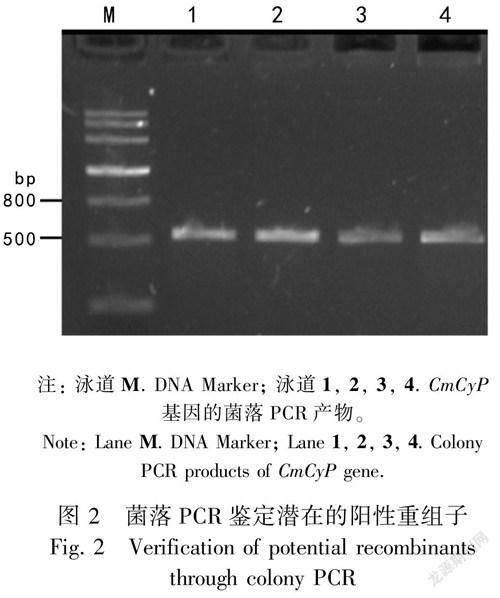
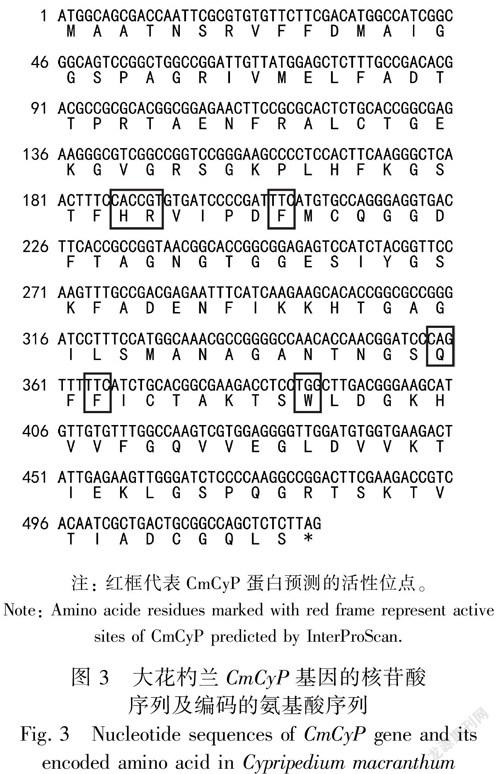
将纯化的PCR产物与载体pGM-T进行连接、转化E. coliTOP10。对转化平板上长出的白色单菌落进行菌落PCR检测,电泳结果如图2所示。菌落PCR扩增得到1条大小约500 bp的条带,与预期大小一致。将菌落PCR鉴定的阳性重组子送至上海生工进行测序,获得大花杓兰CmCyP基因的ORF序列,大小为525 bp(提交至GenBank,登录号为MH411125),编码174个氨基酸(图3)。
2.3 CmCyP蛋白的系统发育分析
将大花杓兰CmCyP基因编码的氨基酸序列在GenBank进行Blastp搜索,发现大花杓兰CmCyP与多种植物亲环蛋白具有较高的序列相似性。选取与大花杓兰CmCyP同源性较高的8条蛋白序列,铁皮石斛(Dendrobium catenatumXP_020689035)、芝麻(Sesamum indicumXP_011074689)、陆地棉(Gossypium hirsutum ACT63839)、西洋长春藤(Hedera helixAPV45518)、三七(Panax notoginsengAIX10768)、大麻槿(Hibiscus cannabinusAQA28693)、落花生(Arachis diogoi ABY57946)和万带兰(Vanda hybrid cultivar ADG34846),构建系统发育树(图4)。图4结果表明,来自9个不同植物的CmCyP蛋白聚成2个分支。大花杓兰亲环蛋白CmCyP与铁皮石斛(Dendrobium catenatum)和万带兰(Vanda hybrid cultivar)CyP处于同一分支上,亲缘关系较近。这与他们均隶属兰科植物的进化及分类地位较一致。
2.4 CmCyP蛋白的生物信息学分析
采用一系列在线软件对大花杓兰CmCyP基因编码蛋白进行生物信息学预测分析。推测CmCyP蛋白的分子式为C803H1261N227O246S9,相对分子量为18.32 kD,理论等电点(pI)为8.73。预测大花杓兰CmCyP蛋白位于细胞质、不含信号肽,无跨膜结构域、稳定的亲水性蛋白。
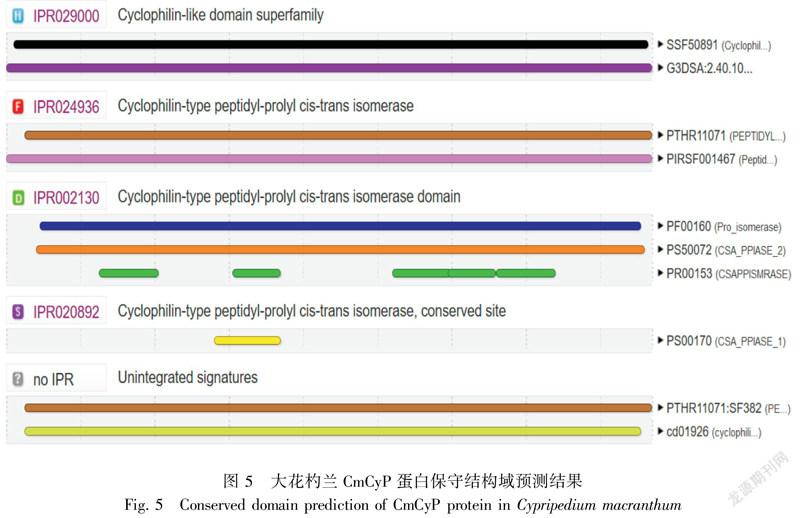
采用InterProScan对CmCyP蛋白的保守结构域进行预测分析(图5)。图5结果表明,大花杓兰CmCyP蛋白含4种保守结构域,分别在氨基酸序列的3~173位是亲环素样蛋白超家族(IPR029000);6~174位是亲环素型肽脯氨酰顺反异构酶(IPR024936);26~41、62~74、105~132和133~148为亲环素型肽脯氨酰顺反异构酶的结构域(IPR002130);57~74位是亲环素型肽脯氨酰顺反异构酶的保守位点(IPR0020892)。CmCyP蛋白的活性位点为63H、64R、69F、120Q、122F和130W(图3)。应用NetPhos 3.1程序对CmCyP蛋白的磷酸化位点进行预测,结果表明该蛋白序列存在18个潜在的磷酸化位点,其中9个丝氨酸(Ser)位点、8个苏氨酸(Thr)位点和1个酪氨酸(Tyr)位点。这些磷酸化位点主要能够被p38MAPK、unsp、SRC、GSK3、PKA、PKC、PKG、CKⅡ等蛋白激酶磷酸化。用NetOGlyc 4.0 进行糖基化位点预测分析,发现CmCyP蛋白含2个潜在的糖基化位点。
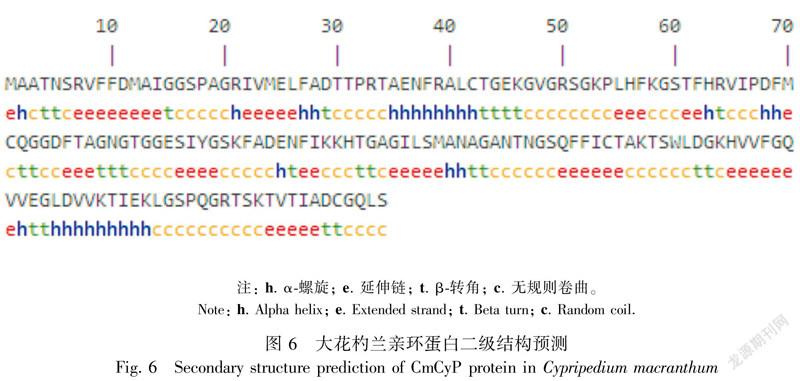
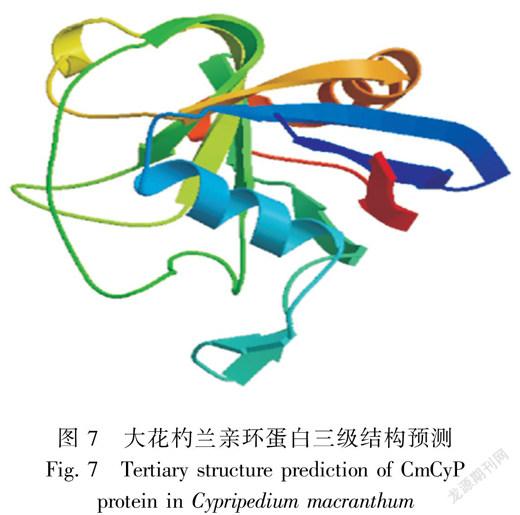
利用SOPMA预测大花杓兰CmCyP蛋白二级结构,结果如图6所示。该蛋白含有13.37%的α-螺旋(Alpha helix),31.98%的延伸链(Extended strand),14.53%的β-转角(Beta turn)和40.12%的无规则卷曲(Random coil)。采用SWISS-MODEL在线工具,以甜橙(Citrus sinensis)(PDB ID:4jjm.1)为模板,序列相似性为57%,在5~174位氨基酸同源建模,预测大花杓兰CmCyP的三级结构(图7)。从预测的三维模型可以看出,大花杓兰CmCyP蛋白主要由无规则卷曲、延伸链、α-螺旋和β-转角组成,与二级结构预测结果基本一致。
3 討论与结论
亲环素是一个多基因家族,其中拟南芥有31个CyP基因、水稻29个CyP基因、大豆62个CyP基因(童惠姗等,2017)。CyP基因目前在很多植物中已被鉴定,但其功能只在拟南芥和水稻中有较深入研究。Kim et al.(2012)研究发现水稻亲环素基因(OsCYP20-2)能增强拟南芥和烟草的抗旱性。水稻OsCYP19-4基因过表达能提高水稻生物量和耐冷能力(Hwa et al.,2016;Lee et al.,2016)。在拟南芥中,过表达木豆亲环素基因(CcCyP)的植株对冷、热、盐、干旱等逆境胁迫均具有较好的耐受性(Sekhar et al.,2010)。Pogorelko et al. (2014)研究证实拟南芥亲环素AtCYP19参与其对抗病原细菌丁香假单胞菌(Pseudomonas syringae)的防御反应。水稻亲环素蛋白CyP1通过影响稻瘟病菌(Magnaporthe grisea)附着孢形成和菌丝生长发挥其抗菌作用(Viaud et al.,2002)。Lee et al.(2007)研究发现大白菜亲环素对多种病原真菌(如Botrytis cinerea,Trichoderma harzianum,T. viride,Rhizoctonia solani,Fusarium solani, F. oxysporum)均有不同程度的抑菌作用。Zhang et al.(2017)证实人参亲环素pgCyP对植物病原真菌Phytophthora cactorum具有较强的抑制作用,但对Rhizoctonia solani,Fusarium solani和Botrytis cinerea没有抑菌作用。
大花杓兰为兼具观赏和药用价值的兰科植物,其基因组中含多少个亲环素基因,他们是否存在可变剪接?生物学功能如何?这些基础科学问题的研究目前国内外尚未见报道。因此,基于前期大花杓兰转录组数据,本研究采用RT-PCR首次克隆了大花杓兰亲环素基因,命名为CmCyP。测序结果表明,大花杓兰CmCyP基因cDNA全长525 bp,编码174个氨基酸。蛋白多序列比对分析表明,CmCyP在氨基酸水平上与多种植物的CyP具有较高的同源性。系统进化树结果显示,大花杓兰CmCyP与铁皮石斛(Dendrobium catenatum)和万带兰(Vanda hybrid cultivar)的CyP蛋白的亲缘关系较近,这与他们同属于兰科植物的分类地位相一致;生物信息在线分析,预测CmCyP相对分子量为18.32 kD,理论等电点为8.73,该蛋白为存在于细胞质、无信号肽和跨膜结构域、稳定的亲水性蛋白。蛋白保守结构域预测表明,大花杓兰CmCyP属于亲环素样蛋白超家族,含有一个高度保守的肽脯氨酰顺反异构酶结构域,属于单结构域亲环素。CmCyP蛋白包含18个潜在的磷酸化位点和2个潜在的糖基化位点。鉴于CmCyP蛋白磷酸化位点较多,推测其在大花杓兰中生物学功能的发挥可能与激酶磷酸化有关。采用SOPMA预测CmCyP蛋白二级结构,发现该蛋白主要由延伸链和无规则卷曲组成,α-螺旋和β-转角相对较少。本研究工作的开展,对下一步探究大花杓兰亲环素基因的生物学功能具有重要意义。大花杓兰CmCyP也是逆境胁迫相关蛋白吗?CmCyP的表达和积累与菌根真菌侵染大花杓兰根系过程相关吗?CmCyP蛋白参与对抗植物病原菌的防御反应吗?这些问题有待于进一步研究探讨。
参考文献:
AHN JC, KIM DW, YOU YN, et al., 2010. Classification of rice (Oryza sativa L. Japonica nipponbare) immunophilins FKBPs, CMCYPs) and expression patterns under water stress [J]. BMC Plant Biol, 10(1): 253.
CHEN XQ, JI ZH, 2003. The huge book of china orchid [M]. 2nd ed. Bejing: China Forestry Press. [陈心启, 吉占和, 2003. 中国兰花全书[M]. 2版. 北京: 中国林业出版社.]
CHEONG H, SANTOS IBD, LIU W, 2017. Cyclophilin 20-3 is positioned as a regulatory hub between light-dependent redox and 12-oxo-phytodienoic acid signaling [J]. Plant Sign Behav, 12(9): e1362520.
CHOU IT, GASSER CS, 1997. Characterization of the cyclophilin gene family of Arabidopsis thalianaand phylogenetic analysisof known cyclophilin proteins [J]. Plant Mol Biol, 35(6): 873-892.
GALAT A, 1999. Variations of sequences and amino acid compositions of proteins that sustain their biological functions: An analysis of the cyclophilin family of proteins [J]. Arch Biochem Biophys, 371(2): 149-162.
GASSER CS, GUNNING DA, BUDELIER K, et al., 1990. Structureand expression of cytosolic cyclophilin/peptidylprolyl cistrans isomerase of higher plants and production of active tomatocyclophilin in Escherichia coli [J]. Pnas, 87(24): 9519-9523.
HWA YD, SOOK LS, JI PH, et al., 2016. Overexpression of OsCYP19-4 increases tolerance to cold stress and enhances grain yield in rice (Oryza sativa) [J]. J Exp Bot, 67(1): 69-82.
KAUR G, SINGH S, DUTTA T, et al., 2016. The peptidyl-prolyl cis-trans isomerase activity of the wheat cyclophilin, TaCmCyPA-1, is essential for inducing thermotolerance in Escherichia coli [J]. Biochimie Open, 2(C): 9-15.
KIM SK, YOU YN, PARK JC, et al., 2012. The rice thylakoid 1umenal cyclophilin OsCMCYP20-2 confers enhanced environmental stress tolerance in tobacco and Arabidopsis[J]. Plant Cell Rep, 31(2): 417-426.
KUMARI S, ROY S, SINGH P, et al., 2013. Cyclophilins proteins in search of function [J]. Plant Sign Behav, 8: e22734.
KUMARI S, SINGH P, SINGLA-PAREEK SL, et al., 2001. Isolationof unguilin, a cyclophilin-like protein with antimitogenic, antiviral, and antifungal activities, from black-eyed pea [J]. J Protein Chem, 20(5): 353-359.
KUMARI S, SINGH P, SINGLA-PAREEK SL, et al., 2009. Heterologous expression of a salinity and developmentally regulated rice cyclophilin gene (OsCyp2) inE. coliand S. cerevisiaeconfers tolerance towards multiple abiotic stresses [J]. Mol Biotechnol, 43(1): 95-96.
LEE SS, PARK HJ, JUNG WY, et al., 2015. OsCMCYP21-4, a novel Golgi-resident cyclophilin, increases oxidative stress tolerance in rice [J]. Front Plant Sci, 6: 797.
LEE JR, PARK SC, KIM JY, et al., 2007. Molecular and functional characterization of a cyclophilin with antifungal activity from Chinese cabbage [J]. Biochem Bioph Res Co, 353(3): 672-678.
LEE A, SANG SL, JUNG WY, et al., 2016. The OsCYP19-4gene is expressed as multiple alternatively spliced transcripts encoding isoforms with distinct cellular localizations and PPIase activities under cold stress [J]. Int J Mol Sci, 17(7):1154.
LIEBTHAL M, STRVEM, LI X, et al., 2016. Redox-dependent conformational dynamics of decameric 2-cysteine peroxiredoxin and its interaction with cyclophilin 20-3 [J]. Plant Cell Physiol, 57(7): 1415-1425.
MA X, SONG L, YANG Y, et al., 2013. A gain-of-function mutation in the ROC1gene alters plant architecture in Arabidopsis[J]. New Phytol, 197(3): 751-762.
POGORELKO GV, MOKRYAKOVA M, FURSOVA OV, et al., 2014. Characterization of three Arabidopsis thalianaimmunophilin genes involved in the plant defense response against Pseudomonas syringae[J]. Gene, 538(1): 12-22.
SEKHAR K, PRIYANKA B, REDDY VD, et al., 2010. Isolation and characterization of a pigeonpea cyclophilin (CcCYP) gene, and its over-expression in Arabidopsisconfers multiple abiotic stress tolerance [J]. Plant Cell Environ, 33(8): 1324-1338.
TONG HS, WANG SS, ZHU XN, et al., 2017. Research progress of plant cyclophilin gene functions [J]. Acta Bot Boreal-OccidentSin, 37(4): 830-838. [童惠姗, 汪珊珊, 朱馨妮, 等, 2017. 植物亲环素基因功能研究进展[J]. 西北植物学报, 37(4): 830-838.]
VIAUD MC, BALHADRE PV, TALBOTN J, 2002. A Magnaporthe griseacyclophilin acts as a virulence determinant during plant infection [J]. Plant Cell, 14(4): 917-930.
WANG BM, TAN XF, 2008. The structure, function and expressive regulation of plant cyclophilin genes [J]. J Cent S Univ For Technol, 28(1): 168-173.[王保明, 谭晓风, 2008. 植物亲环素基因的结构、功能及表达调控[J]. 中南林业科技大学学报, 28(1): 168-173.]
WU L, LI YJ, ZHANG XY, et al., 2012. Functional analysis of cyclophilin (GhCYP1) in Gossypium hirsutum[J]. Sci Agric Sin, 45(17): 3624-3631. [吴莉, 李艳军, 张新宇,等, 2012. 棉花亲环素基因GhCYP1的功能分析[J]. 中国农业科学, 45(17): 3624-3631.]
YE XY, NG TB, 2002. Isolation of a new cyclophilin-like protein from chickpeas with mitogenic, antifungal and anti-HIV-1 reverse transcriptase activities [J]. Life Sci, 70(10):1129-1138.
ZHANG H, WANG JW, LI SA, et al., 2017. Molecular cloning, expression, purification and functional characterization of an antifungal cyclophilin protein from Panax ginseng[J]. Biomed Rep, 7(6): 527-531.
ZHAO L, PAN CX, PANG KQ, et al., 2018. Gene cloning of PpGL2 transcription factor in peach and its bioinformatics analysis [J]. J Southern Agric, 49(10):1901-1908.[趙丽, 潘彩霞, 庞可勤, 等, 2018. 桃树PpGL2转录因子基因克隆及生物信息学分析[J]. 南方农业学报, 49(10):1901-1908.]

