农作物种子质量检测能力验证中的品种真实性室内分子检测研究
杨华

摘 要:主要介绍了水稻品种真实性鉴定室内分子检测的能力验证方法,探讨了聚丙烯酰胺凝胶、QIAGEN琼脂糖毛细管电泳和荧光毛细管电泳3种不同检测方法的应用分析和比较。各实验室可以根据实际情况选择合适的方法开展能力验证以及日常的检测工作。
关键词:农作物;种子质量;检测能力;验证;品种;真实性;分子检测
文章编号: 1005-2690(2019)06-0127-03 中图分类号: S339.31;S511 文献标志码: B
农作物品种真实性鉴定一直是种子检测中的重点和难点,因为近年来种子市场上假冒伪劣、套牌侵权等违法行为屡禁不止,而传统的检测方法为田间种植鉴定,其需要在作物整个生长发育期间,田间观察其特征特性并与标准样品进行比对,根据明显的性状差异来鉴定品种真实性,鉴定周期至少为一个生产周期,有时候待鉴定结果出来时,违法行为的证据都已经过期或者消失,无法快速有效地打击种子市场上的违法行为。但是近年来随着分子标记技术在品种鉴定中的广泛研究和发展,这种快速、高效的检测方法已经开始彰显优势。
2015年5月29日,国家标准化管理委员会批准的国家标准《农作物种子检验规程 真实性和品种纯度鉴定》第1号修改单规定,品种真实性或分子身份允许采用SSR和SNP分析标记方法。这一规定使SSR分子标记法同传统的田间种植鉴定一样成为国家标准认可的品种真实性鉴定方法。2016年1月1日修订后实施的新《种子法》第四十六条中明确规定,农业、林业主管部门可以采用国家规定的快速检测方法对生产经营的种子品种进行检测,检测结果可以作为行政处罚依据。这款法律条文明确了快速检测方法的法律地位,至此地方法院在审理种子案件、农业部门在查处假冒侵权等案件中,可以依据分子标记快速检测技术查处有关的违法行为。
江苏省于2014年通过了原农业部资质认定,取得了水稻品种真实性室内分子检测的资质,成为首批获得分子检测资质的省级种子质量检测机构。检验中心自取得资质后在2014—2017年种子市场监管中,分子检测技术发挥了无可替代的作用,为多起种子案件提供了强有力的技术支持和保障。为了不断提高中心的检测水平,中心技术人员每年都参加农业农村部组织的农作物种子品种真实性室内检测能力验证。本文就2017年参加的水稻品种真實性室内分子检测能力验证进行了分析和总结。
1 试验材料
试验中用到的水稻种子样品,由能力验证组织方——全国农技推广中心种子检验处提供。共7个种子样品,分别为对照CK08、CK24和待测样稻DC036、稻DC037、稻DC038、稻DC039、稻DC040。
2 试剂耗材
植物基因组DNA提取试剂盒(DNA secure Plant Kit)天根生物公司;Taq酶(Premix Taq)TAKARA。
3 试验仪器
种子粉碎设备(SPEX Geno2010 美国);PCR仪(Agilent);微量紫外分光光度计(Thermo Scientific ND2000);聚丙烯酰胺凝胶电泳仪/槽(北京六一/北京君意);伯乐(Bio-RAD)公司的Gel Dox XR+型号凝胶成像系统进行扫胶成像;琼脂糖毛细管电泳设备(QIAxcel Advanced 全自动核酸分析仪);荧光毛细管电泳设备(ABI)。
4 试验方法
4.1 DNA提取
本试验采用水稻干种子直接提取的方法,每个样品取20粒种子的混株样品,使用粉碎设备磨碎后,用DNA提取试剂盒提取水稻全基因组DNA,详细方法见试剂盒说明书。提取的DNA用微量紫外分光光度计检测DNA质量和浓度,并稀释到50 ng/μL备用。
4.2 PCR扩增
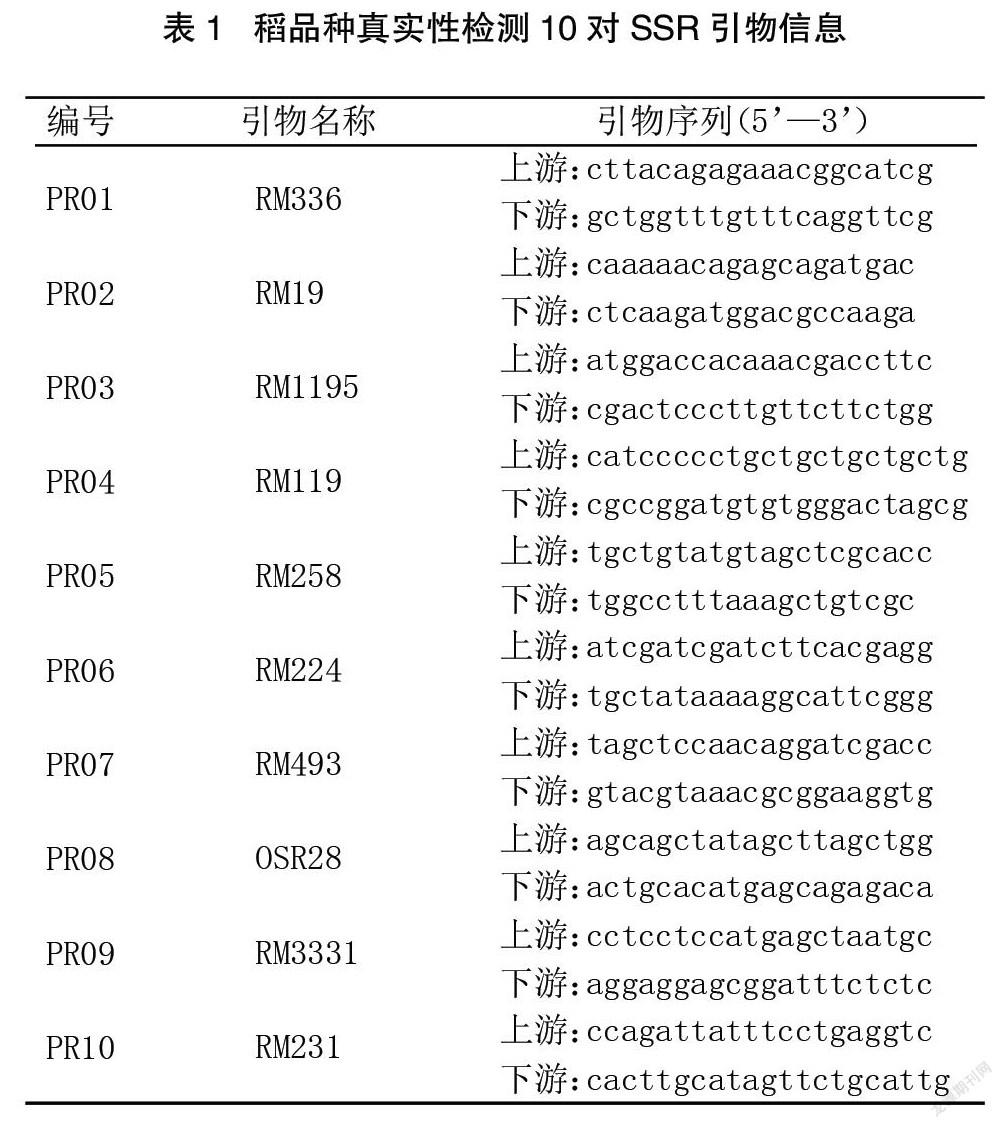
采用能力验证指导书中规定的10对引物进行PCR扩增,内容见表1。
反应体系为16.5 μL Taq酶混合物,1.5 μL DNA模板,2 μL上下游引物的混合物(其中进行荧光毛细管电泳的引物5’端标记荧光集团);反应程序为94 ℃下预变性2 min;进行32次扩增反应循环(94 ℃下变性45 s,58 ℃下退火45 s,72 ℃下延伸1 min);然后72 ℃下延伸8 min;最后10 ℃恒温冷却。
4.3 聚丙烯酰胺凝胶电泳检测
根据行业标准中非变性聚丙烯酰胺凝胶电泳银染检测的具体方法进行电泳和染色。染色后用凝胶成像系统拍照,并用Mage Lab 4.1软件进行数据分析。
4.4 琼脂糖毛细管电泳检测
按照仪器操作手册,将PCR产物放在仪器样品分析台上直接进行毛细管电泳分析,并用仪器自带的分析软件(QIAxcel ScreenGel)进行数据分析。
4.5 荧光毛细管电泳检测
将PCR产物稀释40倍后,分别吸取1 μL加入到分析仪专用的96孔板中,每个孔分别加入0.1 μL内标和8.9 μL去离子甲酰胺,变性处理并离心后放在分析仪上进行电泳,并用Gene Mapper Software 5软件进行数据分析。
5 结果和分析
5.1 聚丙烯酰胺凝胶电泳结果
根据行业标准中的方法步骤,以及本实验室的优化,每个检测位点都得到了清晰电泳图,以P01和P03两个位点的图为例,见图1。并根据指纹图谱对10个位点进行了读图分析,得到了最终的结果,见表2和表3。
5.2 QIAGEN琼脂糖毛细管电泳结果
本试验中应用的QIAGEN琼脂糖毛细管电泳是一种新型的琼脂糖电泳,此方法是通过将溴化乙锭染色的琼脂糖胶制成一种预制卡夹微光采集器,片段在卡夹毛细管中移动时通过一系列激光二极管,激发并检测信号,信号通过光电倍增管传至进行数据分析的软件中,通过软件分析生成模拟的电泳图谱,图谱中显示每条毛细管中片段的带型,以P01和P03两个位点的图为例,见图2,图型清晰,便于分析。
5.3 毛细管电泳分析
本试验通过标准中规定方法和部分步骤优化后,在ABI3700基因分析仪器上利用荧光标记的PCR产物进行毛细管电泳分析扩增产物的片段类型和大小,以P01和P03两个位点的图为例,见图3、图4。图中显示两个对照和5个样品在这两个位点上扩增片段的信号强,带型清晰,具有各自特异的带型,并且通过软件分析能得出每个片段的大小数值。表4为两个对照品种和4个样品在P01和P03两个位点上的片段大小。
5.4 能力验证结果判定
通过分析3种电泳结果各自的图谱或峰值图,均得到了一致的判定结果。与对照样品CK08相比,DC036号样品10个位点上均无差异;DC038号样品在P06位点上有1个差异,其他位点无差异;DC037、DC039号样品只在P02位点上无差异,其他位点均有差异;DC040号样品与对照样品在10个位点上均有差异,详见表2。
与对照样品CK24相比,DC037号样品在10个位点上均无差异;DC039号样品在P05位点上有1个差异,其他位点均无差异;DC036、DC038号样品只在P02位点上无差异,其他位点均有差异;DC040号样品与对照样品在P03和P08两个位点上无差异,详见表3。本次能力验证的结果经农业农村部农机推广中心判定为合格A等级,表明结果真确无误。
6 结论与讨论
目前,水稻品种真实性SSR标记鉴定方法中最常用的3种方法分别为聚丙烯酰胺凝胶电泳、QIAGEN琼脂糖毛细管电泳和ABI荧光毛细管电泳[1,2]。
本研究分别用这3种方法检测了本年度农业农村部分发的能力验证样品,每种方法都得到了清晰、便于分析的胶图和峰图,并将3种方法的结果进行了分析和比对,均得到了一致的检测结果。但是3种方法因为原理不同,也存在本身的优缺点:聚丙烯酰胺凝胶电泳成本低、结果直观,但是操作复杂、耗时长、容易受到人为因素影响、通量也不高;QIAGEN琼脂糖毛细管电泳方法最简便,但是分辨率略低;ABI荧光毛细管电泳分辨率高,最高可达1 bp,且通量高,但是成本相对较高,程序較复杂。
各个实验室可以在工作中根据实际情况选择合适的检验方法,也可以选择几种方法结合的方式进行试验,如先用QIAGEN琼脂糖毛细管电泳方法进行大量样品的初筛,之后对问题品种用分辨率更高的其他两种方法进行进一步鉴定,以获得更加高效、准确的检测结果。
参考文献:
[ 1 ] 刘文彬,许理文,王凤格,等.基于两种荧光毛细管电泳平台筛选评估玉米新型SSR 引物[J].玉米科学,2017,25(2):24-30.
[ 2 ] 程本义,夏俊辉,龚俊义,等.SSR荧光标记毛细管电泳检测法在水稻DNA指纹鉴定中的应用[J].中国水稻科学,2011,25(6):672-676.
(收稿日期:2019-05-15)

