基于化学核心素养下学考复习的教学研究
吴昊

【摘要】:高中化学学科核心素养是高中学生发展核心素养的重要组成部分,是学生综合素质的具体体现。以“微粒之间的相互作用力”单元复習教学为例子,探讨如何让化学核心素养与课堂密切结合,为教师在教学中提供些许参考。
【关键词】:作用力;离子键 共价键 核心素养
一、设计背景
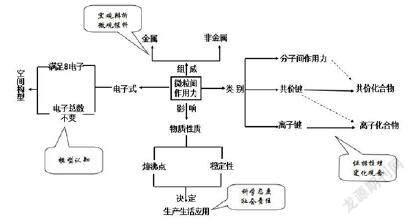
随着高中课程改革的深化,化学教学越来越重视发展学生化学学科核心素养,如何让核心素养在课堂上得以体现,成为广大教师研究的主要工作。苏教版《必修二》微观粒子间的作用力,对高一学生来说既抽象又陌生,但这又是学生化学微粒观念构建的重要组成部分,将学生对物质结构的认识提到一个新的层次。笔者通过高一教学的同课异构过程中,总结了一些教学设计,供大家参考。
二、教学设计
1.学情分析
学生这一单元学过来,主要存在困难的有以下几点:物质作用力的判断,物质变化破坏何种作用力,电子式的书写。因为作用力本身宏观不可见,比较抽象,因此需要建立模型及推理,并用生活中常见例子让学生加深印象。
2.教学目标
(1)能判断常见物质的作用力
(2)能书写常见物质的电子式
(3)能说出物质变化过程中破坏何种作用力
(4)了解微粒作用力在生产生活中的应用
3.教学过程
【环节1】微粒之间的作用力是否可见--水分子成像
教师:一杯水通过我们眼睛观察,看到的是水均一透明,若我们的眼睛能像显微镜一样放大物体数以万倍观察,能否看到水分子,能否看到水分子之间的作用力呢?
视频播放:中国科学家首次拍摄到水分子的内部结构
通过水分子拍摄视频,让学生直观了解到作用力是的的确确真实存在的,明白自己学的化学知识并不是只是局限于理论,而是有实际用途的,并且因为是我国科学家首先提出的,增强了学生的民族自豪感。这些都体现了“证据推理与模型认知”,“科学探究与创新意识”。
【环节2】小组学习--元素、物质、作用力的联系
提问:利用H、C、Cl、O、Na元素组成哪些物质?这些物质有何种作用力?小组合作讨论回答。
根据学生的回答,教师适时补充C2H2,CO2,Na2O2,ClO2,Cl2O,NaHSO4等学考出现过的物质。通过该环节的讨论,目的是让学生形成化学的元素观,同时激发学生发散性思维。
小结物质作用力判断方法:
①通常情况,活泼金属阳离子,铵根出现在物质中,认为有离子键,形成物质叫离子化合物。
②离子化合物中可以存在共价键,但不存在分子间作用力。
③化学键只有共价键存在的物质叫共价化合物或共价单质。这些物质中绝大多数存在分子间作用力。
④稀有气体仅有分子间作用力构成。
对作用力进行分类归纳,体现化学思维中的分类观,核心素养中的证据推理。
【环节3】电子式的书写
教师:微粒间作用力有分类,则需要有直观的表示方式,体现作用力的区别,这就有了电子式这一表示方式。
承接前面小组讨论的物质,书写对应的电子式/结构式。教师可选择学选考出现频率高的物质。如:CO2,H2O2,Na2O2,ClO2,HClO,NaOH,H3O+,NaH等。
书写原则:
先辨别化学键类型,后根据最外层电子情况,满足8电子结构书写。
这一环节体现化学思维中的符号观,核心素养的模型认知。
【环节4】判断物质变化过程中作用力的破坏
教师:从刚才电子式书写中,不难看出最外层电子成键情况是形成化学键的根本原因。一个原子最外层电子总是倾向于达到稳定结构,一种通过共用电子,一种通过电子得失。那共价键和离子键一定完全不同吗,是否存在联系?
【2】
从坐标上看,随着电子转移程度的加大,共价键共用电子偏移到临界点时,就变成了离子键。
练习:小组讨论破坏何种作用力。
小结作用力破坏判断原则:
①离子化合物熔化破坏离子键
②绝大多数共价化合物熔化破坏分子间作用力,形成原子时破坏共价键
这一环节体现化学思维的变化观,核心素养的变化观念。
【学习环节6】生产生活中作用力的应用
提问:通过微粒间作用力的分析,可解释我们日常生产生活的应用原理,请从作用力角度分析海水中提取食盐和淡水、工业制钠,电解水的原理。
海水中提取食盐和淡水过程,淡水分离出来破坏的是分子间作用力,所需要的温度不高;工业制钠是电解熔融NaCl,破坏是离子键,需要高能量。电解水破坏水分子内的共价键,需要高能量。
5.教学设计思路
三、教学思考
修订后的课程标准提出了以下教学核心策略:(1)教学中应注重运用实验事实、数据等证据素材,帮助学生转变偏差认识;(2)注重组织学生开展概括关联、比较说明、推论预测、设计论证等活动;(3)发挥重要知识的功能价值,帮助学生发展认识化学反应的基本角度,形成基本观念。本文设计的微粒间的作用力一定程度上让学生能从更高角度看待问题,追求化学学习的更高层次。
【参考文献】:
【1】中华人民共和国教研部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:18.

