纹藤壶附生菌的分离鉴定及蛋白酶菌株的产酶性质研究
徐萌 杨召阳 李夏云 路宜男 陈依帆 邢翔





















摘 要:目的:研究纹藤壶附生菌的分离鉴定及蛋白酶菌株的产酶性质。方法:黄渤海潮间带海域纹藤壶中分离到54株菌株,经酪蛋白酶实验,筛选得到4株高产蛋白酶的菌株,并对其进行菌种鉴定、产蛋白酶的发酵条件优化及产酶活性测定。结果:经筛选,得到4株高产蛋白酶的菌株,编号分别为X8、X18、X21、X48。通过16S rDNA序列分析,结合透射电镜及形态学观察、生理生化测试结果,初步鉴定X8为河豚毒素假交替单胞菌、X18为乔治亚海杆菌、X21为杀鱼假交替单胞菌、X48为康氏菌。通过测定菌株的生长曲线,确定菌株X8发酵量最高的培养时间为18h、确定菌株X18发酵量最高的培养时间为18h、确定菌株X21发酵量最高的培养时间为21h、确定菌株X48发酵量最高的培养时间为18 h。在最适培养时间的基础上,通过单因素多水平试验设计,可得产蛋白酶菌株X8的最佳发酵条件:可溶性淀粉5.0‰、初始pH 7.0、培养基盐度10‰、培养温度25℃;X18最佳发酵条件:可溶性淀粉5.0‰、初始pH 7.0、培养基盐度15‰、培养温度30℃;X21最佳发酵条件:蔗糖5.0‰、初始pH 7.0~8.0、培养基盐度15‰、培养温度25℃;X48最佳发酵条件:可溶性淀粉5.0‰、初始pH 7.0、培养基盐度15‰、培养温度25℃。结论:在优化发酵条件下,X8、X18、X21、X48菌株产蛋白酶酶活力分别达到707.06、240.00、441.18、328.22 U/mL。该研究为探索潜在的高产蛋白酶菌株提供了科学依据。
关键词:分离鉴定;发酵条件优化;蛋白酶
由于微生物培养简单方便,微生物蛋白酶易大量发酵生产,因此,微生物蛋白酶日渐成为主要的工业生产酶制剂来源[1-3]。本试验以黄渤海潮间带海域的纹藤壶作为研究对象,对藤壶附生菌进行菌种的分离鉴定,对部分酪蛋白水解圈与菌落直径的比值较大的菌株进行了发酵条件优化、产酶活性测定,得到高产蛋白酶的菌株及其最适的生长条件,对于探索海洋微生物资源、将有机废弃物资源化等具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 纹藤壶,山东省威海市黄海沿海潮间带(北纬37°31′59″,东经122°3′43″);河豚毒素假交替单胞菌、乔治亚海杆菌、杀鱼假交替单胞菌、康氏菌,筛选自纹藤壶样品。
1.1.2 试剂 福林试剂,美国Sigma公司;其他试剂均为国产分析纯。
1.1.3 培养基 菌种富集液体培养基、种子培养基、菌种发酵液体培养基:2216E液体培养基;平板分离固体培养基:2216E固体培养基;酪蛋白酶培養基。
1.2 方法
1.2.1 样品的采集 于威海黄海污染海域岸边礁石上,对样品采用无菌采集。
1.2.2 样品的处理 将纹藤壶机体剥离,均质30s,接种在富集培养液。置28℃、110 r/min震荡培养,分别于第0、7、12、24、36 d涂布展开。
1.2.3 纹藤壶附生菌的分离纯化 富集培养液进行10-1~10-n梯度稀释,分别将菌液用涂布棒涂布于分离固体培养基平板上,28℃下恒温培养48h,依菌落形态筛选目标菌。
1.2.4 高产蛋白酶菌株的筛选 制备纯化菌株的菌悬液,将20μL菌液加入到已点孔的含有1%的酪蛋白酶培养基平板上,酶为阳性对照、pH 7.2的缓冲液为阴性对照。测量蛋白酶水解圈直径。
1.2.5 高产蛋白酶菌株的透射电镜超薄切片观察及鉴定 菌株的透射电镜超薄切片观察:由于光学显微镜的分辨率仅为0.2 μm[4],借助光学显微镜观察菌株体内的情况[5]时,无法清晰观测菌株体内直径在0.2 μm 以下的物质颗粒,而电子显微镜的分辨率可达到1~2nm[6]。所以,应用高放大倍数的透射电镜[7]来对菌体进行精准观察[8]。由青岛大学医学院电镜室拍摄。参照文献[9-10]进行菌株形态学、生理生化测试及分子生物学鉴定。PCR扩增,产物电泳验证后,送至华大基因科技测序。测序结果在GenBank数据库中比对。
1.2.6 高产蛋白酶菌株生长曲线的测定 (1)菌种的复苏和发酵培养:由1.2.3中分离并保存的单个菌落分离纯化。(2)生长曲线测定:取1mL种子培养液接种到50mL菌种发酵液体培养基中,于 28℃、110r/min的摇床中培养。分别于培养的0、3、6、9、12、15、18、21h测定OD600值,每个时间重复测定3次。以4株菌菌液培养时间为横坐标、所测菌液的平均OD600值为纵坐标,绘制出4株菌的生长曲线。
1.2.7 高产蛋白酶菌株发酵条件优化 在各菌株发酵量达到最大的培养时间下,采用单因素试验设计优化发酵条件,考察碳源、培养基初始pH值、培养盐度、培养温度对菌株生长的影响。在初始发酵培养基的基础上考察不同碳源(葡萄糖、麦芽糖、蔗糖、乳糖和可溶性淀粉)对菌株生长的影响,调节培养基的初始pH值,考察培养基初始pH值(4、5、6、7、8、9、10)对菌株生长的影响,考察不同培养基盐度(5‰、10‰、15‰、20‰、25‰、30‰、35‰)对菌株生长的影响,考察不同培养温度(15、20、25、30、35、40℃)对菌株生长的影响。最后在上述最适条件下培养该菌株,确定蛋白酶活力。
1.2.8 蛋白酶活力的测定 酪氨酸标准曲线绘制采用GB/T 23527—2009《蛋白酶制剂》法。以酪氨酸浓度c为横坐标、吸光度A为纵坐标,绘制标准曲线。粗酶液的制备参照文献[11]、蛋白酶活力以X表示,按式(1)计算:
X=c×4×N1×10(1)
式(1)中,c为由标准曲线得出的样品最终稀释液的活力(μg/mL);4为反应试剂的总体积(mL);N为样品的稀释倍数;1为参与反应的酶量(mL);10为反应时间(min)。
2 结果与分析
2.1 菌株的分离、筛选和鉴定
2.1.1 纹藤壶附生菌的分离纯化 经多次分离纯化,从纹藤壶中共获得54种菌株,编号X1~X54。
2.1.2 高产蛋白酶菌株的筛选结果 从纹藤壶附生菌中筛选获得多株产蛋白酶的菌株,通过比较这几株菌的水解圈直径与菌落直径的比值,筛选出4株高产蛋白酶菌株,分别为X8、X18、X21、X48(图1)。
2.1.3 透射电镜观察 由图2可知,X8为球状菌,有鞭毛;X18为杆状菌,有鞭毛;X21为杆状菌,有鞭毛;X48为杆状菌,无鞭毛。
2.1.4 形态学观察及生理生化鉴定结果 依据菌株的形态及生理生化检测结果,进行菌种的初步归属[12-13]。X8菌落呈米白色,表面光滑,湿润,边缘不规则。X18菌产橙色菌落,表面光滑,边缘不规则。X21菌产米黄色菌落,表面光滑,边缘不规则。X48菌落呈白色,表面光滑,边缘整齐。各菌株的生理生化特征见附表。
2.1.5 分子生物学鉴定 经PCR扩增、测序后获得基因序列,比对可知,X8菌株序列与河豚毒素假交替单胞菌的16S rDNA序列同源性为99%。结合透射电镜及形态学观察、生理生化特征测试结果,鉴定菌株X8为河豚毒素假交替单胞菌。X18菌株序列与乔治亚海杆菌的16S rDNA序列同源性高达99%。结合透射电镜及形态学观察、生理生化特征测试结果,鉴定菌株X18为乔治亚海杆菌。X21菌株序列与杀鱼假交替单胞菌的16S rDNA序列同源性高达99%。结合透射电镜及形态学观察、生理生化特征测试结果,鉴定菌株X21为杀鱼假交替单胞菌。X48菌株序列与康氏菌的16S rDNA序列同源性高达99%。结合透射电镜及形态学观察、生理生化特征测试结果,鉴定菌株X48为康氏菌。
2.2 高产蛋白酶菌株的生长曲线
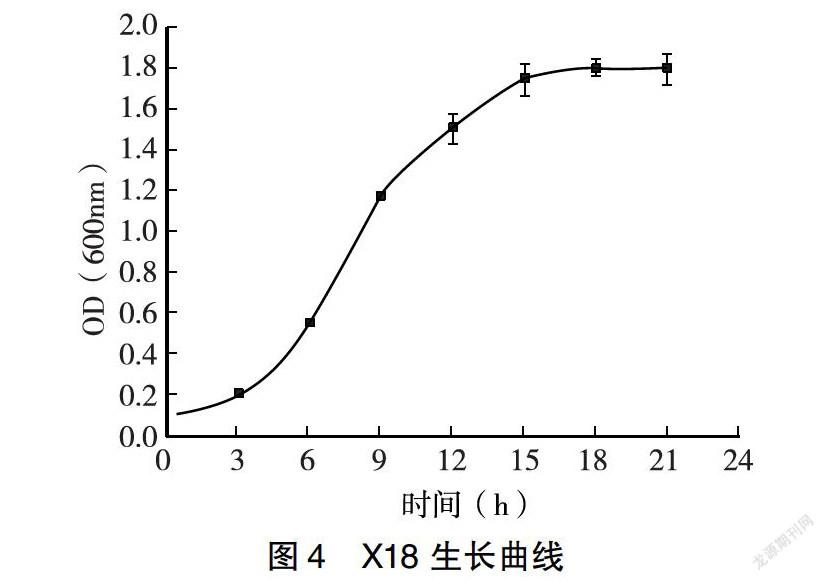
在振荡培养的条件下,测得4株菌培养0、3、6、9、12、15、18、21h的OD600值,每个时间点重复测定3次,取其平均值。细菌的生长是指细菌有规律的增长[14],在生产中,培养条件的差异直接对细菌生长规律、产物的量和生产效率造成影响[15]。菌液的浓度与浑浊度呈正比,浑浊度越大,所测得的OD600值越大,菌液的浓度越大,细菌数量越多。从图3~6中可以看出,随着培养时间的延长,4株菌的OD600值经历了先增大后又逐渐减少的过程,说明4株菌的细菌数量随着培养时间的增加经历了先增多后减少的过程。由图3可知,河豚毒素假交替单胞菌X8在接种后很快开始呈指数增长。0~15h为对数生长期、15~18h为平台期、18h以后为衰亡期,因此,对这种细菌进行研究时,选定18h为最佳培养时间。由图4可知,乔治亚海杆菌X18在0~3h为生长延迟期、3~15h为对数生长期、15~18h为平台期、18h以后为衰亡期。因此,对这种细菌进行研究时,选定18h为最佳培养时间。由图5可知,杀鱼假交替单胞菌X21在0~9h为对数生长期、9~21h为平台期、21h以后为衰亡期。因此,对这种细菌进行研究时,选定21h为最佳培养时间。由图6可知,康氏菌X48在0~12h为对数生长期、12~18h为平台期、18h以后为衰亡期。因此,对这种细菌进行研究时,选定18h为最佳培养时间。
2.3 高产蛋白酶菌株发酵条件优化
2.3.1 碳源对菌株生長的影响 由图7、8、10可知,可溶性淀粉作为碳源时,河豚毒素假交替单胞菌X8、乔治亚海杆菌X18、康氏菌X48可以获得最大培养密度。蔗糖、麦芽糖等次之。由图9可知,蔗糖作为碳源时,杀鱼假交替单胞菌X21可以获得最大培养密度,可溶性淀粉、葡萄糖次之。
2.3.2 培养基初始pH值对菌株生长的影响 由图11~12可知,随着初始pH值升高,河豚毒素假交替单胞菌X8、乔治亚海杆菌X18菌液的密度逐渐增大;当初始pH值>6时,菌液浓度下降。由图13可知,随着初始pH值升高,杀鱼假交替单胞菌X21菌液的浓度逐渐增大;当初始pH值>8时,浓度下降明显。由图14可知,随着初始pH值升高,康氏菌X48菌液浓度增大;当初始pH值>7时,菌液浓度下降。
2.3.3 培养基盐度对菌株生长的影响 由图15可知,随着盐度的升高,河豚毒素假交替单胞菌X8菌液浓度逐渐增大,细菌数量增多;当盐度>10‰时,细菌浓度下降。由图16可知,随着盐度的升高,乔治亚海杆菌X18菌液的浓度逐渐增大;当盐度>15‰时,细菌浓度下降。由图17可知,随着盐度的升高,杀鱼假交替单胞菌X21菌液的浓度逐渐增大;当盐度>15‰时,细菌浓度下降。由图18可知,随着盐度的升高,康氏菌X48菌液的浓度逐渐增大;当盐度>15‰时,细菌浓度开始下降。
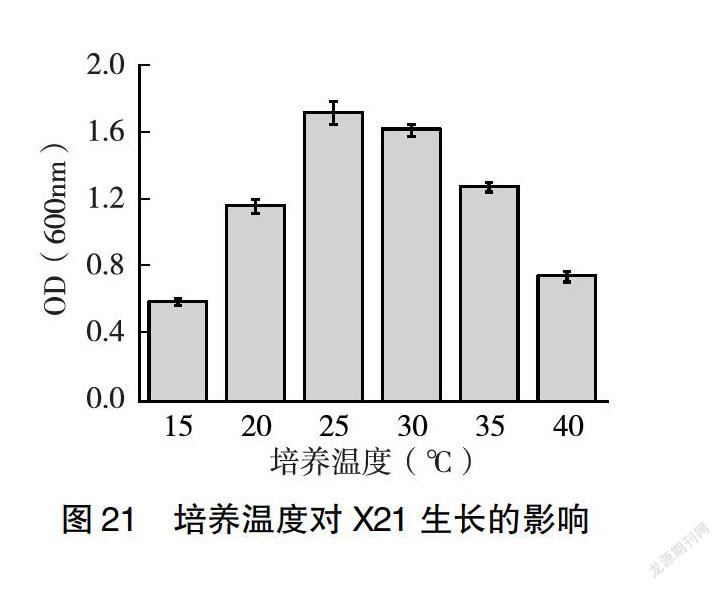
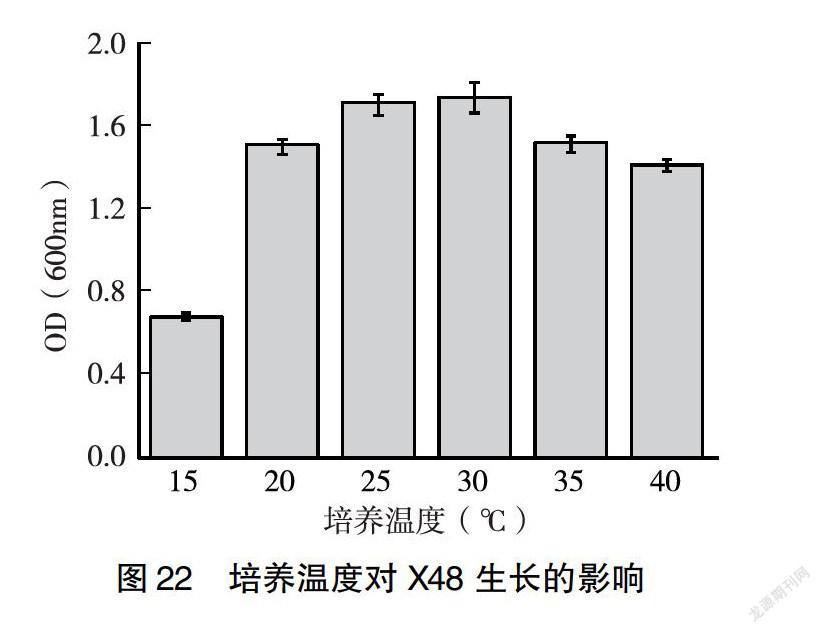
2.3.4 培养温度对菌株生长的影响 由图19、21、22可知,随着培养温度的升高,河豚毒素假交替单胞菌X8、杀鱼假交替单胞菌X21、康氏菌X48菌液的浓度逐渐增大;当温度>25℃时,菌液浓度开始下降。故25℃为发酵的最适温度。由图20可知,随着培养温度的升高,乔治亚海杆菌X18菌液的密度逐渐增大,细菌数量增多;当温度>30℃时,菌液浑浊度开始下降,细菌数量开始下降。故30℃为发酵的最适温度。
2.4 蛋白酶活力的测定
2.4.1 酪氨酸标准曲线 按照前面蛋白酶活力的测定中的操作方法,得到酪氨酸标准曲线回归方程(图23)。该曲线拟合度较好,精密度较高。
2.4.2 福林法测定蛋白酶活力 依据1.2.8蛋白酶活性的测定方法,在优化后发酵条件下,经计算,X8、X18、X21、X48菌株产蛋白酶酶活力分别达到707.06、240.00、441.18、328.22U/mL。
3 结论
本研究从山东沿海污染海域的纹藤壶中筛选得到4株高产蛋白酶的菌株,编号分别为X8、X18、X21、X48,分别鉴定X8为河豚毒素假交替单胞菌(Pseudoalteromonas tetraodonis)、X18为乔治亚海杆菌(Marinobacterium georgiense)、X21为杀鱼假交替单胞菌(Pseudoalteromonas piscicida)、X48为康氏菌(Kangiella japonica)。通过测定菌株的生长曲线,确定菌株X8、X18、X21、X48发酵量最高的培养时间分别为18、18、21、18h。在最适培养时间的基础上,通过单因素试验优化,确定X8菌株产蛋白酶的最优发酵条件:可溶性淀粉5.0‰、初始pH 7.0、培养基盐度10‰、培养温度25℃;X18菌株产蛋白酶的最优发酵条件:可溶性淀粉5.0‰、初始pH 7.0、培养基盐度15‰、培养温度30℃;X21菌株产蛋白酶的最优发酵条件:蔗糖5.0‰、初始pH 7.0~8.0、培养基盐度15‰、培养温度25℃;X48菌株产蛋白酶的最优发酵条件:可溶性淀粉5.0‰、初始pH 7.0、培养基盐度15‰、培养温度25℃。在此优化发酵条件下,X8、X18、X21、X48菌株产蛋白酶酶活力分别达到了707.06、240.00、441.18、328.22U/mL。
4 討论
藤壶食物来源中含大量蛋白类物质,猜想藤壶附生菌中存在产蛋白酶菌株,以帮助其消化、利用食物。本试验以山东沿海污染海域的纹藤壶作为研究对象,对纹藤壶的附生菌进行了分离鉴定,筛选及研究了其中4种高产蛋白酶菌株的发酵条件,在优化后的发酵条件下,X8、X18、X21、X48菌株产蛋白酶酶活力分别达到了707.06、240.00、441.18、328.22U/mL。蛋白酶活力均高于赵海霞等[16,20]从土壤中筛选出的1株蛋白酶酶活性为21.19U/mL的粘质沙雷氏菌,超出约10倍以上;均高于冯爱娟等[17]从腐乳中筛选出的蛋白酶酶活性为97.1U/mL的消瘦芽孢杆菌[20],超出约3倍以上;均高于张力元[18]从海洋中筛选出的蛋白酶活力为218.87U/mL的短小芽孢杆菌;X8、X21菌株的酶活高于袁艳超[19]从芝麻粕中筛选出的酶活为363.57U/mL的淀粉芽孢杆菌。因此,本研究筛选出的4株高产蛋白酶菌株的蛋白酶活力均为较高水平。本试验为进一步研究这4株高产蛋白酶菌株的产酶特性以及在工业领域的应用提供科学依据,对于探索海洋微生物资源、将有机废弃物资源化等具有重要意义。
参考文献
[1]Niyonzima F N,More S.Detergent-compatible proteases:microbial production,properties,and stain removal analysis[J].Prep Biochem Biotech,2015,45(3):233-258.
[2]方海红,胡好远,黄红英,等.微生物碱性蛋白酶的研究进展[J].微生物学通报,2002,29(2):57-59.
[3]张力元.海洋来源产蛋白酶的菌株筛选及其产酶条件的优化研究[D].河北保定:河北农业大学,2014.
[4]葛艳辉,等.聚磷菌胞内聚合物的染色条件优化及染色方法比较[J].环境科学与技术,2014,32(2):1-6.
[5]高信曾.电子显微镜的原理和技术[J].山西农业科学,1980(1):28-29、13.
[6]刘威,任瑞晨.透射电子显微镜在矿物加工与利用中的应用[J].微计算机信息,2010,26(12-1):141-143.
[7]Chen W S,et al.Revealing the structures of cellulose nanofiber bundles obtained by mechanical nanofibrillation via TEM observation[J].Carbohydr Polym,2015(117):950-956.
[8]Srot V,et al.Influence of TEM specimen preparation on chemical composition of Pb(Mg1/3Nb2/3)O3-PbTiO3 single crystals[J].Micron,2014(62):37-42.
[9]Buchanan R E,Gibbens N E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:274-325.
[10]黄文芳.粘质沙雷氏菌的研究Ⅰ-Serratiamarcescens9-2菌株分离、分类鉴定和形态特征[J].华南师范大学学报(自然科学版),2003(3):108-111.
[11]Felsenstein J.Confidence-limits on phylogenies-an approach using the bootstrap[J].Evolution,1985,39(4):783-791.
[12]郑朝成,周立祥.污泥中一株产耐高温蛋白酶菌株的分离、鉴定及酶学特性[J].环境科学学报,2012,32(3):577-583.
[13]Laemmli U K.cleavage of structural proteins during assembly of head of Bacteriophage-T4[J].Nature,1970,227(5259):680-685.
[14]杨国钊,等.嗜水气单胞菌生长曲线的测定及药物敏感性试验[J].畜牧兽医科技信息,2011(9):27-30.
[15]王亚敏.养殖刺参(Apostichopus japonicus)肠道益生菌的筛选[D].大连:大连水产院,2008(6):32-33.
[16]赵海霞,赵培培,陈惠,等.一株产胶原蛋白酶沙雷氏菌的分离及鉴定[J].中国饲料,2012(1):9-11、14.
[17]冯爱娟,叶茂,陈萍柔,等.蛋白酶菌株的筛选与鉴定[J].中国调味品,2017,42(11):49-52.
[18]张力元.海洋来源产蛋白酶的菌株筛选及其产酶条件的优化研究[D].河北保定:河北农业大学,2014.
[19]袁艳超.蛋白酶高产菌株的筛选及其发酵芝麻粕制备芝麻多肽的研究[D].南昌:江西师范大学,2017.
[20]耿芳,等.土壤中高产蛋白酶菌株的筛选鉴定及发酵条件优化[J].中国酿造,2018,37(4):66-71.
Isolation and Identification of Epiphytic Bacteria from Barnacle and Enzymatic Properties of Protease-producing Strains
XU Meng,YANG Zhao-yang,LI Xia-yun,LU Yi-nan,CHEN Yi-fan,XING Xiang
(Marine College of Shandong University,Weihai 264209,China)
Abstract:Objective To study isolate and identify epiphytic bacteria from barnacle and enzymatic properties of protease-producing strains.Method Totally 54 strains were isolated from barnacles in the contaminated coastal waters of Shandong province.Result Totally 4 strains with high protease production were screened by casein test.The strains were identified,the fermentation conditions of protease production were optimized and the enzyme activity was tested.Totally 4 strains of protease-producing strains were screened and identified as X8,X18,X21 and X48,respectively.X8 was identified as Pseudoalteromonas tetraodonis,X18 as Marinobacterium georgiense,X21 as Pseudoalteromonas piscicida and X48 as Kangiella japonica by 16S rDNA sequence analysis,transmission electron microscopy,morphological observation and physiological and biochemical characteristics test.By measuring the growth curve of the strain,it was determined that the highest fermentation time of strain X8 was 18 hours,the highest fermentation time of strain X18 was 18 hours,the highest fermentation time of strain X21 was 21 hours,and the highest fermentation time of strain X48 was 18 hours.On the basis of optimum fermentation time and single factor experiment,the optimum fermentation conditions of protease production by X8 strain were soluble starch 5.0‰,initial pH 7.0,medium salinity 10‰ and culture temperature 25℃.The optimum fermentation conditions of protease production by X18 strain were soluble starch 5.0‰,initial pH 7.0,medium salinity 15‰ and culture temperature 30℃.The optimum fermentation conditions of protease production by X21 strain were sucrose 5.0‰,initial pH 7.0~8.0,medium salinity 15‰ and culture temperature 25℃.The optimum fermentation conditions of protease production by X48 strain were soluble starch 5.0‰,initial pH 7.0,medium salinity 15‰ and culture temperature 25℃.Conclusion Under the optimum fermentation conditions,the protease activity of strains X8,X18,X21 and X48 reached 707.06 U/mL,240.00 U/mL,441.18 U/mL and 328.22 U/mL,respectively.This study provided a preliminary basis for exploring potential protease-producing strains.
Keywords:isolation and identification;fermentation condition optimization;protease
(責任编辑 唐建敏)

