土壤水分含量和接种摩西斗管囊霉(Funneliformismosseae)对伯乐树幼苗生长的影响
王丹丹 魏蓉 张薇 林明琛 陈红锋

摘 要: 该研究测定了伯乐树在不同水分处理(40%、60%、80%、100%)和时间节点下的菌根侵染率,不同水分处理前后接种组和对照组幼苗株高、地径、叶片数等形态指标以及叶片丙二醛含量、幼苗成活率指标。结果表明:(1)相对含水量60%条件下,菌丝、丛枝和总的侵染率最高,40%低水分含量和80%以上高水分含量都不利于菌根真菌对幼苗的侵染。(2)在40%和60%低水分量含量条件下,接种幼苗的丙二醛含量显著低于对照,接种摩西斗管囊霉可提高幼苗对干旱胁迫的抗耐性,但80%和100%高水分含量条件下接种对幼苗的作用不明显。(3)幼苗在自然和接种条件下适宜生长的土壤相对含水量为80%和60%。(4)相同水分条件下,接种幼苗成活率高于对照,其中相对含水量60%下接种幼苗的成活率最高(90%),在40%低水分含量或100%饱和水分含量下,幼苗的成活率都相对较低。
关键词: 摩西斗管囊霉, 水分胁迫, 伯乐树, 成活率
中图分类号: Q943.1 文献标识码: A 文章编号: 1000-3142(2019)07-0976-10
Abstract: In this paper, the mycorrhizal infection rates of Bretschneidera sinensis under different water treatments (40%, 60%, 80%, 100%) and time points were determined. Quantified morphological characteristics of the seedlings such as height, ground diameter, and number of leaves, together with malonaldehyde content and survival rate in the inoculation group and the control group before and after different water treatments were also determined. The results were as follows: (1) Under the condition of relative soil moisture content of 60%, the infection rates of mycelium, arbuscula and the total were the highest, low moisture content (40%) and high moisture content (≥80%) were not conducive to mycorrhizal fungi on the seedlings infestation. (2) The content of malondialdehyde in the inoculated seedlings was significantly lower than that of the control at 40% and 60% treatments, which suggested that inoculation with Funneliformis mosseae could increase seedling resistance to drought stress, but with no obvious effect on treatments of 80% and 100% high moisture content. (3) The relative water content of soil suitable for seedling growth under natural and inoculated conditions was 80% and 60%, respectively. (4) Under the same water conditions, the survival rate of inoculated seedlings was higher than that of the control, with the highest (90%) under 60% treatment, while the survival rate of seedlings was relatively low at 40% low moisture content and 100% saturated moisture content.
Key words: Funneliformis mosseae, water stress, Bretschneidera sinensis, survival rate
伯乐树(Bretschneidera sinensis)又名钟萼木、山桃花,是以我国为分布中心的单种科植物,是第三纪古热带植物区系的孑遗种,在研究被子植物的系统发育、古地理和古气候等方面具有重要科学价值(Chen,1984;Wu,1991)。该种零星分布在我国长江以南部分省区的山林地带,长期以来因其生境破坏严重,现有母树资源稀少、幼苗成活率低、天然更新困难,已处于珍稀濒危的境地,于1999年被列为国家一级重点保护野生植物,并在《中国物种红色名录》中被评估为濒危等级(于永福,1999;汪松和解焱,2004)。
伯乐树生长过程存在两个瓶颈期,分别为由种子到幼苗和由幼苗到成熟植株这两个时期。目前通过物理机械等方法已实现了种子到幼苗的过渡 (伍铭凯等,2006;张季等,2011),但从幼苗到成熟植株过渡的技术问题仍未解决,其根本原因在于尚未明确限制幼苗生长的关键生态因子及其作用机制。伯乐树茎的生态解剖学特征表明,其导管直径较小,水分运输效率不高,相对于成熟植株来说,幼苗对水分运输的要求则更高(费松林等,1999)。加之,伯乐树根尖表面少见根毛分化,也限制了其对水分和矿质营养的吸收。因此,夏季高溫干旱成为了导致伯乐树1年生幼苗高死亡率的主要原因(乔琦等,2010,2011)。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是植物体内常见的一种专性营养共生内生菌根,在地球上有80%的陆生植物的根系可与AMF共生形成丛枝菌根共生体(Smith & Read,2008;Wang & Qiu,2006)。许多研究表明,丛枝菌根真菌有助于提高植物的抗旱性(Brachmann & Parniske,2006;陈婕等,2014;黄化刚等,2017;许平辉等,2017;张菲等,2017;贾振宇等,2017)。摩西斗管囊霉(Funneliformis mosseae,原名摩西球囊霉)是伯乐树原生境土壤中常见的一种AM真菌(乔琦等,2015)。黄久香和庄雪影(2000)报道在伯乐树根际土壤中存在球囊霉属和无梗囊霉属孢子,并在其菌根中发现丛枝和泡囊结构。赵永平等(2018)通过对万寿菊幼苗接种摩西球囊霉等丛植菌根真菌,发现AMF能够减轻胁迫对幼苗的危害,增强植物體的抗逆性。王敏强等(2018)研究发现甜菊接种摩西斗管囊霉后能够提高其耐盐性。乔琦等(2015)在摩西斗管囊霉与伯乐树共生效应的研究中发现摩西斗管囊霉能增强伯乐树幼苗超氧化物歧化酶(superoxide dismutase,SOD)活性,促进幼苗生长。但目前关于不同土壤水分含量和接种摩西斗管囊霉对伯乐树幼苗生长的影响方面的研究未见报道。
本研究选取伯乐树生境土壤中常见的摩西斗管囊霉作为供试丛枝菌根真菌,通过测定不同水分处理和时间节点的菌根侵染率,水分处理前后幼苗株高、地径、叶片数等形态指标,叶片中丙二醛含量以及幼苗成活率等,探讨不同水分处理和接种摩西斗管囊霉对伯乐树幼苗生长和存活能力的影响,为摸清限制伯乐树幼苗生长的关键生态因子及其作用机制研究提供理论依据。
1 材料与方法
1.1 材料和处理
1.1.1 供试植物 伯乐树的成熟种子于2016年11月采集自广东南昆山国家级森林公园(113°53′ E,23°38′ N)。种子千粒重为1 786.0 g。将除去橘红色假种皮后的种子置于育苗盘中用湿沙积存,于2017年1月起陆续萌发,4月初,待苗高20 cm时移至灭菌基质中。
1.1.2 试验地点与供试基质 试验实施地位于广州华南植物园实验基地(113°21′ E,23°10′ N),试验在半控制状态下的温室大棚中进行(仅遮雨,一层遮阴网)。供试基质为泥炭∶椰糠∶河沙比例为1∶1∶2,混合均匀后装入无纺布袋置于高压蒸汽灭菌锅0.15 MPa、温度约120 ℃灭菌2 h。晾晒一周后装盆,花盆底径约16 cm。基质干重为每盆1 470.0 g,最大持水量为0.76。
1.1.3 供试菌种 试验所用的丛枝菌根真菌菌种为摩西斗管囊霉,由北京市农林科学院植物营养与资源研究所“丛枝菌根真菌种质资源库(BGC)”提供。菌种接种剂由真菌孢子、菌丝、侵染根段等繁殖体以及混合基质组成。将摩西斗管囊霉菌土混合均匀,采用三点接种法每盆接种菌土14.0 g,共接种80盆植株。
1.1.4 试验设计与方法 试验设一个接种摩西斗管囊霉菌土处理(A组)和一个空白对照CK(B组)。每盆定植1株幼苗,A组每盆接种14.0 g菌剂。接种后2个月正常进行浇水养护,每两周施一次减磷配方Hoagland营养液(王幼珊等,2012)。空白对照B组未接种菌剂,与A组水肥养护条件相同。A、B两组于2017年7月1日开始进行水分处理,7月31日结束,土壤相对含水量设置4个梯度,分别维持在40%、60%、80%和100%水平。每盆土壤干重均为(1 470.0±5)g,水分处理后各组重量分别为(2 000.0±5) g、(2 200.0±5)g、(2 400.0±5) g、(2 600.0±5) g(土壤相对含水量=土壤含水量/田间持水量×100%)。共计4×2组处理,每组处理16次重复(各16盆)。供试容器是口径、高度、底径分别为180 mm、180 mm、140 mm的塑料育苗盆。水分处理结束后恢复浇水,30 d后(2017年8月30日)观察记录各组处理成活株数、计算成活率。定期测定株高、基径、叶片数、小叶数。在进行水分处理之前(接种后45 d)、水分处理开始时(接种后60 d)、水分处理中期(接种后75 d)、水分处理结束时(接种后90 d),测定各处理菌根侵染率。在水分处理期间,每10 d测量一次叶片丙二醛(malonaldehyde,MDA)含量。
1.2 指标测定
1.2.1 形态指标 每个处理选取9株幼苗于水分处理开始和结束时,分别使用直尺、电子游标卡尺测定株高、基径。水分处理开始后每15 d观察记录一次叶片数、小叶数。水分处理30 d时结束,植株恢复正常养护。
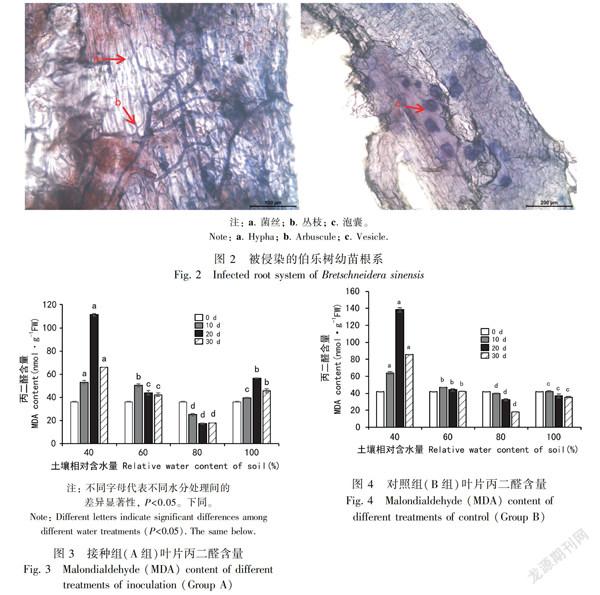
1.2.2 菌根侵染率 在进行水分处理之前(接种后45 d)、水分处理开始时(接种后60 d)、水分处理中期(接种后75 d)、水分处理结束时(接种后90 d),对接种组(A组)的植株和对照组(B组)进行采样测定。每个处理选取3株幼苗取鲜根系,切成1 cm左右的根段,清水冲洗干净后,用FAA固定液固定。将根段用Trypanblue染色法,选取40条根段制片,在光学显微镜下(Leica DM2000)用40倍物镜观察菌丝、丛枝和泡囊结构,每个视野出现菌丝、丛枝或泡囊中的任何一种形态,即为相应形态计数加1,同时为总侵染率加1;若每个视野中出现2种或以上结构,则每种结构计数分别加1,同时总侵染率计数加1。每个样品共观察200个视野。
丛枝菌根侵染率计算公式:总侵染率(TC)=总侵染计数/200×100%;菌丝侵染率(HC)=菌丝侵染计数/200×100%;丛枝侵染率(AC)=丛枝侵染计数/200×100%;泡囊侵染率(VC)=泡囊侵染计数/200×100%。
1.2.3 丙二醛(MDA) 采用硫代巴比妥酸法(李合生,2000),每个处理选取3株幼苗取相同位置的小叶0.3 g,洗净擦干后放入预冷的研钵中,加少许石英砂和2.0 mL 10%TCA,冰浴研磨成匀浆,将其转移到离心管中,再用3.0 mL TCA冲洗研钵和研棒数次并转移至离心管,所得匀浆在3 000 r·min-1下离心10 min,将上清液转入带塞试管中并用10%TCA溶液定容至5.0 mL(V0)。取上清液2.0 mL于带塞试管中,加入0.5%TBA2.0 mL,混合后(Vm)沸水浴20 min,迅速冷却后再离心,上清液分别于532、600、450 nm处测OD值。实验所用仪器:上海舜宇恒平FA2004电子分析天平、北京永光明XMTD-4000电热恒温水浴锅、湘仪H-2050R台式高速冰冻离心机、上海佑科UV759CTR紫外可见分光光度计。
式中,A450、A532、A600分别代表450、532、600 nm波长下的吸光度值。V0代表样品提取液的总体积(mL);Vs代表显色反应中样品液的提取体积(mL);W代表植物叶片鲜重(g)。
1.2.4 成活率 恢复正常养护后30 d观察记录各处理成活株数,计算成活率。成活率=每组处理成活植株数/每组处理植株总数×100%。
1.3 数据分析
所得数据用Microsoft Excel软件进行整理并作图,用SPSS 22.0软件对数据进行方差分析,用LSD 法多重比较平均数间的差异显著程度(平均数±标准偏差,P<0.05)。
2 结果与分析
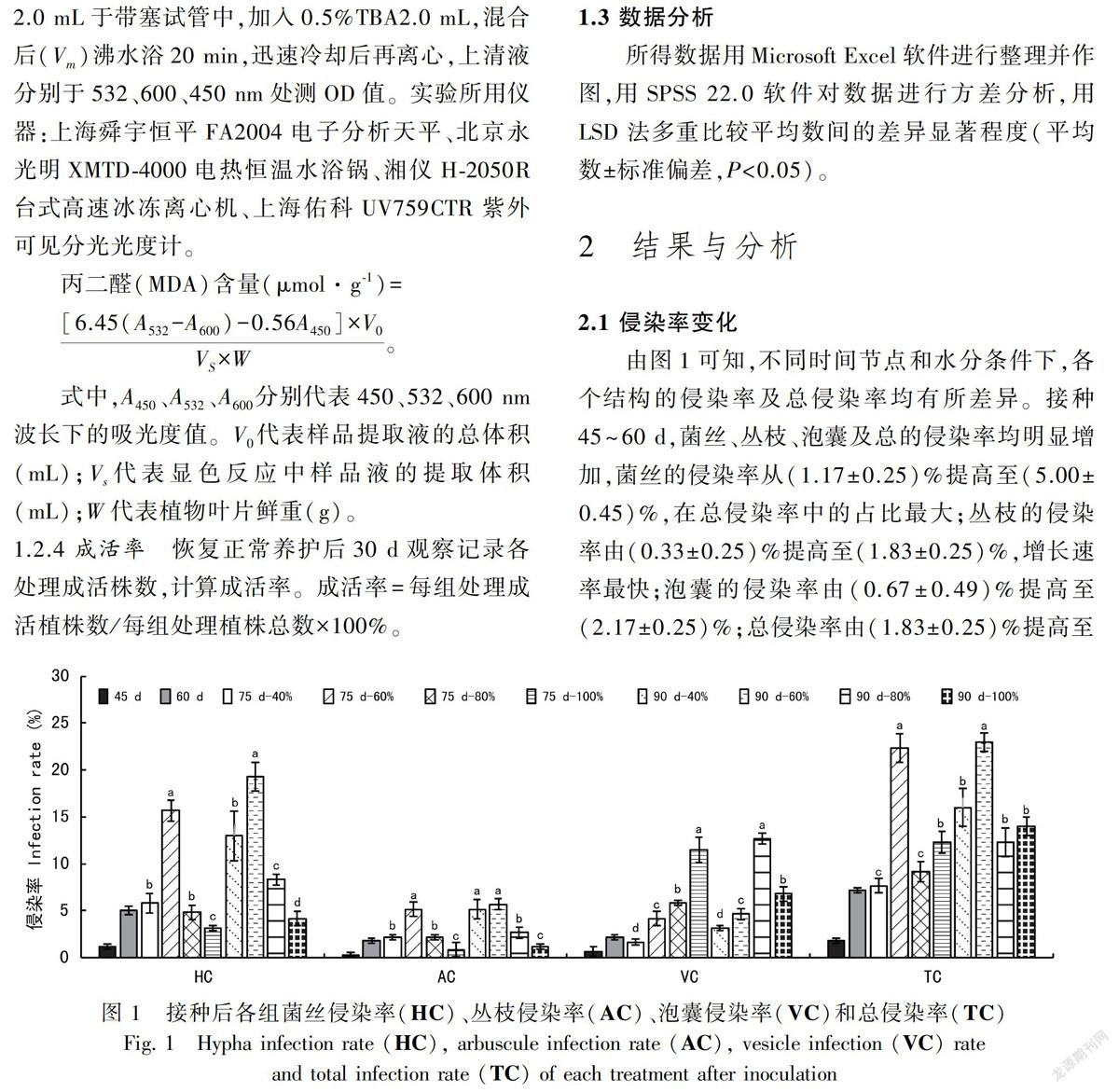
2.1 侵染率变化
由图1可知,不同时间节点和水分条件下,各个结构的侵染率及总侵染率均有所差异。接种45~60 d,菌丝、丛枝、泡囊及总的侵染率均明顯增加,菌丝的侵染率从(1.17±0.25)%提高至(5.00±0.45)%,在总侵染率中的占比最大;丛枝的侵染率由(0.33±0.25)%提高至(1.83±0.25)%,增长速率最快;泡囊的侵染率由(0.67±0.49)%提高至(2.17±0.25)%;总侵染率由(1.83±0.25)%提高至(7.17±0.25)%。
水分处理开始后,各水分处理间侵染率的差异逐渐显现。在75 d时,相对含水量60%下,菌丝、丛枝和总侵染率均最高,分别为(15.67±1.15)%、(5.17±0.76)%、(22.33±1.53)%,而在相对含水量80%和100%下,三者的侵染率均有所降低。在90 d时也出现了类似的结果,且菌丝、丛枝和总侵染率均高于60 d时,分别为(19.33±1.53)%、(5.67±0.58)%、(23.00±1.00)%,可能是随着时间的延长,在60%以下低水分含量下有利于菌丝、丛枝增殖并对根系持续侵染,而在80%以上高水分含量不利于菌丝、丛枝增殖和侵染。泡囊表现出在80%以上高水分含量下的侵染率要高于60%以下低水分含量下的侵染率,70 d时,相对含水量100%下,泡囊的侵染率最高,为(11.50±1.32)%;而90 d时,相对含水量80%下,泡囊的侵染率最高,为(12.67±0.58)%。Pearson相关性分析得出,水分与泡囊侵染率呈显著正相关(P=0.001),表明水分含量大,菌根真菌更易形成泡囊结构。
摩西斗管囊霉在水分处理前对植株的侵染率较低,幼苗根部皮层组织内只可见少量菌丝、泡囊和丛枝结构(图2),水分处理后的各个总侵染率[(7.67±0.76)%~(23.00±1.00)%]高于处理前[(1.83±0.25)%~(7.17±0.25)%],其原因可能是由于随着时间的延长,根系不断增长,同时菌根真菌各种结构不断增殖,二者的接触几率增大,总侵染率提高。
2.2 不同水分处理下叶片丙二醛(MDA)含量的变化
丙二醛是植物在受胁迫时产生的一种物质,在一定程度上可反映植物受环境胁迫的情况(赵永平等,2018)。由图3和图4可知,接种组和对照组叶片中丙二醛含量的变化趋势大体相同:随着水分处理的进行,含水量为40%组别的丙二醛含量先上升后下降,接种组为(36.12±0.13)、(53.01±1.53)、(111.47±1.08)、(65.84±0.10) nmol·g-1FW,对照组为(41.92±0.40)、(63.76±1.68)、(138.35±2.39)、(85.55±0.38) nmol·g-1FW,二组均在20 d时达最高,且接种组丙二醛含量低于对照组含量;60%含水量处理组先上升后下降,接种组为(36.12±0.13)、(50.27±1.32)、(44.0±1.93)、(42.17±1.45) nmol·g-1FW,对照组为(41.92±0.40)、(47.04±0.38)、(124.15±1.33)、(42.25±0.32) nmol·g-1FW;80%含水量处理组丙二醛含量持续缓慢下降;100%含水量组别先升高而后下降,接种组为(36.12±0.13)、(39.45±0.59)、(56.58±0.10)、(45.39±1.72) nmol·g-1FW,对照组为(41.92±0.40)、(42.38±0.84)、(37.01±2.30)、(35.62±0.91) nmol·g-1FW。通过丙二醛含量的升降变化情况推断,当土壤相对含水量低于60%时,伯乐树幼苗受到一定程度的干旱胁迫,而土壤相对含水量超过80%时,会对幼苗产生一定的湿害。接种摩西斗管囊霉降低了幼苗中丙二醛含量,有利于增强幼苗对干旱胁迫的抗耐性。
2.3 幼苗形态指标变化
表1结果表明,水分处理前(接种60 d),接种组与对照组之间株高、基径、复叶数、小叶数等指标均无显著差异(P>0.05)。由表2可知,对于接种组来说,水分处理后第30天,株高没有显著差异,相对含水量60%下的株高增长量[(3.03±0.91) cm]、基径增长量[(1.76±0.33) mm]显著高于其他处理。在未接种组中,相对含水量80%下,株高增长量[(2.02±0.20) cm]、基径增长量[(1.84±0.16) mm]均高于其他处理。从表3结果来看,两组复叶数、小叶数均呈下降趋势,水分处理开始第15天,各组差异不显著。第30天时,接种组60%相对含水量状态下的复叶数、小叶数多于其他组;在对照组中,80%相对含水量状态下的复叶数、小叶数优于其他组。综上所述,相对含水量60%下,接种幼苗的生长情况较优,幼苗在无接种的自然状态下,适宜生长的土壤相对水分含量为80%左右。但在低含水量(40%和60%)条件下,接种组株高增长量和基径增长量均高于未接种组,而在高含水量(80%和100%)时出现了相反的情况。
2.4 幼苗成活率
由表4可知,恢复正常养护30 d后各组成活率,相同水分条件下,接种组(A组)的成活率均高于对照组(B组), 表明接种摩西斗管囊霉对提高伯乐树一年生幼苗的成活率有一定作用。接种组在相对含水量60%下成活率最高(90%),未接种组幼苗在相对含水量80%下的成活率最高(85%)。在40%低水分含量或100%饱和水分含量下,幼苗的成活率都相对较低,不利于幼苗生长,特别在相对水分含量40%条件下尤为明显,表明干旱对幼苗的成活率影响较大。
3 讨论
3.1 不同水分含量对摩西斗管囊霉侵染率的影响
García et al.(2008)对细叶百脉根(Lotus tenuis)AM真菌研究发现在水分过多或亏损时,丛枝、菌丝结构的形成会减少,而水分过多时抗性结构泡囊的形成率提高256%,水分亏损对其影响不大。本研究得出,不同水分条件影响摩西斗管囊霉菌丝、泡囊和丛枝结构及总的侵染率。在土壤相对含水量60%时,菌丝、丛枝对幼苗的侵染率达到最大,当相对含水量为100%时,菌丝和丛枝的侵染率显著低于相对含水量80%和60%处理。
3.2 接种摩西斗管囊霉对幼苗水分胁迫生理的影响
接种AMF能增强植物的抗性。莫言玲等(2016)研究干旱胁迫下接种地表球囊霉对西瓜生长影响,发现接种AMF可以提高幼苗的叶片相对含水量和叶绿素含量, 促进植株的生长,特别是促进根系的生长。接种AMF处理缓解了干旱对叶绿体的伤害效应。吴强盛等(2006)研究发现,接种丛枝菌根真菌降低了柑橘叶片和根系的MDA、H2O2和O2- · 含量,提高各种抗氧化酶(如SOD、POD、CAT、GR和APX)活性和各种抗氧化剂(ASC、GSH)含量,从而减轻水分胁迫产生的氧化破坏,使菌根化柑橘在水分胁迫下处于更有利的地位。乔琦等(2015)研究发现摩西斗管囊霉可增强伯乐树幼苗超氧化物歧化酶活性,明显增加可溶性糖含量、叶绿素含量与水分含量,促进幼苗生长和提高成活率。而通过丙二醛含量变化分析接种AMF对伯乐树的抗性影响方面还需进一步研究。
当植物受到胁迫时,植物体内活性氧的产生与清除这个平衡将可能被破坏,随着胁迫时间的延长和胁迫程度的加重,由超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(AsAPOD)及非酶类抗氧剂如抗坏血酸(ASC)、谷胱甘肽(GSH)等组成的活性氧清除系统的功能逐渐降低,活性氧积累得越来越多,最终使细胞膜发生膜质过氧化并发生自由基链式反应,形成丙二醛(MDA),使细胞膜流动性下降,膜功能受到伤害。MDA 的积累可能对膜和细胞造成一定的伤害,它在一定程度上也反映植物受环境逆境胁迫的情况,并在逆境胁迫下植物的抗性与MDA 含量呈负相关(赵永平等,2018)。本研究中,接种组和对照组丙二醛含量在60%以下低含水量(干旱胁迫)情况下表现先升后降趋势,且接种组丙二醛含量显著低于未接种组,在这种胁迫条件下,丙二醛含量显著降低可能是由于接种后,AMF刺激了抗氧化酶系统,抗氧化酶系统去除了活性氧,膜脂受到的过氧化作用减弱,从而产生的丙二醛量下降。丙二醛含量降低,说明膜功能损害程度小,反映出接种摩西斗管囊霉在一定程度上提高了幼苗对水分胁迫的抗耐性。100%含水量(湿害)处理组丙二醛含量出现先升后降,表明幼苗受到一定的湿害,接种组的丙二醛含量高于对照组,可能由于高水分条件下摩西斗管囊霉总侵染率下降,且不利于菌丝、丛枝等结构的形成,摩西斗管囊霉发挥的作用并不明显。
3.3 不同水分含量对幼苗生长和存活的影响
丛枝菌根的侵染会促进或改善植物根系对水分和矿质营养的吸收,提高根系含水量(李晓林和曹一平,1993;Smith, 2001;Aroca et al.,2007),改善根际微环境(Harrison,1999;Shenoy & Kalagudi, 2005;马俊卿等,2018),从而促进植物的生长。本研究结果显示,在接种条件下伯乐树幼苗在相对含水量60%下生长得最好且成活率最高。由于相对含水量60%下菌丝、丛枝和总侵染率均最高,说明相对含水量60%是既利于幼苗生长又利于摩西斗管囊霉侵染的适宜条件,接种摩西斗管囊霉有利于提高幼苗在干旱胁迫下生长的能力。但在高含水量(80%和100%)时接种组株高增长量和基径增长量均低于未接种组,出现了与在低含水量(40%和60%)条件下相反的情况,前者后者可能由于幼苗对短期的水分胁迫有一定的耐受力。在不接种的条件下,伯乐树幼苗在相对含水量80%下生长较好,表明土壤水分含量跟AMF之间存在交互作用,即接种摩西斗管囊霉能够使伯乐树幼苗在更低的水分条件下生长和存活。在相同的相对含水量条件下接种组成活率均高于未接种组,可能由于菌根菌侵染与植物形成共生关系,增强了植物抵抗水分胁迫的能力,提高了成活率。100%高含水量状态下幼苗成活率显著高于40%低含水量状态下的,可能由于伯乐树幼苗对短期的水分胁迫具有一定的耐受力,而对干旱胁迫则更为敏感。
4 结论
本研究通过对接种摩西斗管囊霉和不同水分处理前后的侵染率、形态和生理指标及成活率分析,得出不同水分条件影响摩西斗管囊霉菌絲、泡囊和丛枝结构及总的侵染率,在土壤相对含水量60%条件下适宜菌根真菌的侵染。40%低水分含量和80%以上高水分含量都不利于菌根真菌对幼苗的侵染。在40%和60%低水分量含量条件下,接种幼苗的丙二醛含量显著低于对照,表明接种摩西斗管囊霉可提高幼苗对干旱胁迫的抗耐性,但80%和100%高水分含量条件下接种对幼苗的作用不明显;在不同水分含量对幼苗生长和存活的影响方面,相对含水量60%是既利于幼苗生长又利于摩西斗管囊霉侵染的适宜水分条件,接种摩西斗管囊霉有利于提高幼苗在干旱胁迫下生长的能力。伯乐树幼苗对短期的水分胁迫具有一定的耐受力,而对干旱胁迫则更为敏感。幼苗在自然条件下适宜生长的土壤相对含水量为80%;相同水分条件下,接种幼苗成活率高于对照,接种摩西斗管囊霉有利于提高幼苗的成活率,其中相对含水量60%下接种幼苗的成活率最高,在40%低水分含量或100%饱和水分含量下,幼苗的成活率都相对较低。本研究为解决伯乐树繁育关键技术问题,推进解濒和保育工作提供了参考。
致谢 中国科学院华南植物园唐旭利研究员、叶文副研究员、刘海林助研对本研究工作和论文撰写提出了很好的意见和建议,在此表示感谢!
参考文献:
AROCA R, PORCEL R, RUIZ-LOZANO JM, 2007. How does arbuscular mycorrhizal symbiosis regulate root hydraulic properties and plasma membrane aquaporins in Phaseolus vulgaris under drought, cold or salinity stresses? [J]. New Phytol, 173(4):808-816.
BRACHMANN A, PARNISKE M, 2006. The most widespread symbiosis on earth [J]. Plos Biol, 4(7):1111-1112.
CHEN J, XIE J, TANG M, 2014. Effects of arbuscular mycorrhizal fungi on the growth and drought resistance of Amorpha fruticosa under water stress [J]. J Beijing For Univ, 36(6):142-148. [陈婕, 谢靖, 唐明, 2014. 水分胁迫下丛枝菌根真菌对紫穗槐生长和抗旱性的影响 [J]. 北京林业大学学报, 36(6):142-148.]
CHEN WQ, 1984.Bretschneideraceae [M]. Beijing:Science Press: 8-10.
FEI SL, FANG JY, FAN YJ, et al., 1999. Anatomical characteristics of leaves and woods of Fagus lucida and their relationship to ecological factors [J]. Acta Bot Sin, 41(9):1002-1009. [费松林, 方精云, 樊拥军, 等,1999. 贵州梵净山亮叶水青冈叶片和木材的解剖学特征及其与生态因子的关系 [J]. 植物学报, 41(9):1002-1009.]
GARCA I, MENDOZA R, POMAR MC, 2008. Deficit and excess of soil water impact on plant growth of Lotus tenuis by affecting nutrient uptake and arbuscular mycorrhizal symbiosis [J]. Plant Soil, 304:117-131.
HARRISON MJ, 1999. Molecular and cellular aspects of the arbuscular mycorrhizal symbiosis [J]. Ann Rev Plant Biol, 50:361-389.
HE XL, ZHANG HS, ZHAO LL, 2008. Effects of AM fungi and water stress on drought resistance of Artemisia ordosica in different soils [J]. J Plant Ecol, 32(5):994-1001. [賀学礼, 张焕仕, 赵丽莉, 2008. 不同土壤中水分胁迫和AM真菌对油蒿抗旱性的影响 [J]. 植物生态学报, 32(5):994-1001.]
HUANG HG, L LX, ZHANG YM, et al., 2017. Microbe-assisted drought resistance for tobacco plants: Mechanisms and applications [J]. Chin J Appl Ecol, 28(9):3099-3110. [黄化刚, 吕立新, 张艳茗, 等, 2017. 微生物帮助烟草抗旱的机理及其应用 [J]. 应用生态学报, 28(9):3099-3110.]
HUANG JX, ZHUANG XY, 2000. Mycorrhizal study on three national secondary protection plants of Chebaling nursery [J]. J S Chin Agric Univ, 2:38-41. [黄久香, 庄雪影, 2000. 车八岭苗圃三种国家二级保护植物的菌根研究 [J]. 华南农业大学学报, 2:38-41.]
JIA ZY, YU J, DE Y, et al., 2017. The effect of arbuscular mycorrhiza fungi on drought resistance of Leymus chinensis [J]. J Arid Land Resour Environ, 31(1):132-136. [贾振宇, 于洁, 德英, 等, 2017. 丛枝菌根真菌接种对羊草抗旱性的影响 [J]. 干旱区资源与环境, 31(1):132-136.]
LI HS, 2000. Principles and techniques of plant physiology and biochemistry experiment [M]. Beijing:Higher Education Press: 192-194. [李合生, 2000. 植物生理生化实验原理和技术 [M]. 北京:高等教育出版社:192-194. ]
LI XL, CAO YP, 1993. The mechanism of VA mycorrhizal absorption of mineral nutrients [J]. Soil, 25(5):274-277. [李晓林, 曹一平, 1993. VA 菌根吸收矿质养分的机制 [J]. 土壤, 25(5):274-277.]
MA JQ, WEI ZL, QIN JL, et al., 2018. Investigation on types of AM fungi in rhizospheresoil of wild Artemisia annua L. in Guangxi [J]. J Southern Agric, 49(5):870-876. [马俊卿, 韦竹立, 覃京龙, 等, 2018. 广西野生黄花蒿根际土壤AM真菌类型调查分析[J]. 南方农业学报, 49(5):870-876.]
MO YL, 2016. The mechanism of watermalon in response to drought stress and the mitigation effict of AMF [D]. Yangling:Northwest A & F University:117-119. [莫言玲, 2016. 西瓜对干旱胁迫的响应机制及丛枝菌根真菌的缓解效应 [D]. 杨凌:西北农林科技大学: 117-119.]
QIAO Q, GUO XF, XING FW, et al., 2015. Symbiosis effect of Glomus eburneun on seed of Bretschneidera sinensis [J]. J Zhejiang For Sci Technol, 35(3):43-46. [喬琦, 郭幸飞, 邢福武, 等, 2015. 摩西球囊霉与伯乐树的共生效应研究 [J]. 浙江林业科技, 35(3):43-46.]
QIAO Q, QIN XS, XING FW, et al., 2011. Death causes and conservation strategies of the annual regenerated seedlings of rare plant, Bretschneidera sinensis [J]. Acta Ecol Sin, 31(16):4709-4716. [乔琦, 秦新生, 邢福武, 等,2011. 珍稀植物伯乐树一年生更新幼苗的死亡原因和保育策略 [J]. 生态学报, 31(16):4709-4716.]
QIAO Q, WEN XY, CHEN HF, et al., 2010. Ecological anatomy of the root in Bretschneidera sinensis, a threatened endemic plant in China [J]. J Wuhan Bot Res, 28(5):544-549. [乔琦, 文香英, 陈红锋, 等, 2010. 中国特有濒危植物伯乐树根的结构特征 [J]. 武汉植物学研究, 28(5):544-549.]
SHENOY VV, KALAGUDI GM, 2005. Enhancing plant phosphorus use efficiency for sustainable cropping [J]. Biotechnol Adv,23:501-513.
SMITH FW, 2001. S and P transport systems in plants [J]. Plant Soil, 232:109-118.
SMITH SE, READ DJ, 2008. Mycorrhizal symbiosis [M]. London:Academic Press.
WANG B, QIU YL, 2006. Phylogenetic distribution and evolution of mycorrhizas in land plants [J]. Mycorrhiza, 16:299-363.
WANG MQ, WU PH, SHEN YK, et al., 2018. Effects of arbuscular mycorrhizal fungus on the growth and nitrogen and phosphours acquisition of salt stressed Stevia rebaudiana [J]. Chin J Appl Ecol, http://kns.cnki.net/kcms/detail/51.1482.Q.20180319.1558.015.html. [王敏强, 吴沛鸿, 沈益康, 等, 2018. 盐胁迫下接种AM真菌对甜菊生长和氮磷吸收的影响 [J]. 应用生态学报, http://kns.cnki.net/kcms/detail/51.1482.Q.20180319.1558.015.html.]
WANG S, XIE Y, 2004. China species red list(Vol.I) [M]. Beijing: Higher Education Press. [汪松, 解焱, 2004. 中国物种红色名录(第一卷) [M]. 北京:中国高等教育出版社.]
WANG YS, ZHANG SB, ZHANG MQ, 2012. China arbuscular mycorrhizal fungi and resources [M]. Beijing:China Agriculture Publishing House:175-176. [王幼珊, 张淑彬, 张美庆, 2012. 中国丛枝菌根真菌资源与种质资源 [M]. 北京:中国农业出版社:175-176.]
WU MK, YANG HY, LONG W, et al., 2006. A study on the seedling cultivation of Bretschneidera sinensis Hemsl. [J]. Guizhou For Sci Technol, 34(4):39-41+38. [伍铭凯, 杨汉远, 龙舞, 等,2006. 伯乐树种子育苗试验 [J]. 贵州林业科技, 34(4):39-41+38.]
WU QS, 2006. Study on effect and mechanism of arbuscular mycorrihizal fungi in drought resistance of citrus [D]. Wuhan:Huazhong Agricultural University:36-40. [吴强盛, 2006. 丛枝菌根真菌对柑橘抗旱性的作用及其机理研究 [D]. 武汉:华中农业大学:36-40.]
WU ZY, 1991. The areal-types of Chinese genera of seed plants [J]. Acta Bot Yunnan, 13(S4):1-3.
XU PH, WANG FQ, QI YG , et al., 2017. The effects of mycorrhizal fungi on the drought resistance of Camellia sinensis L. [J]. Acta Agric Boreal-Occident Sin, 26(7):1033-1040. [许平辉, 王飞权, 齐玉岗, 等, 2017. 丛枝菌根真菌对茶树抗旱性的影响 [J]. 西北农业学报, 26(7):1033-1040.]
YU YF, 1999. List of national key protection wild plants(1st batch) [J]. Life World, 151(5):4-11. [于永福, 1999. 国家重点保护野生植物名录(第一批) [J]. 植物杂志, 151(5): 4-11.]
ZHANG F, NI QD, ZOU YN, et al., 2017. Preliminary study on the mechanism of AMF in enhancing the drought tolerance of plants [J]. J Fungal Res, 15(1):8-13. [张菲, 倪秋丹, 邹英宁, 等, 2017. AMF增强枳抗旱性作用机制的初步研究 [J]. 菌物学报, 15(1):8-13.]
ZHANG J, TIAN HL, WANG YQ, et al., 2011. Comparison of seeds and seedling growth for 3 different geographical provenances of Bretschneidera sinensis [J]. Chin J Trop Agric, 31(5):12-15. [张季, 田华林, 王玉奇, 等, 2011. 3个不同地理种源的伯乐树种子和苗期生长差异比较 [J]. 热带农业科学, 31(5):12-15.]
ZHAO YP, YANG P, ZHU Y, et al., 2011.Effects of arbuscular mycorrhizal fungi on physiological characteristics of seedlings of different marigold (Tagetes erecta) varieties [J]. Acta Agric Jiangxi, 30(3):102-105. [趙永平, 杨萍, 朱亚, 等, 2018. 丛枝菌根真菌对不同品种万寿菊幼苗生理特性的影响 [J]. 江西农业学报, 30(3):102-105.]

