叶绿素自动监测法与传统监测法比对分析研究
左新宇 程帅 徐浩 刘陈飞 黄昱






摘要:为了研究自动监测与传统监测所得数据是否具有可比性,2018年1-6月在三峡库区支流4个自动监测站点开展每月1次的叶绿素比对监测,对获得的24对数据进行了相关性分析、显著性检验和偏差分析。结果表明,自动监测和传统监测所得数据显著性相关,但同时也存在显著性差异,偏差大部分在15%以内。造成该差异性的主要原因有方法原理的不同和杂质干扰等。因此叶绿素自动监测尚无法取代传统常规监测,但其具有较好的时效性、可比性以及高灵敏度,在应急监测、在线监测等方面具有独特优势。自动监测可与传统监测相互配合和补充,以更好地服务于水环境水生态的监测管理和保护。
关键词:叶绿素监测;自动监测;比对监测;比对分析
中图法分类号:X832
文献标志码:A
DOI: 10.15974/j.cnki.slsdkb.2019.08.011
1 研究背景
随着经济和社会发展,采取每月定期或不定期的人工采样方式对水环境和水生态质量进行监测,已难以满足人们日益增长的对数据量以及数据质量的要求。自动监测是通过自动化仪器完成机械的采集和分析工作,可降低人工成本,提高工作效率。自动监测仪器可通过设置监测频次實现逐日监测、每小时监测,甚至不间断监测,从而采集到频次更密集、更详细的数据,并且能及时传送至数据管理中心,极大提高了监测数据的完整性和时效性,有助于掌握水体总体情况,提高对突发状况的认识程度和应急反应能力,从而更好地服务于水环境水生态的分析评价和管理保护。
水体中的藻类种类和生物量是影响水质的重要因素之一,也是表征水体富营养化状况的重要指标之一。叶绿素广泛存在于植物体中,叶绿素a是所有浮游植物门类均含有的叶绿素类型[1]。叶绿素的含量作为估算浮游植物生物量的重要指标,其含量的测定也是研究水体初级生产力和富营养化水平的有效方法。
目前,实验室进行叶绿素监测的主要方法有分光光度法、高效液相色谱法和荧光光度法等[2-4]。采取以上方法提取藻类叶绿素都需要经过样品采集、浓缩、破碎、浸提等前处理过程,需要实验室提供相应的设备[5],且采样、送样、提取、测量过程步骤多、耗时较长,难以满足水资源、水环境、水生态监测与管理对效率和时效性的要求。
叶绿素受光激发后会发射荧光,基于该性质,可采用活体荧光分析法(即体内荧光法)在水体原位测量叶绿素的含量。测量仪器通过自带的光源释放一定波长的光,水中的叶绿素吸收该光后,受到激发,释放出波长更长的荧光。通过测量所释放光的强度,来测量水中叶绿素的含量。该方法无需前处理,操作简单,灵敏度高,量程大,适用于叶绿素的应急监测和在线监测。目前已有多款多参数水质监测仪采用该方法进行测量[5]。
已有学者对自动监测能否能替代传统监测等问题进行了研究,并得出了不同的结论[6-7]。对于两种监测方法得出数据产生差异的原因,还需要进一步的比对研究和探讨。
基于2018年布设在三峡库区支流的4个野外自动监测站的数据,每月开展1次自动监测与采用传统分光光度法测量叶绿素的比对监测。分析了自动监测仪器野外条件下的监测数据,对其与实验室传统监测数据的相关性、差异性以及差异产生成因进行了讨论,以期为水环境、水生态的监测管理和保护提供参考。
2 断面布设及监测方法
2.1 断面测点及时间
选择三峡库区澎溪河(小江)、草堂河、大宁河和香溪河等4条重要支流,在其人河口上游约3 km处分别设置4个比对监测断面。断面处设置浮标船,自动监测设备安装于浮标船上。传统监测断面采样点位于自动监测设备3m的范围内。监测时间为2018年1~6月,每月1次,共6次。
2.2 监测方法及仪器
(1)传统监测。在距离监测平台3m范围以内,采集平台周围水面下0.5 m混合样。为了尽可能减少误差,现场抽滤采集水样,并将滤膜立即置于4 cC冰盒中,放人车载冰箱冷藏运输并及时送回实验室分析。分析方法采用SL 88-2012《水质叶绿素的测定分光光度法》[8]。实验室所用的量器及分光光度计均经过检定或校准。
(2)自动监测。自动监测仪器为英国AquareadAP-7000多参数水质监测仪,采用荧光分析法在监测断面进行原位观测。仪器安装前经过校准,每月采样时进行维护校准,所选用的AP-7000叶绿素光学电极的主要参数见表1。
3 结果分析
3.1 数据结果
4个自动监测站2018年1~6月共24组的对比对监测数据见表2。图l为叶绿素浓度变化曲线。初步判断得出,自动监测与传统监测数据的变化趋势较为一致。
3.2 相关性分析
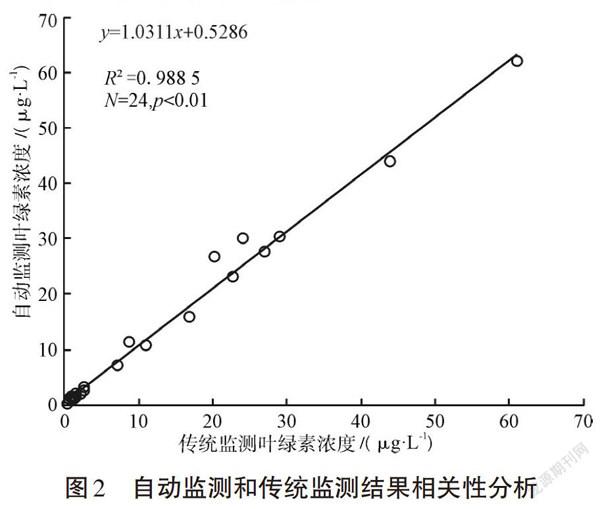
将24组数据按传统监测方法和自动监测方法分为两组,进行配对样本t检验,得到其相关系数为0.994( P
将自动监测方法和传统监测方法测得结果作为相关量,进行回归分析,结果表明两组方法测得的结果数据显著相关,见图2。
3.3 差异性分析
对传统监测方法和自动监测方法得到的两组结果分别进行均值和标准差计算,并在此基础上,针对同一监测指标的两组结果进行配对和样本t检验。假设两组数据不存在显著差异性,得到的t值和Sig.值见表3。t=-2.413,Sig.为0.024∈(0.01,0.05),表明配对的两组数据存在显著差异性。
3.4 偏差分析
对上述存在显著差异性的配对数据组进行偏差分析,以检验差异大小是否在允许范围内。
因测量数据有限,无法确定样品的绝对真值,难以进行绝对误差的分析,因此将两组数据单位进行换算后,通过相对偏差的计算,进行精密度分析。相对偏差计算公式为
计算结果见表4,平均偏差为7.1%。
根据SL219-2013《水环境监测规范》中关于两个监测系统间分析精密度的允许差规定,一般理化指标通常情况下,分析精密度偏差不超过15 %[9],
比对结果表明,自动监测方法和传统监测方法测得的数据显著性相关,但两组数据也存在显著性差异,24组数据中,有3对出现了偏差大于15%,占比12.5%,其余均处于可接受的范围内。
4 数据差异成因分析
(1)方法原理不同。自动监测仪器基于体内荧光法,探头释放一定波长的光线,水中的叶绿素吸收光线后,释放出波长685 nm左右的荧光,通过测量荧光强度得出水中叶绿素的含量。水体中能被激发而产生荧光的物质,除浮游植物体内的叶绿素外,水体中化学状态的叶绿素以及其他能产生荧光的物质均被算作是叶绿素。荧光法测定的是不同形式下总叶绿素的值[6-7],但无法区分不同形式的叶绿素。传统监测方法的主要对象是叶绿素a。由于测量多个波长的信息,对叶绿素a和叶绿素b进行了区分,甚至对脱镁叶绿素进行了校准。由于两种方法的原理不同,适用对象也有所不同,且自动监测的数据量通常较传统监测数据量大,因此两种方法原理不同导致了系统误差。
(2)泥沙杂质和杂光的干扰。由于自动监测是基于光信号的监测方式,而野外自动监测的样品未经过前处理,很容易因为光的散射、反射等,受到水体中泥沙等杂质的干扰[10]。汛期和雨天水体泥沙含量大,导致一些季节性或偶然性差异。而在野外原位测量同样也可能会因为昼夜等光线强弱的不同,而受到杂光干扰[6]。传统监测方法在实验室经过浸提离心等前处理,可以基本消除杂质和杂光的干扰。从这个角度来说,传统的实验室浸提法结果相对准确。
(3)样品的性质不同。即使传统监测方法测得两份样品结果相同,也不能保证自动监测能得到相同的结果。尤其是当样品藻类形态和大小不同时,其均匀度也会不同,导致测量结果存在差异。尤其是存在团藻、多甲藻、微囊藻等较大的个体或群体时,其样品本身并不均匀,与实验室浸提的较均匀的叶绿素溶液有很大不同。
(4)分析时间的差异。自动监测在原位可以很快地测出相应数据,而传统采样涉及样品采集运输等过程,在时间上会有差异。尽管运输过程中,温度较低,但长时间运输可能会导致实验室样品和原位的样品存在差异。即便是在采样现场进行抽滤,也仍然无法避免前处理过程耗时过长问题。
(5)测量仪器的校正和测量过程中的质量控制。在对比试验过程中,室内使用的分光光度计及相关的器具经过周期检定校准,并且在有效期内。现场自动监测仪器带有自动清洗功能,并且每月由工作人员进行一次清洗、人工维护和校准。然而,由于磨损程度和藻类种类不同,自动清洗效果也存在一些差异;仪器校准标准品保质期短,标准品和待测水体中叶绿素存在的状态和均一性有较大差异[11]。实验室测量人员的经验和操作方式不同,也可能带来偶然误差。
5 结语与展望
由于数据量较少,可能导致此次比对分析结果存在一定的不足。而通过本次样品比对的数据分析可知,叶绿素测量值的变化范围较小,最大值为62.13μg/L。不同的样品浓度,可能导致其结果相对偏差等差异性也会有所不同[6]。因此,未来在对自动和传统监测进行比对时,还需增大样品容量,扩大样品浓度范围,才能更加准确地分析两者间的差异。
由于自动监测灵敏度高,且具有较好的时效性和可比性,因而在应急监测、在线监测等方面具有良好的应用前景。即使自动监测叶绿素结果与实验室手工方法结果存在一定的偏差,叶绿素自动监测依然具有其独特优势。由于自动监测测量叶绿素的数据相关性良好,即使自动监测仪器示值变化不能保证绝对准确,但是其变化趋势依然具有参考价值。尤其是在突发应急监测和在线监测中,自动监测能定时或不间断的记录水体待测物浓度,并能够快速及时的传递出变化的信号。在全变化过程中,由于自动监测频次高,可以更完整地记录变化过程。而自动监测的快速响应优势为水华等应急风险事件实时预警预报和实时监控提供了可行性。
除自动监测和传统监测外,目前还可以运用遥感等方法进行水体富营养化和叶绿素的监测[12-13]。这些监测方式都各有优缺点,可与传统监测方法相互配合,形成互补,更好地为水资源、水环境、水生态监测管理和保护工作提供服务和支撑。
参考文献:
[1] 魏印心,胡鸿钧.中国淡水藻类:系统、生态及分类[M].中国:科学出版社,2006.
[2]U.S. Environmental Protection Agency. Method 445.0: Invitro determination of chlorophyll a and pheophytin a[R].Washington: U.S. Environmental Protection Agency, 1997.
[3]U.S. Environmental Protection Agency. Determination ofchlorophylls a,b,c lc and pheopigments in marine andfreshwater algae by visible spectrophotometry[R].
Wash-ington: U.S. Environmental Protection Agency, 1997.
[4]U.S. Environmental Protection Agency. Determination ofchlorophylls a and b and identification of other pigmentsof interest in manne and freshwater algae using high per-formance liquid chromatography with visible wavelengthdetection[R]. Washington: U.S. Environmental Protec-tion Agency.1997.
[5]朱喜,胡明明.中国淡水湖泊蓝藻暴发治理与预防[M].中国:中国水利水电出版社,2014.
[6]刘苑,陈宇炜,邓建明.YSI(多參数水质检测仪)测定叶绿素a浓度的准确性及误差探讨[J].湖泊科学,2010,22(6):965-968.
[7] 张江龙.叶绿素监测仪器在水质自动监测应用中的优劣浅析[J].现代科学仪器,2007(1):41-43.
[8]SL 88-2012水质叶绿素的测定分光光度法[S].
[9]SL 219-2013水环境检测规范[S].
[10] 叶陈军.浊度对活体叶绿素荧光检测的影响及修正方法[J].海洋学研究,2018,36(2):27-35.
[11] 樊琳琳,荧光法测定水体叶绿素藻标准品制备技术研究[Dl.石家庄:河北科技大学,2016.
[12]秦伯强,朱广伟,张运林,等,高频无线自动监测技术在湖泊蓝藻水华监测和预测中的应用[J].科研信息化技术与应用,2010(3):61-71.
[13]孙笑笑,联合浮标与卫星数据的赤潮预警与决策服务[D].杭州:浙江大学,2017.

