出芽短梗霉菌PA-2发酵培养基及发酵条件优化
杨莹 庄新亚 程亮 郭青云


摘要:【目的】优化出芽短梗霉菌(Aureobasidium pullulans)PA-2菌株产孢发酵培养基和发酵条件,以提高PA-2菌株的产孢量,为该菌的开发和生产应用提供理论依据。【方法】以PA-2菌株发酵液中的产孢量为检测指标,采用单因子优化PA-2菌株发酵培养基和最佳发酵条件,通过中心组合设计(Central composite design, CCD)筛选培养基成分最佳配比;用PA-2菌株制成可湿性粉剂用于杂草藜田间防除试验。【结果】经优化后,PA-2菌株产孢最佳培养基配方为葡萄糖84.60 g/L、大豆粉46.35 g/L、NaCl 2.59 g/L、MgSO4 0.52 g/L、KCl 0.78 g/L、K2HPO4 6.50 g/L、(NH4)2SO4 0.52 g/L;最佳发酵条件为pH 7、温度25 ℃、装液量60 mL/250 mL、转速180 r/min、接种量8%、培养时间120 h。田间防除试验结果表明,PA-2可湿性粉剂对杂草藜的鲜重防效最高可达75.0%。【结论】优化后的培养和发酵条件可有效提高PA-2菌株的产孢量,降低发酵成本,适合发酵放大试验及相关剂型的开发研究;可采用PA-2菌株生产菌剂应用于杂草防除。
关键词: 出芽短梗霉菌PA-2;产孢量;发酵条件;单因子优化;田间试验
中图分类号: S476 文献标志码: A 文章编号:2095-1191(2019)09-1998-11
Abstract:【Objective】In order to improve Aureobasidium pullulans PA-2 spore production and provide theoretical references for its exploitation and application, medium composition and fermentation conditions of PA-2 were optimized.【Method】Spore production in fermentation broth of PA-2 strain were set as test indexes. Single factor experiments were used to determine the optimum basic medium and fermentation conditions. The optimum formulation of fermentation medium was determined by central composite design(CCD). The wettable powder made by PA-2 was used to conduct field control test of Chenopodium album. 【Result】The optimal medium composition for PA-2 strain spore production were:Glucose 84.60 g/L, soybean powder 46.35 g/L, NaCl 2.59 g/L, MgSO4 0.52 g/L, KCl 0.78 g/L, K2HPO4 6.50 g/L, (NH4)2SO4 0.52 g/L. The optimal fermentation conditions were:initial pH 7, culture temperature 25 ℃,liquid volume 60 mL/250 mL, rotation speed 180 r/min,inoculation amount 8%, and fermentation for 120 h. The results of field control experiment showed that the fresh weight effect of PA-2 wettable powder on C. album reached 75.0%. 【Conclusion】The optimized medium and fermentation conditions enhance the spore production of A. pullulans PA-2, lower the fermentation cost, and are suitable for development of fermentation scale-up test and related dosage forms. PA-2 can be used to produce microbial ino-culum for weed control.
Key words: Aureobasidium pullulans PA-2; spore yield; fermentation conditions; single factor optimization;field experiment
0 引言
【研究意义】田间杂草是作物病虫害发生和传播的介质,杂草增加了农业田间管理劳动和投入成本,成为严重危害农业经济的因素之一(李久新,2011;陈世国和强胜,2015;李香菊,2018)。化学除草剂的长期大量使用导致农田杂草抗药性迅速发展,作物药害、农药残留发生频繁,增加了杂草治理的难度和人工费用(冯维卓和吴建良,2001;梁巧玲和马德英,2007)。因此,研究高效、绿色、无污染的生物农药以增加除草药剂的丰富度,避免单一药剂的长期使用造成杂草抗药性已成为当前杂草防除研究的热点。出芽短梗霉菌(Aureobasidium pullulans)是一类与酵母密切相关的真菌,目前针对出芽短梗霉菌研究报道最多的是通过发酵培养基及其发酵条件优化增加出芽短梗霉菌产生的糖类物质来合成多糖类物质、胞外酶类、抗菌素和聚苹果酸等(刘畅,2012;Rong et al.,2015;王建梓,2016)。由于芽短梗霉菌多糖类物质具有极佳的成膜性、可塑性及易自然降解,已广泛应用于食品生产、医疗、化妆品、水果保鲜等众多领域(Choudhury et al.,2012;刘鑫,2015),是一种极具研究价值和应用前景的新型生物制品。但该菌株作为生防除草剂在杂草生防领域的研究在国内外仅有少量报道,研究报道该菌可产生能抑制杂草和植物病害的代谢产物,进而发挥防除作用(Prashanthi and Srikant,2005;Zhang et al.,2012;李永龙等,2014;宿翠翠,2016)。本研究旨在优化源自植物的出芽短梗霉菌PA-2菌株的发酵条件,为该菌作为新型生物除草药剂的研制提供理论参考。【前人研究进展】在不同生境中发现的出芽短梗霉菌对生长条件和环境要求各有不同,优化适合特定菌株的发酵条件是研究利用该菌株的重要基础(吴海霞等,2018)。不同学者采用单因素和正交优化设计及Box-Benhnken中心组合设计分别对出芽短梗霉菌的不同菌株液体发酵条件进行优化,提高了发酵水平,缩短了发酵周期,为后续的工业生产打下基础。常帆等(2013)采用响应面分析對出芽短梗霉As3.933产普鲁兰多糖的发酵培养基进行优化,优化后的普鲁兰多糖产量达22.29 g/L,较初始液体发酵培养基(17.32 g/L)提高28.70%。陈国强等(2017)采用单因子试验对出芽短梗霉菌A5菌株的摇瓶发酵培养基和培养条件进行优化,在最佳发酵条件下普鲁兰多糖的产量为22.9 g/L。陈曦等(2018)采用单因素试验、Plackett-Burman法和正交试验对出芽短梗霉BK-10菌株的产聚苹果酸条件进行优化,优化条件下聚苹果酸的糖酸转化率达0.71 g/g,生产强度达0.89 g/(L·h),较优化前分别提高18.33%和71.15%。【本研究切入点】现阶段对出芽短梗霉菌的研究以发酵产生糖类物质和提高发酵液活性物质为主要方向,针对提高孢子数量的研究仅有少量报道。【拟解决的关键问题】出芽短梗霉菌PA-2菌株是青海省农业有害生物综合治理重点实验室(以下简称本实验室)从自然感病的杨树病叶上分离得到的一株对多种杂草具有较强防除作用,具有良好生防应用前景的优良菌株(李永龙等,2014;程亮,2016)。本研究以PA-2菌株发酵液中产孢量为对象,通过单因素试验和响应曲面试验,优化PA-2菌株的培养基和摇瓶发酵条件,以期为该菌作为除草剂的研发和应用提供理论基础。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株 出芽短梗霉菌PA-2菌株由本实验室从自然感病杨树叶上分离获得并保存。
1. 1. 2 培养基 菌株活化培养基:PDA培养基;菌株种子培养基:葡萄糖20.00 g/L、酵母浸粉10.00 g/L、蛋白胨20.00 g/L。
1. 2 试验方法
1. 2. 1 菌株活化和种子液制备 将实验室保存的出芽短梗霉菌PA-2菌株转接到PDA固体培养基中,28 ℃培养5 d,用打孔器在菌落边缘取菌块(Φ=8 mm)接种于盛有50 mL种子培养基的250 mL三角瓶中,每50 mL接菌1块,于25 ℃、180 r/min条件下摇床培养3 d作为种子液。
1. 2. 2 培养基优化
1. 2. 2. 1 固体培养基筛选 选择7种不同的培养基(表1)进行基础固体培养基筛选。取活化的菌种菌饼(Φ=8 mm)接种于不同的基础培养基中央,在25 ℃下培养,分别于培养后5和14 d测量菌落直径,观察培养基中菌落直径及形态特征。每处理重复3次。选择菌落直径较大的培养基作为培养基优化的基础培养基。
1. 2. 2. 2 液体发酵培养基筛选 将种子发酵液以4%接种量分别接入装有50 mL供试7种液体发酵培养基(表1)的锥形瓶中,于180 r/min、25 ℃条件下摇床培养,在发酵培养的第24、48、72、96、120、144和168 h分别测定产孢量,并绘制不同培养基生长曲线。每处理重复3次。选择产孢量较大的培养基作为培养基优化的基础培养基。
1. 2. 3 最适碳、氮源筛选 选择4种碳源(玉米粉、小麦粉、蔗糖和葡萄糖)和5种氮源[KNO3、酵母膏、(NH4)2SO4、大豆粉和PDA],分别等量代替筛选出的基础培养基中的碳源和氮源,配制成不同的碳、氮源培养基进行PA-2菌株培养,根据发酵液中的产孢量筛选出最适碳、氮源种类。每处理重复3次。
1. 2. 4 培养基优化单因素试验 对筛选出的培养基各成分进行单因素试验。将种子液以4%接种量接入装有50 mL基础培养基培养液的250 mL三角瓶中,于25 ℃、180 r/min条件下摇床培养7 d,测定产孢量。每处理重复3次。培养基各成分及水平选择如表2所示。
1. 2. 5 响应面法优化培养基成分及配比 以单因素试验得到的结果为中心点,运用Design Expert 8.0.6对主要因素碳源、氮源和无机盐重新编码,以PA-2菌株的产孢量为响应值(Y),设计3因素5水平响应面(RSM)试验,其因素及水平(表3)根据中心组合设计(Central composite design,CCD)原理进行。
1. 2. 6 发酵条件优化试验 以优化的培养基为发酵培养基,分别测定不同初始pH(5、6、7、8和9)、发酵时间(0、12、24、36、48和60 h)、装液量(20、40、60、80、100 和120 mL/250 mL)、接种量(4%、8%、10%、12%和16%)、培养温度(15、20、25、30和35 ℃)和摇床转速(140、160、180、200和220 r/min)对PA-2菌株产孢量的影响,每处理重复3次。
1. 2. 7 PA-2菌株可湿性粉剂对杂草藜的防除试验
按照筛选获得的优化发酵培养基配方和发酵条件进行PA-2菌株发酵,发酵完成后喷雾干燥制成菌粉,加入不同助剂(硅藻土和聚乙烯醇等)制成孢子量为108个/g的可湿性粉剂。田间试验在青海省西宁市城北区二十里铺镇进行,随机区组排列,小区面积8 m2,按200 mL/m2喷药液量进行喷雾,可湿性粉剂设200、400、600和800 g/ha,以200 g/L氯氟吡氧乙酸EC为对照CK1、清水为对照CK2,每处理重复3次,在杂草藜7~8叶时进行喷雾,施药后7、20和40 d分别测定杂草藜的株高和鲜重,计算株高抑制率和鲜重防效。
株高抑制率(%)=(对照区株高-处理区株高)/对照区株高×100
鮮重防效(%)=(对照区鲜重-处理区鲜重)/对照区鲜重×100
1. 3 统计分析
采用Excel 2003和DPS 6.50对试验数据进行统计分析,运用Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2. 1 培养基优化结果
2. 1. 1 固体基础培养基筛选 不同培养基上PA-2菌株的菌落形态及特征见表4。
由图1可知,PA-2菌株在不同培养基上的菌落形态基本相似,菌落颜色基本是从白色转变为墨绿色。在大多数培养基中均表现为气生菌丝生长速度慢,基内菌丝生长速度较快,且菌丝薄而稀疏。培养基Ⅵ和培养基Ⅶ菌丝发达,后期生长过程中培养基Ⅵ菌落边缘菌丝稀薄,气生菌丝最发达致密,而培养基Ⅶ在培养后期与前期菌落表现一致。
由表5可知,培养第5 d时,PA-2菌株在培养基Ⅱ中生长最好,菌落直径达24.61 mm,显著高于其他培养基处理(P<0.05,下同),在培养基Ⅵ上长势最差,菌落直径仅为16.49 mm,显著低于其他培养基处理;培养第14 d,PA-2菌株菌落直径在PDA培养基、改良PDA培养基、培养基Ⅱ、培养基Ⅵ和培养基Ⅶ上无显著差异(P>0.05,下同)。结合菌落形态观察,选择培养基Ⅶ为PA-2菌株的最适固体基础培养基。
2. 1. 2 液体基础培养基筛选 分别在不同发酵时间测定不同培养基发酵液中PA-2菌株的产孢量。由图2可知,在相同发酵时间下均以培养基Ⅶ发酵液的产孢量最多,其中在培养96 h时的产孢量最大,达7.45×108个/mL;PDA培养基和改良PDA培养基发酵液中产孢量最低,几乎不产孢或产孢很少。因此,结合菌丝生长形态和生长直径,选取培养基Ⅶ为PA-2菌株产孢的液体基础培养基。
2. 2 培养基碳、氮源筛选结果
由表6可知,PA-2菌株在以葡萄糖和玉米粉为碳源的培养基上产孢量最多,分别达5.10×105和2.93×105 个/mL,两者孢子悬浮液的OD600间差异不显著;在以大豆粉为氮源的培养基上产孢量最多,达2.13×106个/mL,其孢子悬浮液的OD600显著大于其他氮源处理。因此,选择葡萄糖和大豆粉作为PA-2菌株产孢发酵培养基的最适碳、氮源。
2. 3 培养基优化单因素试验结果
2. 3. 1 葡萄糖 由图3可知,随着葡萄糖添加量的增加,PA-2菌株的产孢量呈先缓慢增长再下降的变化趋势,当葡萄糖添加量为80.00 g/L时产孢量达最大值,为4.10×108个/mL;当葡萄糖添加量增至100.00 g/L后产孢量呈下降趋势。因此,选择初始葡萄糖添加量80.00 g/L为PA-2菌株发酵培养基的碳源。
2. 3. 2 大豆粉 由图4可知,随着大豆粉添加量的增加,PA-2菌株的产孢量呈先增长后下降的变化趋势,在大豆粉添加量为35.00 g/L时产孢量达最大值,为4.20×108 个/mL,当大豆粉添加量超过35.00 g/L后产孢量呈下降趋势。因此,选择初始大豆粉添加量35.00 g/L为PA-2菌株发酵培养基的氮源。
2. 3. 3 K2HPO4 由图5可知,随着K2HPO4添加量的增加,PA-2菌株的产孢量呈先增长后下降的变化趋势,在K2HPO4添加量为10.00 g/L时产孢量达最大值,为5.40×108 个/mL;当K2HPO4添加量超过10.00 g/L后产孢量呈下降趋势。因此,选择K2HPO4添加量10.00 g/L为PA-2菌株发酵培养基的无机盐。
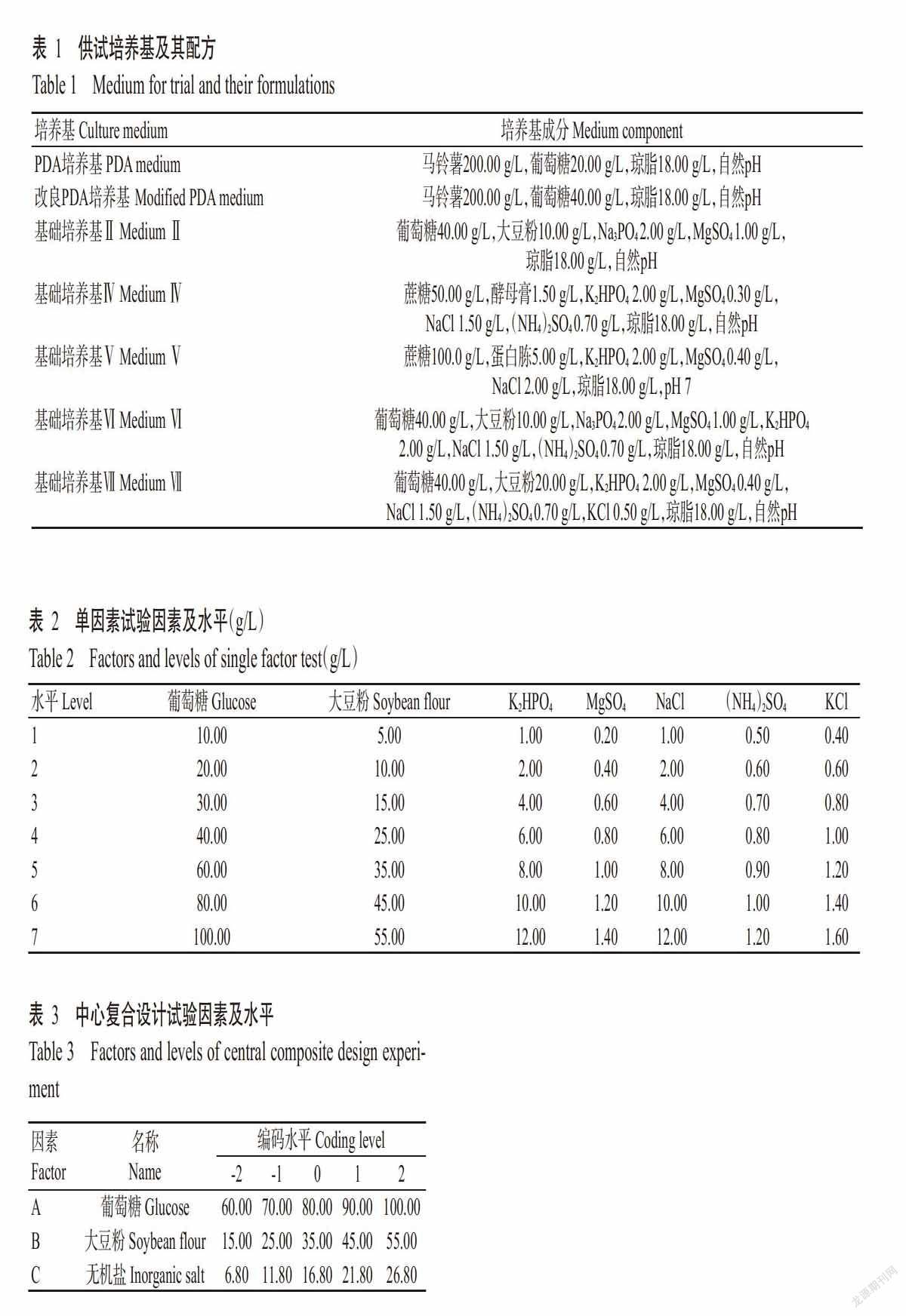
2. 3. 4 MgSO4 由图6可知,随着MgSO4添加量的增加,PA-2菌株的产孢量呈缓慢增长再下降的变化趋势,在MgSO4添加量为0.80 g/L时产孢量达最大值,为3.50×108 个/mL;当MgSO4添加量超过0.80 g/L后产孢量呈快速下降趋势并且趋于平稳。因此,选择MgSO4添加量0.80 g/L为PA-2菌株发酵培养基的无机盐。
2. 3. 5 NaCl 由图7可知,随着NaCl添加量的增加,PA-2菌株的产孢量呈先增长后下降的变化趋势,在NaCl添加量为4.00 g/L时产孢量达最大值,为3.60×108 个/mL;当NaCl添加量超过4.00 g/L后产孢量呈显著下降趋势。因此,选择NaCl添加量4.00 g/L为PA-2菌株发酵培养基的无机盐。
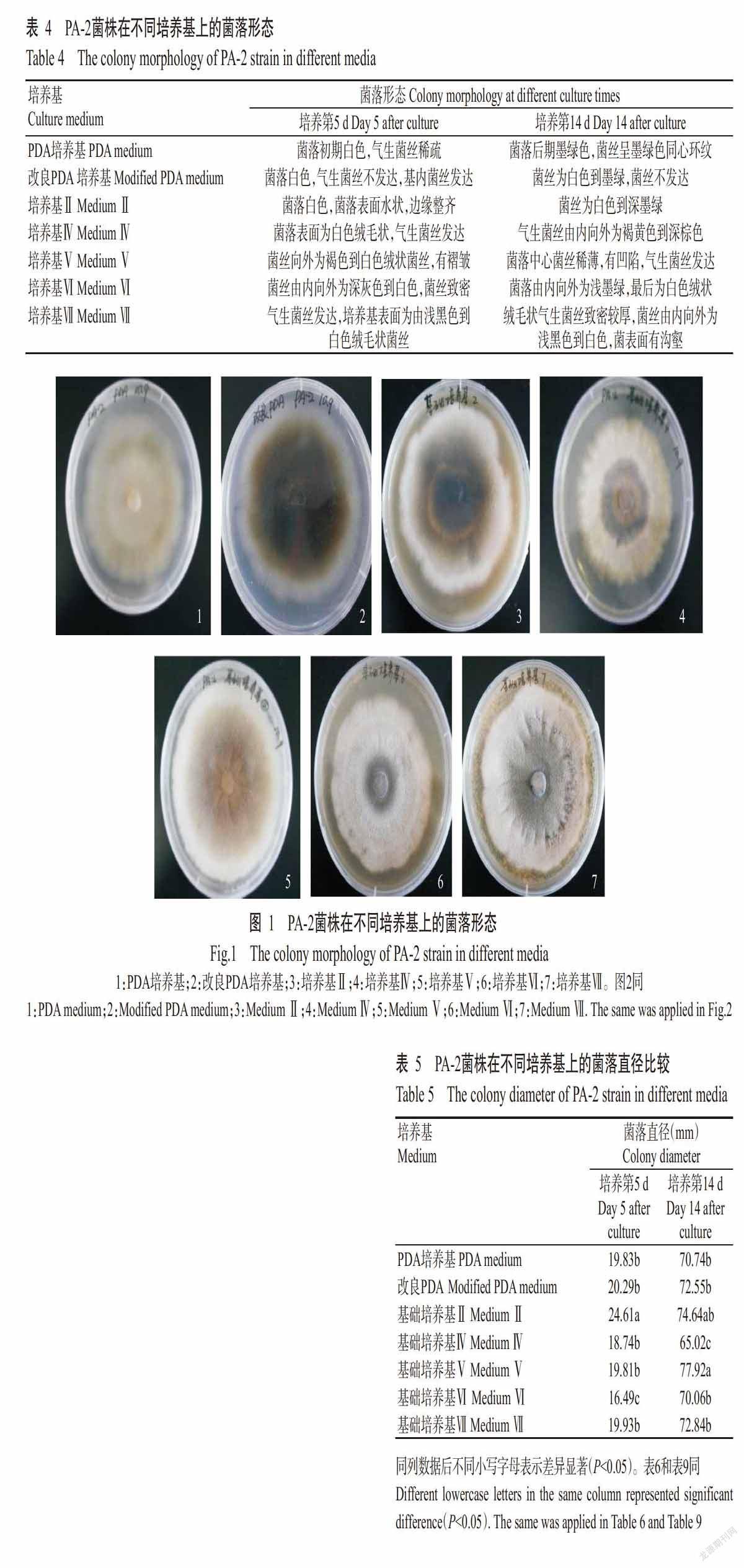
2. 3. 6 (NH4)2SO4 由图8可知,随着(NH4)2SO4添加量的增加,PA-2菌株的产孢量呈缓慢增长再快速下降趋势,在(NH4)2SO4添加量为0.60 g/L时曲线轻微上升,在添加量为0.80~0.90 g/L时曲线几乎达到平稳,此时产孢量达最大值;当(NH4)2SO4添加量超过0.9 g/L时产孢量呈显著下降趋势。因此,为了节约成本,选择(NH4)2SO4添加量0.80 g/L为PA-2菌株发酵培养基的无机盐。
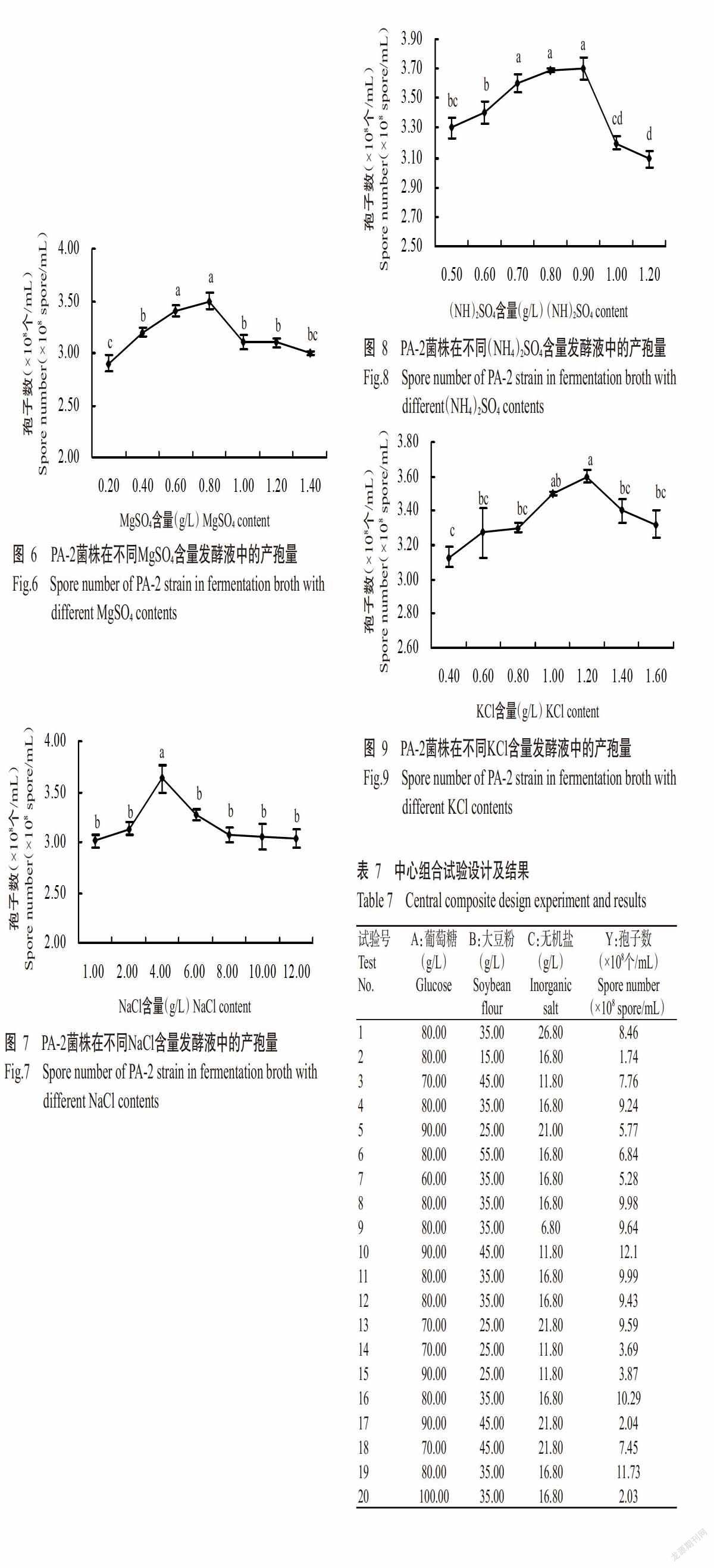
2. 3. 7 KCl 由图9可知,随着KCl添加量的增加,PA-2菌株的产孢量呈先增长再下降的趋势,但增长过程缓慢,在KCl添加量为1.20 g/L时产孢量达最大值,为3.60×108 个/mL;当KCl添加量超过1.20 g/L后产孢量呈明显下降趋势。因此,选择KCl添加量1.20 g/L为PA-2菌株发酵培养基的无机盐。
2. 4 中心组合设计试验优化结果
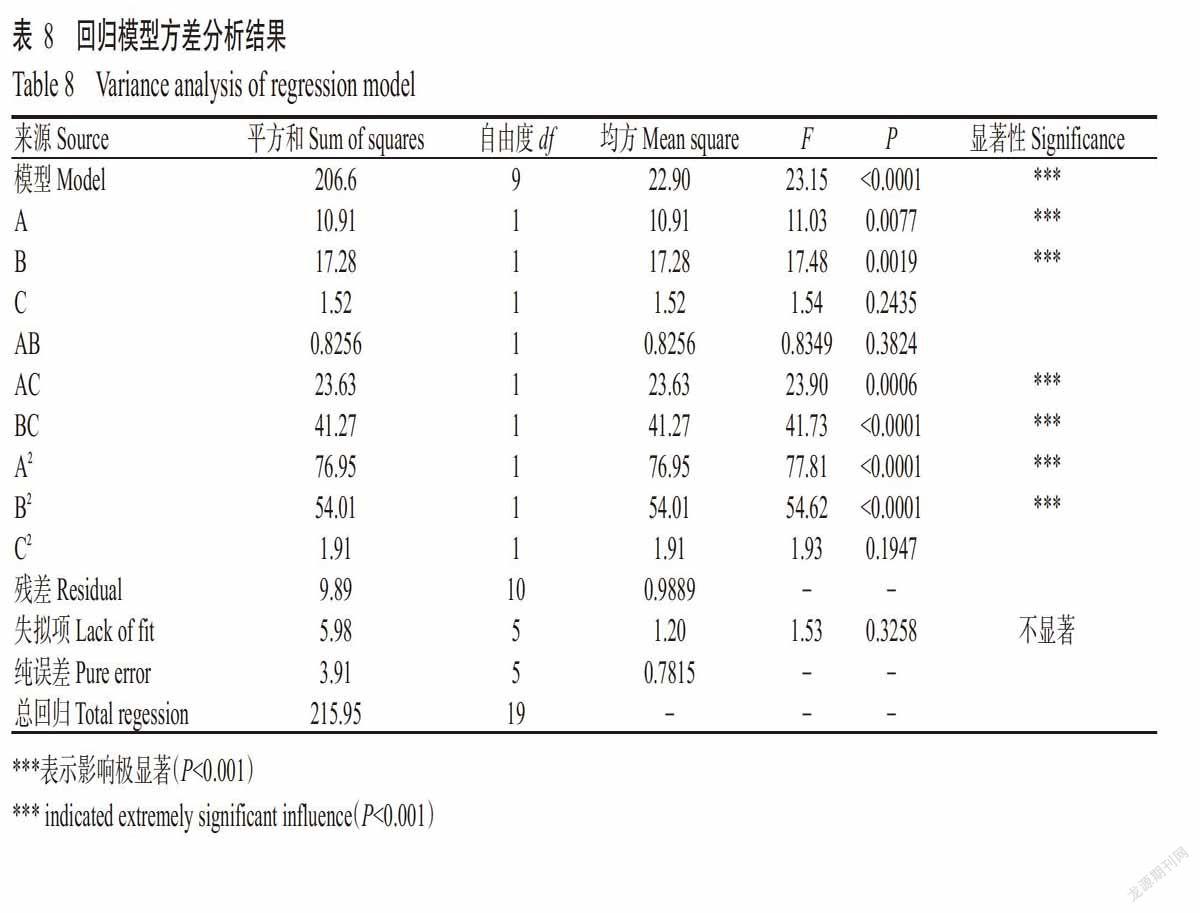
在单因素试验的基础上,运用Design Expert 8.0.6的CCD设计原理,对出芽短梗霉菌PA-2菌株发酵培养基培养条件进行3因素5水平试验,结果见表7。
以出芽短梗霉菌PA-2菌株发酵培养基孢子数(Y)为响应值,根据CCD设计的试验结果,利用Design Expert 8.0.6对表7数据进行分析,得到孢子数与葡萄糖(A)、大豆粉(B)、无机盐(C)的二次多项回归方程:
Y=10.09-0.8256A+1.04B-0.3081C+0.3213AB-1.72AC-2.27BC-1.75A2-1.47B2-0.2757C2
對回归模型进行可信度分析和方差分析,结果见表8。由表8可知,模型F=23.15,P<0.0001,说明该回归方程极显著。失拟项不显著,说明该模型模拟性较好。模型的复相关系数R2=0.9542,调整复相关系数R2=0.9130,预测复相关系数R2=0.7707,说明调整复相关系数(0.9130)与预测复相关系数(0.7707)有较合理的相符度,该模型具有较好的回归性。模型信噪比>4,表明该模型具有足够的信号响应设计。因此,该模型能对出芽短梗霉菌PA-2菌株孢子量进行分析和预测。
根据回归方程绘制试验因素间交互效应三维立体响应曲面和等高线图,观察在一个因素不变的情况下其他两个因素对产孢量的影响,结果见图10~图12。其中,葡萄糖浓度与大豆粉浓度交互作用响应面为开口向下的凸形曲面,说明葡萄糖浓度与大豆粉浓度的交互作用较显著。在回归方程求解得到出芽短梗霉菌PA-2菌株发酵培养基产孢量的培养基条件为: 葡萄糖84.60 g/L,大豆粉46.35 g/L,无机盐10.91 g/L[NaCl 2.59 g/L、MgSO4 0.52 g/L、KCl 0.78 g/L、K2HPO4 6.50 g/L、(NH4)2SO4 0.52 g/L],预测PA-2菌株产孢量最高值为12.76×108个/mL。
根据模型求出的最优条件配制培养基,对模型进行3次以上验证试验,得知出芽短梗霉菌PA-2菌株平均产孢量达10.68×108个/mL,与预测值相比无明显差异,但略有不同。分析其原因可能是由于培养基在发酵过程中含氧量、转速、pH会随着孢子数的上升而有所改变,从而导致最终实际产孢量与预测值略有不同。
2. 5 发酵条件优化测定结果
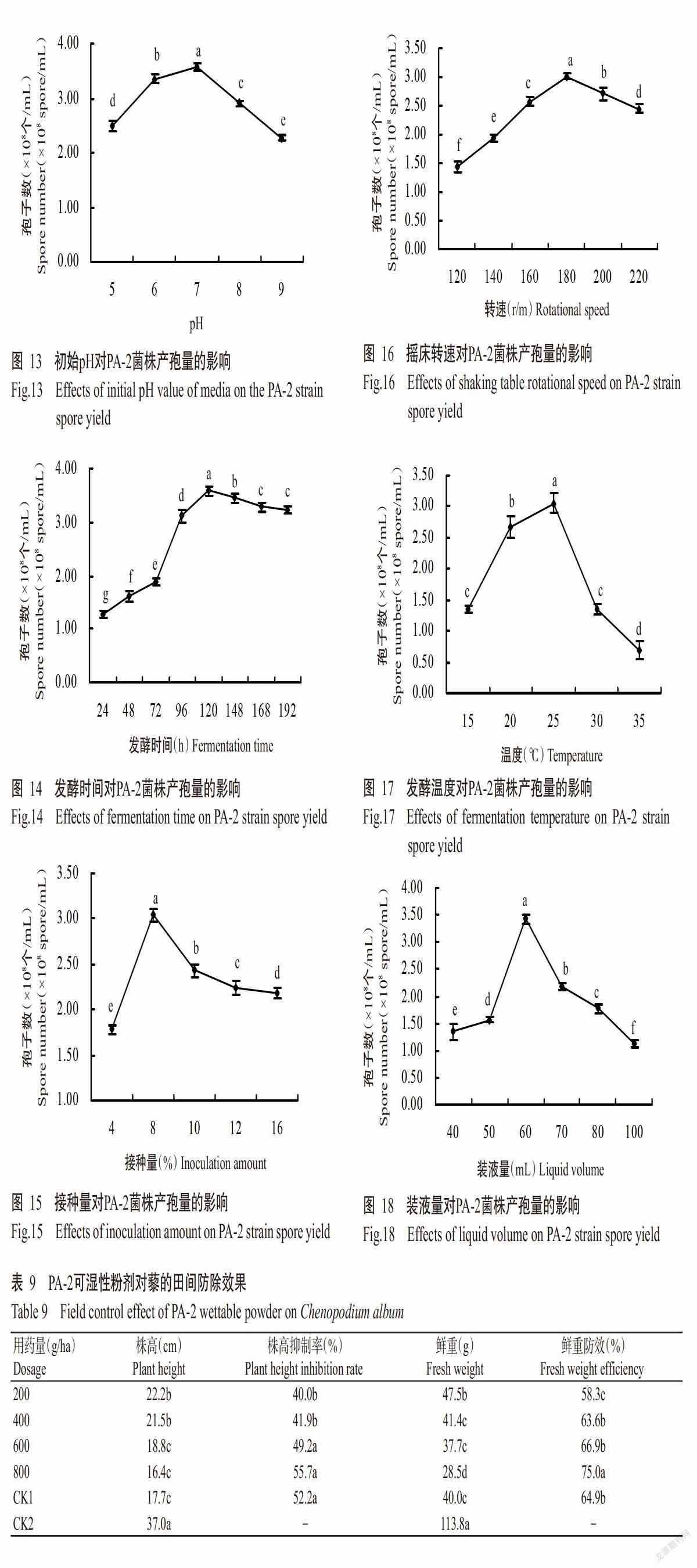
2. 5. 1 初始pH 测定5个pH(5、6、7、8和9)对PA-2菌株产孢的影响,结果(图13)表明,发酵培养基初始pH 5~7时产孢量均随着pH的增大而增加,pH为7时产孢量达最大值,为3.57×108 个/mL,显著高于其他初始pH处理,当pH大于7后PA-2菌株的产孢量明显下降。说明中性条件适合PA-2菌株生长,因此,选择pH 7为PA-2菌株摇瓶产孢发酵的最佳pH。
2. 5. 2 发酵时间 发酵过程中每隔12 h对PA-2菌株的产孢量进行测定,结果(图14)表明,在发酵0~120 h时,随着发酵时间的增加,孢子数量呈对数增长,在发酵120 h时产孢量达最大值,为3.58×108个/mL,显著高于其他发酵时间处理;发酵120~192 h时产孢量趋于稳定即进入平台期。因此,选择120 h为PA-2菌株摇瓶产孢发酵的最佳发酵时间。
2. 5. 3 接种量 由图15可知,接种量在4%~8%时PA-2菌株的产孢量呈明显上升趋势,接种量为8%时达最大值,为3.04×108 个/mL,显著高于其他接种量处理;接种量超过8%后,PA-2菌株的产孢量明显下降。因此,选择8%作为PA-2菌株摇瓶产孢发酵的最佳接种量。
2. 5. 4 摇床转速 由图16可知,当摇床转速为120~180 r/min时,随着转速增大,PA-2菌株的产孢量呈上升趋势,在180 r/min时产孢量达最大值,为3.02×108 个/mL,显著高于其他摇床转速处理;当转速超过180 r/min后产孢量缓慢下降。因此,选择180 r/min作为PA-2菌株摇瓶产孢发酵最佳摇床转速。
2. 5. 5 发酵温度 分别在不同温度下进行发酵,结果(图17)表明,在15~25 ℃时PA-2菌株的产孢量呈上升趋势,25 ℃时产孢量达最大值,为3.05×108 个/mL,显著高于其他发酵温度处理;超过25 ℃后产孢量明显下降。因此,选择25 ℃作为PA-2菌株摇瓶产孢发酵的最佳温度。
2. 5. 6 装液量 对发酵时培养基装液量进行测定,结果(图18)表明,在250 mL三角瓶中,装液量为40~60 mL时,随着装液量的增加,产孢量呈上升趋势,装液量在60 mL时产孢量达最大值,为3.43×108 个/mL,显著高于其他装液量处理;装液量大于60 mL后产孢量明显下降。因此,选择60 mL为PA-2菌株摇瓶产芽孢发酵的最佳装液量。
2. 6 PA-2可湿性粉剂对杂草藜的田间防除效果
由表9可知,PA-2可湿性粉剂对藜有明显的防除作用,用药量为800 g/ha时对藜的株高抑制率为55.7%、鲜重防效为75.0%,显著高于用药量为200和400 g/ha的防除效果,与对照药剂200 g/L氯氟吡氧乙酸EC处理组(CK1)的株高抑制效果相当,而鲜重防效显著高于对照药剂处理处理。因此,田间可使用PA-2可湿性粉剂防除杂草藜。
3 讨论
孢子是微生物产生的繁殖体,是微生物发酵生产的一个重要中间体,孢子的质量、数量对发酵产量和生物活性均有明显影响,其受营养物质和环境等因素的综合影响(许丽娟等,2008)。孢子产率是决定生防菌制剂的重要指标(李鸿文和冯明光,2008)。通过培养基和发酵条件优化以提高孢子产量,可为工业化生产和应用生防菌剂提供保障。本研究结果表明,出芽短梗霉菌PA-2菌株在基础培养基Ⅶ上菌落直径和产孢量最高,与常帆等(2013)对出芽短梗霉菌A5的研究结果略有差异,可能是针对最后的代谢产物应用方向不同所致;葡萄糖作为碳源对出芽短梗霉菌PA-2菌株的产孢有利,与宋小娜(2014)对该菌的研究结果一致,且葡萄糖价格便宜、成本低,适合工业大批量发酵。大豆粉作为氮源的培养基有利于PA-2菌株产孢和生长,与张文芝等(2010)对蜡质芽孢杆菌AR156的研究结果一致,而添加其他氮源[(NH4)2SO4和KNO3]不利于孢子形成,说明无机氮源不利于孢子的形成,与吴海霞等(2018)报道的酵母膏对海洋细菌GM-1-1的孢子形成不利相吻合。
本研究在基础培养基、碳源、氮源和无机盐单因素试验的基础上,采用响应面设计进行优化,得到PA-2菌株产孢的最佳培养基配方:葡萄糖84.60 g/L,大豆粉46.35 g/L,无机盐10.91 g/L[NaCl 2.59 g/L、MgSO4 0.52 g/L、KCl 0.78 g/L、K2HPO4 6.50 g/L、(NH4)2SO4 0.52 g/L],優化后PA-2菌株的产孢量为10.68×108 个/mL,提高了产孢量,表明该菌株在生产上具有较好的优势,为进一步的除草研究及后期生防制剂工业化生产提供了重要数据。
在发酵条件优化试验中,发现PA-2菌株对外界pH环境的适应性较强,中心偏酸的环境更适于PA-2菌株产孢,也解释了酵母菌多存在于酸性环境下的观点(Lima et al.,2003)。在培养温度的试验中,发现PA-2菌株在25 ℃下产孢量最大,与李世杰等(2000)对短梗霉多糖的研究结果存在差异,可能与其长期栖居的自然环境有关,或者与孢子和代谢产物对环境的要求条件不一致有关。本研究还发现,培养时间在120 h时PA-2菌株的产孢量最大,达到对数生长期,随着时间的推移,菌体自溶导致孢子量下降。
本研究按照优化的培养基配方和发酵条件对PA-2菌株进行发酵培养,干燥后添加助剂制成PA-2可湿性粉剂,其对杂草藜的株高抑制率最高为55.7%、鲜重防效最高可达75.0%,与对照药剂200 g/L氯氟吡氧乙酸EC处理组的株高抑制效果相当,但鲜重防效显著高于对照药剂。为提高PA-2可湿性粉剂对杂草藜的防除效果,今后将开展菌药混配方面的试验研究,为田间应用提供理论依据。
4 结论
PA-2菌株产孢最佳培养基配方为葡萄糖84.60 g/L、大豆粉46.35 g/L、NaCl 2.59 g/L、MgSO4 0.52 g/L、KCl 0.78 g/L、K2HPO4 6.50 g/L、(NH4)2SO4 0.52 g/L;最佳发酵条件为pH 7、温度25 ℃、装液量60 mL/250 mL、转速180 r/min、接种量8%、培养时间120 h。优化后的培养和发酵条件可有效提高PA-2菌株的产孢量,降低发酵成本,适合发酵放大试验及相关剂型的开发研究;可采用PA-2菌株生产菌剂应用于杂草防除。
参考文献:
常帆,薛文娇,安超,马赛箭. 2013. 利用响应面法优化出芽短梗霉As3.933产普鲁兰多糖发酵培养基[J]. 化学与生物工程,30(5):42-45. [Chang F,Xue W J,An C,Ma S J. 2013. Optimization of fermentation medium for production by Aureobasidium pullulans As3.933 using response surface methodology[J]. Chemistry Bioengineering,30(5):42-45.]
陳国强,吴文涛,王纪明,廖韦红,张海波,咸漠,雷廷宙,魏玉西. 2017. 出芽短梗霉A5产胞外多糖发酵条件的优化及产物结构鉴定[J]. 中国生物工程杂志,37(2): 54-62. [Chen G Q,Wu W T,Wang J M,Liao W H,Zhang H B,Xian M,Lei T Z ,Wei Y X. 2017. Production and characteristics of pulluan produced by Aureobasidium pulluans A5[J]. China Biotechnology,37(2): 54-62.]
陈世国,强胜. 2015. 生物除草剂研究与开发的现状及未来的发展趋势[J]. 中国生物防治学报,31(5):770-779. [Chen S G,Qiang S. 2015. The status and future directions of bioherbicide study and development[J]. Chinese Journal of Biological Control,31(5):770-779.]
陈曦,鲍文娜,黄美娟,李怡辉,潘海峰,谢志鹏,张建国. 2018. 出芽短梗霉产聚苹果酸发酵条件的优化[J]. 微生物学通报,45(2): 231-237. [Chen X,Bao W N,Huang M J,Li Y H,Pan H F,Xie Z P,Zhang J G. 2018. Optimization of fermentation conditions for polymalic acid production by Aureobasidium pullulans BK-10[J]. Microbio-logy China,45(2): 231-237.]
程亮. 2016. 出芽短梗霉PA-2产除草活性物质的初步分离[J].江苏农业科学,44(6):199-202. [Cheng L. 2016. Preliminary separation of herbicidal active substances produced by Aureobasidium pullulans PA-2[J]. Jiangsu Journal of Agricultural Sciences,44(6):199-202.]
冯维卓,吴建良. 2001. 除草剂的使用现状和存在问题[J]. 现代农药,(1):36-38. [Feng W L,Wu J L. 2001. The current status and problems of herbicide use[J]. Modern Agrochemicals,(1):36-38.]
李鸿文,冯明光. 2008. 球孢白僵菌不同菌株分生孢子的耐热能力[J]. 浙江大学学报(农业与生命科学版),34(2):158-162. [Li H W,Feng M G. 2008. Bioassay thermoto-lerance of Beauveria bassiana strains from different hosts and geographic origins[J]. Journal of Zhejiang University(Agriculture and Life Sciences),34(2):158-162.]
李久新. 2011. 农田杂草的危害及除草剂的使用技术[J]. 现代农业,(5):68-69. [Li J X. 2011. Harm of farmland weeds and techniques for using herbicides[J]. Modern Agriculture,(5): 68-69.]
李世杰,彭华松,方尚玲. 2000. 玉米淀粉为原料短梗霉多糖发酵条件研究[J]. 粮食与饲料工业,(12): 41-42. [Li S J,Peng H S,Fang S L. 2000. Study on Pullulan fermentation with corn starch as culture material[J]. Cereal & Feed Industry,(12): 41-42.]
李香菊. 2018. 近年我国农田杂草防控中的突出问题与治理对策[J]. 植物保护,44(5):77-84. [Li X J. 2018. Main problems and management strategies of weeds in agricultural fields in China in recent years[J]. Plant Protection,44(5): 77-84.]
李永龙,程亮,朱海霞,郭青云. 2014. 出芽短梗霉菌PA-2的除草活性及对作物的安全性[J]. 中国生物防治学报,30(2):232-238. [Li Y L,Cheng L,Zhu H X,Guo Q Y. 2014. Herbicial activity of Aureobasidium pullulans PA-2 on weeds and its safety on crops[J]. Chinese Journal of Biological Control,30(2):232-238.]
梁巧玲,马德英. 2007. 农田杂草的危害及除草剂的使用技术[J]. 杂草科学,(2): 35-36. [Liang Q L,Ma D Y. 2007. Research progress on comprehensive controlling of weeds in farmland[J]. Weed Science,(2): 35-36.]
劉畅. 2012. 出芽短梗霉的发酵条件及其糖酵解研究[D]. 无锡:江南大学. [Liu C. 2012. Study on fermentation conditions and glycolytic pathway of Aurebasidium pullulans[D]. Wuxi: Jiangnan University.]
刘鑫. 2015. 出芽短梗霉发酵生产普鲁兰多糖及多糖涂膜荔枝保鲜的研究[D]. 南宁:广西大学. [Liu X. 2015. Pullulan fermentation by Aureobasidium pulluans and coating lychee preservtion[D]. Nanning: Guanxi University.]
宋小娜. 2014. 3株杂草生防菌培养条件及菌剂的初步研究[D]. 西宁:青海大学. [Song X N. 2014. Study on culture conditions and biological agent of three kinds of biological control microorganisms on weeds[D]. Xining: Qinghai University.]
宿翠翠. 2016. 出芽短梗霉PA-2次生代谢产物中除草活性物质研究[D]. 西宁:青海大学. [Su C C. 2016. Study on the herbical substance from secondary metabolite of Aureobacidium pullulans PA-2[D]. Xining: Qinghai University.]
王建梓. 2016. 出芽短梗霉发酵产普鲁兰多糖工艺条件优化[D]. 天津:天津科技大学. [Wang J Z. 2016. Research on the production of pullulan producted by Aurebasidium pullulans[D]. Tianjing: Tianjing University of Science and Technology.]
吴海霞,陈茹,曹雪梅,李欢,暴增海,马桂珍,王军强,罗志会. 2018. 海洋细菌GM-1-1产芽孢发酵培养基和摇瓶发酵条件优化[J]. 南方农业学报,49(12): 2454-2462.[Wu H X,Chen R,Cao X M,Li H,Bao Z H,Ma G Z,Wang J Q,Luo Z H. 2018. Optimization of fermentation medium for spore production and flask-shaking fermentation conditions of marine bacteria GM-1-1[J]. Journal of Southern Agriculture,49(12): 2454-2462.]
许丽娟,刘冬华,刘红,汪彬,张爱群. 2008. 我国微生物农药的应用现状及发展前景[J]. 农药研究与应用,12(1):9-11. [Xu L J,Liu D H,Liu H,Wang B,Zhang A Q. 2008. The current application status and development of microbial pesticide in China[J]. Agrochemicals Research & Application,12(1):9-11.]
张文芝,王云鹏,刘红霞,郭坚华. 2010. 蜡质芽孢杆菌AR156发酵培养基及发酵条件的优化[J]. 微生物学通报,37(6):803-810. [Zhang W Z,Wang Y P,Liu H X,Guo J H. 2010. optimization of medium components and cultu-ral conditions of Bacillus cereus AR156[J]. Microbiology China,37(6): 803-810.]
Choudhury A R,Bhattacharyya M S,Prasad G S. 2012. Application of response surface methodology to understand the interaction of media components during pullulan production by Aureobasidium pullulans RBF-4A3[J]. Biocataly-sis and Agricultural Biotechnology,1(3):232-237.
Lima G,De Curtis F,Castoria R,De Cicco V. 2003. Integra-ted control of apple postharvest pathogens and survival of biocontrol yeasts in semi-commercial conditions[J]. European Journal of Plant Pathology,109(4):341-349.
Prashanthi S K,Srikant K. 2005. Aureobasidium pullulans,a potential mycoherbicide forbiocontrol of eupatorium [Chro-molaena odorata (L.) King and Robinson weed]. Current Science,88(1):18-21.
Rong,Y J,Zhang,L,Chi,Z M,Wang X H. 2015. A carboxymethylcellulase from a marine yeast(Aureobasidium pullulans 98): Its purification,characterization,gene cloning and carboxymethyl cellulose digestion[J]. Journal of Ocean University of China,14(5):913-921.
Zhang D P,Spadaro D,Valente S,Garibaldi A. 2012. Clo-ning,characterization,expression and antifungal activity of an alkaline serine protease of Aureobasidium pullulans PL5 involved in the biological control of postharvest pathogens[J]. International Journal of Food Microbiology,153(3):453-464.
(责任编辑 麻小燕)

