生物材料表面微结构对循环肿瘤细胞粘附、增殖及捕获率的影响
吴兴达,吕群松 (广东医科大学信息工程学院,广东湛江 524023)
目前肿瘤的检测手段主要基于影像学和病理学检查[1-2],这些检测较难发现早期症状,患者容易错过最佳治疗时间。循环肿瘤细胞(CTC)是原发肿瘤扩散转移的重要途径,在早期肿瘤患者血液中便能检测到;捕获和富集肿瘤患者血液中的CTC,有利于肿瘤转移的早期诊断、个体化治疗方案的定制、肿瘤治疗效果评估及其转移机制的研究[3]。由于CTC在外周血中数量极其稀少,提高CTC检测准确性和灵敏度是高纯、高效富集CTC的关键。然而目前同时满足高纯度和高捕获率的分离富集还存在着巨大挑战。鉴于抗原和抗体结合的高特异性和高亲和力,抗体修饰的材料可捕获到纯度较高的CTC。为了提高CTC的捕获率,探讨细胞捕获率与材料表面微结构之间的关系,本文制备了3种具有不同微米或纳米级结构特征的TiO2表面,并以光滑表面作对照,观察不同微结构表面CTC的粘附、铺展等行为,分析其与细胞捕获率之间的关联。
1 材料和方法
1.1 材料
钛酸四丁酯、(3-巯基丙基)三甲氧基硅烷(MPTMS)、马来酰亚胺丁酸-N-琥珀酰亚胺酯交联剂(GMBS)、链霉亲和素(SA)、生物素化的anti-EpCAM等主要试剂均购自Sigma公司;聚二甲基硅氧烷(PDMS)购自美国Momentive公司;人乳腺癌细胞系MCF-7、人宫颈癌细胞Hela由中国科学院细胞库/干细胞库提供。
1.2 方法
1.2.1 材料制备 纳米结构用水热反应法制备、微米结构用溶胶凝胶法和真空辅助软压印法制备。由0.3 mL钛酸四丁酯、22 mL去离子水和18 mL盐酸组成的前驱液倒入高压釜内胆,氟掺杂氧化锡(FTO)玻璃斜靠内胆,在140 °C下水热6 h生长TiO2纳米线获得纳米结构;以荷叶为模板制备PDMS负结构印章,再在TiO2溶胶凝胶上压印出微米柱阵列,烧结后获得仿荷叶微米结构。在微米结构基底上按上述水热反应条件生长纳米线,获得仿荷叶微纳结构。
1.2.2 材料表面抗体修饰 4种结构基底浸泡在4%(体积分数)的MPTMS乙醇溶液中10 h,分别用乙醇和二甲亚砜(DMSO)清洗3次后,浸入GMBS中60 min,再将链霉亲和素(SA)接枝到GMBS上,用PBS缓冲液冲洗掉未能接上的SA。最后将生物素化的anti-EpCAM滴在基底上,孵育1 h后用PBS缓冲液清洗。修饰抗体后材料放在4 ℃冰箱内待用。
1.2.3 细胞捕获实验 选取人乳腺癌细胞MCF-7作为目标细胞,EpCAM低表达的宫颈癌细胞Hela作为对照。将4种结构基底置于6孔板,每孔加入3 mL特定浓度的MCF-7细胞悬浮液,然后放入细胞培养箱,37 ℃、5% CO2的环境下培养。将分别孵育30、45、60、75 min后的基底取出,用PBS润洗除去未捕获的细胞。俘获细胞用4%多聚甲醛固定,加入2 mL PBS以及20 μL荧光染色剂FDA进行染色处理10 min,染色后用PBS润洗3~5次,除去残留在基底表面的FDA,最后置于荧光显微镜下观察细胞捕获情况。
1.2.4 扫描电镜观察捕获细胞 捕获细胞用4%多聚甲醛固定后,使用梯度酒精(30%、50%、70%、90%、100%)脱水。观察前喷金25 s。
1.2.5 细胞增殖实验 将带捕获细胞的基底置于新鲜DMEM培养液中连续培养24 h,用钙黄绿素和碘化丙啶染色处理后在荧光显微镜下观察增殖情况。
1.2.6 细胞捕获率的计算 荧光显微镜下计算捕获细胞个数,细胞捕获率定义为实验细胞密度与理论细胞密度之比。实验细胞密度指荧光显微镜视野下的细胞个数n除以该视野面积α,理论细胞密度指细胞总数N除以6孔板一个孔的底面积A。即
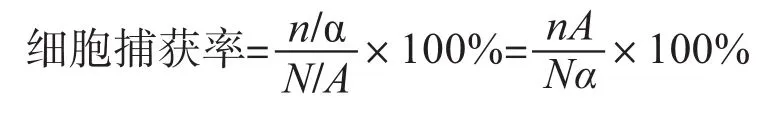
1.3 统计学处理
采用SPSS24.0软件进行统计学处理。计量资料以均数±标准差表示,采用单因素方差分析和q检验,P<0.05为差异有统计学意义。
2 结果
2.1 纳米结构、微米结构及微纳结构的扫描电镜观察结果
扫描电子显微镜(SEM)观察3种TiO2表面,结果见图1。图1(a)所示的纳米结构中,大量纳米线均匀分布在FTO玻璃上,其直径约70 nm,长约800 nm。图1(b)是仿荷叶分布的微米柱阵列,微米柱随机分布,高度和直径均为4~6 μm,间距为6~22 μm。图1(c)所示的仿荷叶微纳结构具有与图1(b)相同的微米柱分布,但其基底和微米柱表面布满了纳米线。图1(d)展现微纳结构中一个微米柱的高倍电镜照片,图中可见微米柱表面及其周围基底覆盖着大量纳米线。
2.2 4种结构表面MCF-7细胞形貌的观察
4种结构表面MCF-7细胞的形貌具有明显差异。光滑玻璃表面的细胞呈半球形,无伪足伸出,细胞因未铺展开而显得较小,如图2(a)所示。微米结构表面的细胞则粘附在微米柱旁,如图2(b)所示。纳米结构表面的细胞伸出很多伪足,伪足短而密,铺展开后连成片,见图2(c)。而微纳结构表面的细胞同样伸出片状伪足,但伪足铺展得远,并有向附近微米柱延伸的趋势,见图2(d)。

图1 SEM照片
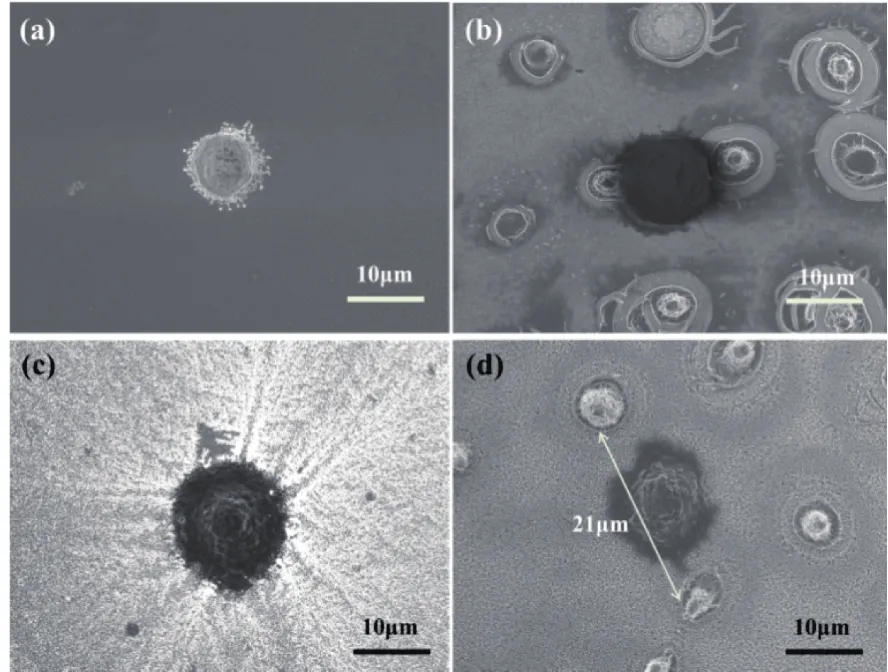
图2 4种结构上捕获细胞的SEM照片
2.3 微米柱间距对细胞铺展的影响
微纳结构中的微米柱间距对细胞铺展有显著影响。图3(a)中细胞摊开铺展在两个微米柱之间,其直径约15.5 μm;图3(b)中细胞完全摊开,铺展在4个微米柱之间,其直径接近20 μm,而这4个微米柱两两之间的距离分别为8.9、14.4 、11.1、18.7 μm。相比之下,图2(d)中细胞直径只有13 μm,扁平程度明显不及图3中的情况,这可能与其两端的微米柱间距较大有关(21 μm)。

图3 微米柱间距对MCF-7形貌的影响
2.4 捕获细胞的增殖情况
在捕获细胞孵育24 h后,微纳结构表面的细胞呈现明显增殖,细胞密度最大,单位面积细胞数为170个,明显多于其他3种结构界面,差异有统计学意义(P<0.01)。

图4 捕获MCF-7在4种不同结构基底上的增殖情况
2.5 4种界面结构的MCF-7和Hela细胞捕获率
随着孵育时间(30~60 min)的延长,4种结构表面的捕获细胞逐渐增多(P<0.01);60 min后细胞捕获率基本不再增加;孵育60 min时,微纳结构的细胞捕获率最高,光滑表面则最低(P<0.01),详见表1。
表1 4种结构界面在不同时间MCF-7细胞捕获率的比较(±s,n=5,%)

表1 4种结构界面在不同时间MCF-7细胞捕获率的比较(±s,n=5,%)
与同组30 min比较:aP<0.01;与同组45 min比较:bP<0.01;与光滑表面、微米结构组60 min比较:cP<0.01
界面结构光滑表面组微米结构组纳米结构组微纳结构组30 min 0.6±0.2 7.6±0.8 28.0±4.8 30.2±4.2 45 min 1.2±0.4 15.6±4.1 53.3±5.8 64.8±7.4 60 min 2.3±0.6ab 23.1±2.8ab 67.2±6.3a 74.2±10.8ac 75 min 2.3±0.9 23.1±3.1 68.0±5.3 75.6±12
2.6 4种结构界面MCF-7和Hela细胞捕获率的比较
孵育60 min后,4种结构对Hela的捕获率均显著低于MCF-7,差异有统计学意义(P<0.01)。
表2 4种结构界面MCF-7和Hela细胞捕获率的比较(±s,n=5,%)

表2 4种结构界面MCF-7和Hela细胞捕获率的比较(±s,n=5,%)
两组比较均P<0.01
细胞类型MCF-7 Hela微纳结构74.2±10.8 2.2±0.4光滑表面2.3±0.6 1.1±0.3微米结构23.1±2.8 0.9±0.3纳米结构67.2±6.3 2.3±0.6
3 讨论
循环肿瘤细胞是从原位肿瘤病灶脱落,侵袭并进入外周血液循环系统的肿瘤细胞,该细胞被认为是肿瘤转移的必要前提。然而患者外周血中CTC的含量极其稀少,对其检测非常困难。目前CTC的分选富集策略有两大类,一类是物理分选法,依据CTC与正常血细胞间的大小、形变性、密度等物理特性存在的差异性设计方法进行分选,例如微过滤器法和密度梯度离心法[4-5];另一类是亲和识别分离法,用具有专一性识别作用的抗体、适配体等生物活性大分子识别CTC表面特异性表达的蛋白标志物,通过两者之间的特异性识别达到分选CTC的目的,例如唯一经过美国食品药品监督管理局认证的CellSearch系统[6]。尽管这些方法能成功捕获和分选CTC,但仍未能实现临床检测和诊断所需高纯、高效的分离富集。因此开发新的先进材料界面及分选技术显得十分重要。设计和制备各种微纳米结构基底,是免疫亲合法捕获CTC的一个研究热点。微纳米结构能增强细胞伪足、微绒毛与基底之间的拓扑相互作用,促进细胞粘附,提高CTC捕获效率[7]。多种纳米结构已经被构建用于CTC捕获,包括纳米线[8]、纳米片[9]、纳米纤维[10]、纳米孔[11]等。近期报道的分形金纳米结构界面[12]、仿白细胞的微纳多级界面[13]、仿玫瑰花瓣的微纳结构界面[14],以及多级纳米线阵列[15],在CTC捕获中由于细胞与材料界面的相互作用大大增强,捕获率得到极大的提高。
设计和构建新的微纳结构材料界面,对于进一步提高CTC捕获率和揭示细胞与材料间相互作用的机制都具有重要意义。本实验利用新鲜荷叶作为模板,通过PDMS印章在TiO2溶胶凝胶表面复制出荷叶表面的微米结构,再通过水热反应在微米结构基底上生长均匀致密的纳米线以模仿荷叶表面的纳米结构,从而得到仿荷叶微纳结构界面。该结构界面主要应用于超疏水领域,少量文献报道将其作为生物材料界面在骨组织工程领域的应用,但在CTC捕获方面尚未见有报道。研究表明相对于光滑和微米结构表面,成骨细胞在仿荷叶微纳结构表面表现出更好的粘附和更高的细胞活性[16-17]。本实验将光滑FTO玻璃、单一微米结构、单一纳米结构和微纳结构表面分别应用于CTC捕获,结果同样也展现了微纳结构界面在促进细胞快速粘附和增殖方面的优越性。
光滑表面上的细胞仍然保持球形,没有伪足伸出,表明细胞与材料之间的相互作用非常弱;微米结构表面的细胞倾向于粘附在微米柱旁,表明微米柱能够给细胞提供粘附点;而纳米结构表面的细胞有许多伪足伸出,表明细胞与材料之间的拓扑相互作用,与文献报道一致[15]。相比之下,微米柱和纳米线共存的微纳结构表面,不仅具有最大的比表面积,抗体在基底表面的负载量最大,更重要的是,在促进细胞粘附铺展方面,微米柱和纳米线发生了协同作用,细胞伸出伪足与纳米结构相互作用,同时伪足的伸展又受邻近微米柱引导,使细胞铺展面积更大。
仿荷叶表面结构中,微米柱的间距并非一致,大致为6~22 μm。扫描电镜观察发现,相对于20 μm以上的间距,15 μm左右的微米柱明显更有利于细胞的铺展,表明微米柱与细胞的距离合适,其引导细胞铺展的作用就会变得更明显。因此,优化微纳结构中的微米柱间距是进一步增强细胞与材料界面相互作用的一个有效途径。在捕获细胞增殖实验中,微纳结构界面具有最密的细胞分布,表明该界面具有良好的细胞相容性,这对于后期的细胞长时间培养是非常有利的。
在4种结构界面中微纳结构最有利于CTC的粘附、铺展和增殖,表明细胞与材料表面的相互作用最强。因此在CTC捕获实验中,微纳结构界面体现出最佳的细胞捕获特性,细胞捕获率高达74%,是光滑表面的32倍。可以预见,通过进一步优化微米柱间距,微纳结构界面的细胞捕获率将能进一步提高,有望在肿瘤诊断中发挥辅助作用。

