我院超说明书用药管理体系构建的实践与探索
黄亮 张伶俐 曾力楠 林芸竹 张川 陈敏 刘丹
摘 要 目的:構建医疗机构超说明书用药管理体系,规范医疗机构超说明书用药行为,提升合理用药水平。方法:建立我院基于循证研究的超说明书用药管理制度,并开展临床实践,以超说明书用药的备案条数、审批通过率等指标评价所建管理体系的运行效果。结果:自2011年起,我院逐步建立并完善了超说明书用药管理制度,建立了多学科团队参与、以药品临床证据质量分级为基础的院内超说明书用药的备案与审批模式。至2016年底,共提交超说明书备案252条,其中儿科159条(占59.77%)、妇产科93条(占34.96%);在提交的超说明书备案药品中,有181个通过审批,通过率为64.29%;专项处方点评提示住院医嘱中超说明书用药医嘱呈下降趋势,已备案的超说明书用药医嘱比率从2013年的17.33%提升到2016年的84.00%。结论:构建的医疗机构超说明书用药管理体系能有效促进临床对超说明书用药的认识,规范超说明书用药行为。
关键词 医疗机构;药事管理;超说明书用药;备案管理;证据质量
Practice and Exploration of the Construction of Management System for Off-label Drug Use in Our Hospital
HUANG Liang1,2,ZHANG Lingli1,2,ZENG Linan1,2,LIN Yunzhu1,2,ZHANG Chuan1,2,CHEN Min1,2,LIU Dan1,2 (1.Dept. of Pharmacy/Evidence-Based Pharmacy Center, West China Second University Hospital, Sichuan University, Chengdu 610041, China;2.Key Lab of Birth Defects and Related Diseases of Women and Children (Sichuan University), Ministry of Education, Chengdu 610041, China)
ABSTRACT OBJECTIVE: To establish the management system for off-label drug use in a medical institutions, and to standardize the behaviors of off-label drug use and improve the rational drug use. METHODS: Based on evidence-based researches for off-label drug use, management system of off-label drug use was established in our hospital, and off-label drug use management was carried out. The effects of management system were evaluated with the number of records for off-label drug use and pass rate of approval as indexes. RESULTS: Since the year of 2011, the management system for off-label drug use had gradually established and improved in our hospital; the mode of registration and approval for off-label drug use was established by based on a multi-disciplinary team management and quality classification for clinical evidence. Up to 2016, a total of 252 records for off-label use were submitted, among which 159 (accounting for 59.77%) were for pediatrics and 93 (accounting for 34.96%) were for gynecology and obstetrics. Among the submitted records, 181 had passed the examination and approval, and the pass rate was 64.29%. Special prescription comments indicated that the numbers of off-label use medical orders in inpatient medical orders showed a downward trend, and the proportion of recorded medical orders of off-label use had increased from 17.33% in 2013 to 84.00% in 2016. CONCLUSIONS: The management system for off-label drug use in medical institutions can effectively improve the clinical understanding of off-label drug use, standardize the behavior of off-label drug use.
KEYWORDS Medical institutions; Pharmaceutical administration; Off-label drug use; Record management; Evidence quality
超说明书用药是我国医院药事管理的焦点和难点问题,近年来随着医疗行业风险防范意识的提升和相关领域研究证据的不断增加,国家卫生主管部门、药学行业协会及医疗机构药事管理人员对超说明书用药管理的必要性已形成共识,但对医疗机构管理体系的构建仍处于探索之中。2007年,四川大学华西第二医院(以下简称我院)循证药学团队基于医院管理需求,开始对超说明书用药证据现状和应对策略进行了系列探索性循证研究[1-6],结果发现:(1)全球儿科超说明书用药现象普遍存在。三级医疗机构发生率高于初级医疗机构,新生儿、婴儿高于其他年龄组儿童;住院儿童发生率高于门诊;最常见的超说明书用药情况为超适用人群(年龄)用药。此结果提示应开展我国儿童超说明书用药多中心研究,为政策制订提供基线证据[1-2]。(2)样本医院儿科超说明书用药现象普遍存在,如2010年儿科门诊处方超说明书用药发生率40.88%,儿科住院医嘱中超说明书用药发生率78.96%,与全球趋势吻合,提示我国药品说明书中儿童用药信息严重缺乏,儿科执业风险高,急需国家制订相关法律法规或指南以规范超说明书用药行为。(3)全球已有多国针对超说明书用药出台相关法律法规和行业规范指南,其中7个国家有相关立法,允许合理的超说明书用药,10个国家的政府部门或学术组织发布了相关指南或(和)建议[6],这些规范主要涉及:1)获取超说明书用药相关信息与证据支持;2)患者知情同意;3)经伦理委员会或(和)药事管理委员会批准;4)记录原因及疗效;5)监测不良反应[6]。
基于上述超说明书用药系列研究结果,我院深入探索和实践超说明书用药制度管理,取得了一定成效,本文将以我院的实践为例,阐述医疗机构超说明书用药管理制度和管理措施的建立,为医疗机构超说明书用药管理提供参考。
1 制度的制订流程
临床药物治疗是涉及医疗机构多部门、多学科的决策和处理过程,超说明书用药作为临床药物治疗问题,在管理制度的制订过程中必然要充分体现多部门参与、多学科合作。
2011年,我院在医院药物治疗学与药事管理委员会(以下简称DTC)的部署下,首先由药学部和医务部初拟超说明书用药管理制度草案,该草案交DTC并组织医院管理部门、医务部、临床科室、药学部、护理部、感染管理等相关专家多次讨论反复修订,最终由DTC将修订稿提交医学伦理委员会审议通过,并由DTC发文通知医务部、临床科室和药学部遵照执行。从我院制度草案拟定到最终由DTC主任委员签署同意到颁布施行,历经了一年多时间。
2 主要的管理制度
超说明书用药管理制度作为医院药事管理制度之一,应遵照医院药事管理制度的一般范例,包括目的、使用范围、人员职责、制度正文及附录表格,并将超说明书用药的基本原则体现在制度中,包括:1)从患者治疗需要出发,非研究性应用;2)循证医学依据;3)DTC和伦理委员会讨论同意;4)规范审批使用、流程;5)患者知情同意。
我院现行超说明书用药管理制度包括以下4方面主要内容:1)超说明书用药的定义;2)超说明书用药的备案、收集与审批;3)超说明书用药的临床应用与知情同意;4)合理性监控与持续改进。
2.1 超说明书用药的定义
明确“超说明书用药”的概念是整个制度顺利施行的前提,我院参考美国医院药师协会[7]和美国国立图书馆中“off label use”MeSH词定义[8],即:药品用于某一疾病或健康状况时,其使用超出药品监督管理部门批准范围的处方或用药行为,在我国即为超出该药品经国家食品药品监督管理局批准的现行药品说明书的内容范围。
2.2 超说明书用药的备案、收集与审批
2.2.1 超说明书用药的备案流程 超说明书备案应基于临床治疗需要,由临床科室提出,有循证证据支持,并经过DTC和伦理委员会审批。
我院超说明书备案流程如下:①DTC、医务部通知临床科室,收集超说明书用药;②临床科室填报《超说明书用药备案申报表》,提交备案;③药学部每年汇总申请表,临床药师审核证据,并提出备案建议;④DTC组织临床、医务、院感、护理等多学科专家审批;⑤DTC通过的备案提交伦理委员会审批;⑥DTC办公室存档备查,纳入医院处方集,并通知临床和药学部等相关部门参照执行。
2.2.2 超说明书用药证据的分级与推荐 为确保超说明书用药是基于当前最佳的循证医学证据,并为了规范医疗机构在相关证据质量评价及作出推荐意见时有统一的标准,应基于循证医学的证据质量评价和分级方法,建立超说明书证据分级与推荐标准。
参考GRADE(The Grading of Recommendation Assessment,Development and Evaluation)方法[9],我院结合最新的《处方管理办法》《医院处方点评管理规范(试行)》等药事管理法规要求及临床证据来源特点,制订了《超说明书用药证据类型、质量分级、推荐意见及管理方法表》,并提交DTC通过,用于超说明书用药证据的审核和推荐意见的判定。一般情况下,有高质量证据支持药品的超说明书用药,同意备案;证据为低质量证据的超说明书用药,经讨论后,部分可通过备案;无证据的超说明书用药,不同意备案。已有说明书内的用法或已有相似超说明书用药备案可替代时,原则上不再批准为超说明书备案。我院超说明书用药证据类型、质量分级、推荐意见及管理方法见表1。
2.3 超說明书用药的临床应用与知情同意
临床医师是超说明书用药的最终实践者和责任人,为合理降低其执业风险,同时保障患者得到最佳治疗并知晓相关风险的权益,在超说明书用药管理中必须对临床应用和知情同意进行规范。
我院制订的超说明书用药管理制度规定:临床医师使用经DTC批准的超说明书用药,无需向DTC再次提出申请,但应向患者进行知情同意,告知患者为什么要超说明书用药以及治疗方案、预后及相关风险。住院患者须签署书面知情同意书,并与患者病历一同归档保存。知情同意书模板经伦理委员会审批,并嵌入医院信息系统(HIS),方便临床使用。
超说明书用药的责任人为处方医师,处方医师应在考虑超说明书用药时熟悉相关证据,必要时与上级医师或临床药师商讨。
另外,我院的超说明书用药管理制度还规定:因患者病情需要,需临时使用未经审批的超说明书用药时,主治医师须请临床药师及上级医师会诊,临床药师及上级医师评估后提出会诊意见,由主治医师最终决定,并与患者签署知情同意书。超说明书用药相应责任由主治医师承担。临时使用未经审批的超说明书用药,仅限于住院患者。
2.4 合理性监控与持续改进
我院将超说明书用药合理性的监控纳入处方点评和医疗质控中,每季度由处方点评小组随机抽取100张门诊处方和30份住院病历,评价内容:①超说明书用药及其备案情况;②超说明书用药医嘱是否按规定签署知情同意书。点评结果经处方点评咨询专家组审查后,再将点评结果和绩效考核结果报DTC和医疗质量管理委员在院内进行通报。医务部依据绩效考核结果落实奖惩,在将处方点评结果纳入相关科室及其工作人员的年度考核,并责成相关部门和科室完善相应的超说明书用药备案并规范用药管理。
3 執行和效果评价
3.1 超说明书备案收集情况
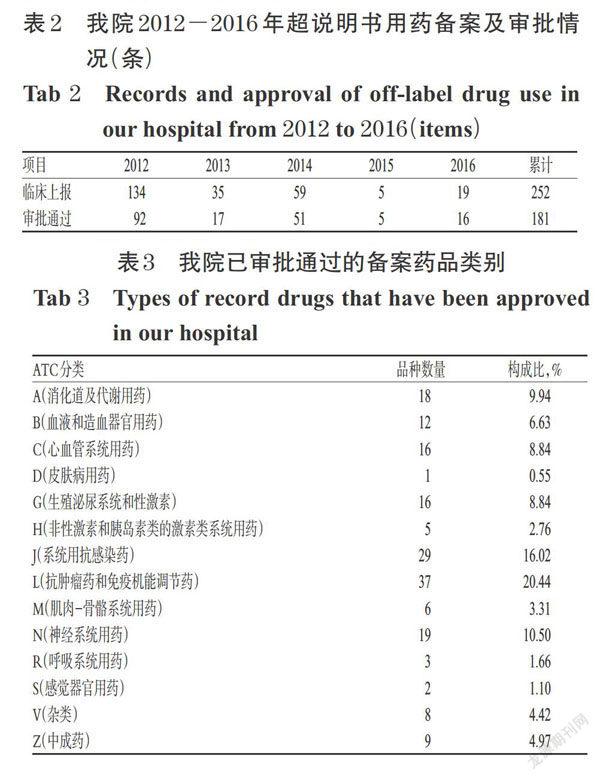
我院从2012年制度执行起,至2016年底共收到临床科室提交的252条超说明书用药备案,覆盖所有临床科室,其中儿科159条(占59.77%),妇产科93条(占34.96%),其他科室(麻醉、影像)14条(占5.26%)。儿科备案数量前三位的科室为新生儿科(54条,33.96%)、儿童血液肿瘤科(47条,29.56%)、儿童感染科(18条,11.32%);妇产科备案数量前三位的科室为生殖内分泌科(30条,32.26%)、妇科肿瘤化疗(18条,19.35%)及辅助生殖医学科(11条,11.83%)。我院2012-2016年超说明书用药备案及审批情况见表2。
3.2 超说明书备案审批情况
至2016年底,我院审批通过的超说明书备案药品品种181个,占备案总数的64.29%;按世界卫生组织药品解剖-治疗-化学分类系统(ATC)分类,各类药品分布情况见表3。
3.3 超说明书使用情况
从2013年至2016年,我院各季度30份抽样病历中的超说明书用药医嘱数和已备案超说明书用药医嘱数见图1所示。
由图1可见,从我院已开展的12期超说明书用药处方点评结果看,我院住院医嘱中超说明书用药备案率从2013年的17.33%提升到2016年的84.00%。另外,从2015年4季度开始点评知情同意书使用情况,至2016年4季度,我院住院超说明书用药医嘱中知情同意书使用率为5.41%。
4 讨论
4.1 结合药事管理需求制订超说明书用药管理制度
超说明书用药是临床药物治疗中普遍存在的现象[10],合理的超说明书用药符合《赫尔辛基宣言》的伦理要求[11]。2010年广东省药学会发布了我国首个《药品未注册用法专家共识》,提出了超说明书用药的5点原则[12]。2011年《三级综合医院评审标准实施细则》对超说明书用药管理提出了要求:①有超说明书管理的规定与程序;②有对临床超说明书用药的监控措施和记录;③有改进措施落实情况,有追踪评价及持续改进的成效。我院从等级评审要求出发,基于前期系列研究结果,结合国内外有关规范和要求[6-7,13-15],将超说明书用药管理纳入我院药事管理制度中,确定了管理流程,制订了管理制度,并在执行过程中对我院超说明书用药情况进行追踪和持续改进,取得了初步成效。
4.2 循证方法在超说明书用药管理中的应用
目前对于超说明书用药的证据质量和推荐意见分级尚无统一标准。我院目前采用的分级方案(见表1)是在管理实践中不断完善并参考有关行业协会共识[9,12-13]的基础上形成的。该分级方案的特点为:对于具有高质量证据的备案进行强推荐,保证其临床应用;将国内外专著、非高质量临床研究,专家共识等类别的备案作为低质量证据,弱推荐,由DTC组织的多学科团队评估其临床获益与风险后决定是否临床应用。备案用法的证据来源于临床的主动上报以及临床药师的再次审核,确保了证据来源的准确性。
4.3 超说明书用药管理促进临床用药水平的提高
超说明书用药管理工作提高了临床科室对超说明书用药问题的重视程度,并规范了临床用药行为。至2016年,超说明书用药在我院全部临床科室均有备案,以儿科为主,占59.77%;妇产科次之,占34.96%;在麻醉和影像等辅助临床科室中也有备案,占5.26%。我院超说明书用药基线调查显示[4],儿科超说明书发生率前2位的科室分别是血液儿科(88.27%)和新生儿科(79.12%),而儿科超说明书用药备案数量的科室分布也以新生儿科(33.96%)、血液肿瘤科(29.56%)为最高;同时在基线调查中,发现超说明书用药率最高的3类药物为S(100%)、G(100%)、D(94.25%),而备案最多的类别为L(20.44%)、J(16.02%)、N(10.50%),这3类是基线研究中超说明书用药医嘱构成比例较高的,提示临床科室进行备案时更应关注临床常用的超说明书用药。而超说明书用药调查结果表明其中主要以超人群(53.02%)和超适应证(40.95%)用药为主。
至2016年底,我院已经审批通过的备案药品品种共181个,占同期全院药品品种总数(624个)的29.00%。从处方点评结果看,至2016年底,住院患者超说明书用药医嘱中有84%是已经过DTC审批同意的,这一比例在2013年仅17.33%,这表明经过5年的超说明书用药管理工作,我院已将绝大多数临床超说明用药纳入到药事管理体系中进行规范管理,同时处方点评也使得我院药师能够将发现的未备案的用法向临床科室反馈,促使其进行备案,备案工作本身就是对用药合理性进行梳理的过程。比如蒲地兰消炎口液等中成药的超说明书备案,即是通过这种方式得以完成的。
4.4 持续改进
目前我院实行的医院层面的超说明书用药管理仍存在一些局限和问题:①我国现有超说明书用药管理处于医疗机构药事管理层面,主要是对临床合理用药的规范,仍缺乏国家政策法律层面的保护和支持,临床超说明书用药面临较大风险;②在中成药超说明书管理中,缺乏高质量证据时如何决策,目前尚无明确的依据;③超说明书用药可能存在更高的不良事件风险,如何开展超说明书用药安全性的后效评价仍不明确;④知情同意书使用率低,如何提高规范超说明书用药知情同意书的管理水平?这些问题也将成为我院对超说明书用药管理的进一步研究和持续改进的重点。
参考文献
[ 1 ] 张伶俐,李幼平,梁毅,等.全球门诊儿童超说明书用药现状的系统评价[J].中国循证医学杂志,2012,12(3):305- 313.
[ 2 ] 张伶俐,李幼平,梁毅,等.全球住院儿童超说明书用药现状的系统评价[J].中国循证医学杂志,2012,12(2):176-187.
[ 3 ] 张伶俐,李幼平,黄亮,等.四川大學华西第二医院儿科门诊处方超药品说明书用药情况调查[J].中国循证医学杂志,2011,11(10):1120-1124.
[ 4 ] 张伶俐,李幼平,黄亮,等.四川大学华西第二医院2010年儿科门诊患儿超说明书用药情况调查[J].中国循证医学杂志,2012,12(3):267-273.
[ 5 ] 张伶俐,李幼平,胡蝶,等.四川大学华西第二医院2010年儿科住院患儿超说明书用药情况调查[J].中国循证医学杂志,2012,12(2):161-167.
[ 6 ] 张伶俐,李幼平,曾力楠,等. 15国超说明书用药政策的循证评价[J].中国循证医学杂志,2012,12(4):426-435.
[ 7 ] American Society of Hospital Pharmacists. ASHP statement on the use of medications for unlabeled uses[J]. Am J Hospital Pharm,1992,49(8):2006-2008.
[ 8 ] NCBI. Mesh:off-label use[EB/OL].(2010-11-08) [2018- 11-02].https://www.ncbi.nlm.nih.gov/mesh/?term=off+label+drug+use.
[ 9 ] 杨悦,何畔,邹韵,等.推荐分级的评估、制定与评价方法以及WHO在基本药物遴选中的应用[J].中国药房,2011,22(32):2977-2981.
[10] 黄亮,申向黎,张伶俐,等.正确认识并有效规范超说明书用药行为[J].中国医院药学杂志,2009,29(11):949-951.
[11] Wold Medical Association. WMA declaration of Helsinki-ethical principles for medical research involving human subjects[EB/OL]. (2013-10-30)[2018-11-02]. htt- ps://www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects/.
[12] 广东省药学会.药品未注册用法专家共识[EB/OL].(2010- 03-08)[2018-11-02].http://www.sinopharmacy.com.cn/download/1.html
[13] KATHLEEN K,TERRY G.药物和治疗学委员会实践指南:中文版[S].中国医院协会药事管理专业委员会 译,北京:2006.
[14] 中国药理学会治疗药物监测研究专业委员会药品风险管理学组.超说明书用药专家共识[J].药物不良反应杂志,2015,7(2):101-103.
[15] 中华医学会儿科学分会临床药理学组.中国儿科超说明书用药专家共识[J].中华儿科杂志,2016,54(2) :101- 103.
(收稿日期:2018-07-11 修回日期:2018-11-07)
(编辑:刘 萍)

