沙门菌致病的奥秘
孙兰清 左玲莉 杨斯迪 黄瑞 吴淑燕


沙门菌是一类常见的.以人和动物为宿主的肠道致病菌,在全球范围内引起严重的公共卫生问题。本文主要介绍沙门菌人浸宿主的过程和鼠伤寒沙门菌与巨噬细胞相互斗争的结局,揭示沙门菌致病的奥秘。
沙门菌属(Salmonella)是一类经粪口途径感染人和动物的革兰阴性兼性胞内菌。作为全球四大人类腹泻病病因之一,沙门菌感染每年可引起约1.8亿例腹泻病,导致高达41%的腹泻相关死亡病例[1]。沙门菌的发现可追溯至1885年,美国兽医病理学家沙门(D.E.Salmon)的助手史密斯(T.Smith)在寻找引起猪霍乱的病因时,从患猪体内意外分离出一种新的细菌。沙门将该菌以自己的名字命名,尽管后来研究证实这并不是他们本要寻找的病原体,但菌属的命名“Salmonella”仍沿用至今。
沙门菌属包括肠道沙门菌(S.enterica)和邦戈沙门菌(S.bongori)两个种,目前已发现2600种以上的血清型。肠道沙门菌又可分为6个亚种,其中与人类疾病密切相关的血清型主要是第一亚种,即肠道沙门菌肠道亚种(S.enterica subsp.enterica),约99%的临床分离株属于此亚种。根据宿主感染后的临床表现,沙门菌血清型分为类伤寒沙门菌(typhoidal Salmonella,TS)和非伤寒沙门菌(non-typhoidal Salmonella,NTS)两大类。前者主要包括伤寒沙门菌、甲型副伤寒沙门菌、肖氏沙门菌(原称乙型副伤寒沙门菌)和希氏沙门菌(原称丙型副伤寒沙门菌)等。人类作为TS感染的唯一宿主,在经历7~14天左右的无症状潜伏期后,可出现高热、肝脾肿大和玫瑰疹等全身症状,即肠热症(enteric fever)。除上述血清型外的沙门菌归类为NTS。NTS宿主范围广,部分血清型是引起人畜共患病腹泻的病原菌。在婴幼儿、老人和免疫功能低[人群中,NTS还可导致严重全身感染。
鉴于沙门菌感染在全球引起严重的公共卫生问题,本文主要就沙门菌的入侵过程和鼠伤寒沙门菌与巨噬细胞的相互关系做一详细介绍,为深入探究沙门菌的致病机制和寻找新的治疗手段提供依据。
沙门菌入侵宿主的过程
沙门菌经口进入消化道,首先面临的是pH极低的胃酸,该菌可通过激发酸耐受反应(acid toleranceresponse,ATR)增强自身的存活能力。进入肠腔的沙门菌不仅能与肠道内正常菌群竞争营养,还可利用自身分泌的毒力蛋白获得生长优势。例如,NTS中的鼠伤寒沙门菌(S.typhimurium)可利用肠道内正常菌群无法代谢的成分,一种活性氧(reactive oxygen species,ROS)和内源性含硫化合物硫代硫酸盐的反应产物连四硫酸盐(tetrathionate),从而通过调控呼吸作用与肠道共生菌竞争营养。肠腔内的沙门菌在黏附素和菌毛介导的黏附作用下,主要定植于人体回肠末端和近端结肠,并利用其致病性突破肠黏膜上皮屏障。
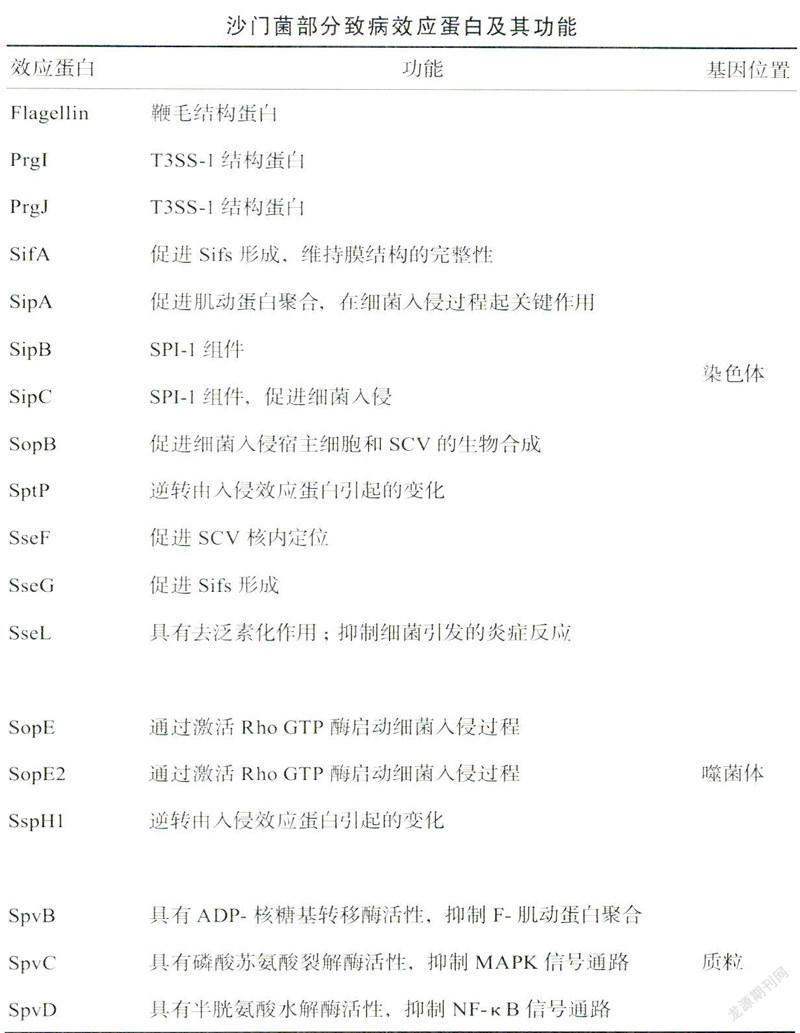
沙门菌的致病性与染色体、染色体外的质粒、噬菌体基因组和可移动元件等密切相关。其中,毒力岛是存在于细菌染色体上编码毒力相关基因的特定区域。沙门菌毒力岛1(Salmonella pathogenicity island 1,SPI-1)和沙门菌毒力岛2(Salmonella pathogenicity island2,SPI-2)分别编码两种重要的Ⅲ型分泌系统(type Ⅲsecretion system 1和type Ⅲ secretion system 2,简称为T3SS-1和T3SS-2)。该系统的结构类似于“注射器”,能将沙门菌分泌的效应蛋白转运至宿主细胞内,以促进细菌的定植、繁殖和扩散。除染色体外,沙门菌质粒携带的毒力基因亦是该菌致病的重要因素。如笔者实验室长期研究的存在于大多数致病性沙门菌质粒的毒力基因spv(Salmonellaplasmid virulence gene),包括调控基因spvR和4个结构基因spvA、spvB、spvC及spvD共5个开放阅读框,其编码产物在促进沙门菌感染宿主过程中发挥重要作用。沙门菌在上述部分效应蛋白的协助下,主要通过以下3种方式突破肠黏膜上皮屏障致病。
肠黏膜上皮屏障包括肠黏膜表面黏膜层、肠上皮细胞、细胞间紧密连接和固有层。肠上皮细胞由不同类型的细胞组成,如肠上皮细胞、产生黏膜的杯状细胞、分泌抗菌肽的潘氏细胞、位于隐窝的干细胞和转运抗原的微褶皱细胞(microfold cell,M细胞)等。沙门菌突破肠黏膜上皮屏障最主要的一种方式是由M细胞介导的转胞吞作用。M细胞与其他肠上皮细胞紧密连接,可将肠腔中的病原菌和抗原成分轉运至位于其下方的派尔集合淋巴结(Peyer's patch,PP),供巨噬细胞吞噬和清除。
沙门菌的第2种突破方式是利用自身的T3SS-1系统,诱导肠上皮细胞发挥胞吞作用。Hi1D是沙门菌入侵宿主的关键调节分子,由其感知肠腔内高渗低氧环境的信号启动转录,调控T3SS-1系统的组件、相关效应蛋白及其他转录因子。随后,沙门菌通过T3SS-1系统分泌SopE、SopE2和SopB等感染早期效应蛋白,激活细胞分裂周期蛋白42(cell divisioncycle protein 42,Cdc42)等Ras超家族三磷酸鸟昔结合蛋白Rho GTP酶的活性,从而诱导宿主细胞肌动蛋白骨架重排,促进细胞的胞吞作用,并触发胞内膜性结构的形成。此外,SipA和SipC等效应蛋白可直接与T3SS-1在宿主细胞注射部位的肌动蛋白结合从而发挥上述细胞骨架重排等效应。一旦进入宿主细胞,沙门菌可分泌SptP和SspHl等效应蛋自,逆转细胞骨架发生的改变,有利于维持宿主细胞的稳定,从而保证自身存活。细胞内的膜性结构,经部分T3SS-2效应蛋白修饰后,将胞质内的沙门菌包裹形成含沙门菌的囊泡(Salmonella-containing vacuole,SCV)(以下简称“囊泡”)免受不利因素的影响。囊泡内环境酸化(pH5-5.5)、抗菌肽增加、钙离子Cat'和镁离子Mg‘等二价阳离子以及磷酸盐浓度降低等累积效应,促进T3SS-2表达和SifA、SseG和SseF等效应蛋白的分泌,有利于沙门菌诱导的丝状结构(Salmonella-induced filaments,Sifs)形成。在Sifs的牵引下,囊泡逐步迁移至靠近细胞核的高尔基体附近,以获得更多能量和营养物质。尽管有研究发现鼠伤寒沙门菌可以游离于胞浆大量繁殖,但囊泡仍被认为是沙门菌胞内繁殖的主要场所[2]。
除上述两种途径外,细胞旁路途经亦是沙门菌突破肠黏膜上皮屏障的重要方式。一方面,沙门菌可通过SopB,SopE,SopE2和SipA等效应蛋自破坏肠上皮细胞间紧密连接的结构和功能,有利于自身入侵;另一方面,CX3CR1+巨噬细胞和树突状细胞也可从细胞旁路直接伸出伪足,捕捉肠腔内的沙门菌,穿过肠勃膜上皮。沙门菌突破肠黏膜上皮屏障到达派尔集合淋巴结后,NTS感染往往局限于胃肠道,但严重时可同TS一样播散至肝和脾等脏器,引发严重全身感染。
鼠伤寒沙门菌与巨噬细胞的相互作用
在NTS各血清型导致的全身感染中,鼠伤寒沙门菌是最常见的致病菌之一,约占65.2%"'。鼠伤寒沙门菌进人消化道后,除利用上述3种方式突破肠黏膜上皮屏障外,还诱导肠上皮细胞凋亡——一种受半胱氨酸天冬氨酸蛋白酶(caspase)家族成员调控的细胞程序性死亡方式,使细胞脱落,从而破坏上皮屏障。作为兼性胞内菌,鼠伤寒沙门菌到达固有层后,可被巨噬细胞主动吞噬或诱导巨噬细胞吞噬。
巨噬细胞由骨髓造血干细胞和定向祖细胞分化发育而来,广泛分布于血液、骨髓、淋巴结、肝和脾等组织器官,其胞质中富含溶酶体颗粒,既可直接吞噬和杀伤病原菌,发挥非特异性免疫应答作用,又参与抗原的摄取、加工、处理和递呈,启动特异性免疫应答此外,巨噬细胞还可分泌细胞因子,募集活化更多的巨噬细胞、中性粒细胞和淋巴细胞等免疫细胞,在宿主抗感染免疫中发挥重要作用。入侵的鼠伤寒沙门菌一方面遭遇巨噬细胞吞噬和杀伤,另一方面其以巨噬细胞为庇护场所,抵抗药物、抗体及非特异性免疫分子,如补体、溶菌酶和防御素等的杀伤,并随之播散到肝和脾等肠外组织产生新的病灶,导致全身感染。在感染的过程中,鼠伤寒沙门菌主要触发巨噬细胞自噬(autophagy)、焦亡(pyroptosis)和程序性坏死(necroptosis)等细胞死亡方式。巨噬细胞利用这些机制释放入侵的细菌,促进宿主将其清除。为了抵御宿主的抗感染免疫杀伤,实现自身生长、繁殖和扩散,鼠伤寒沙门菌系统地进化了利用细胞这些机制的能力。
细胞自噬是真核细胞进化的高度保守的防御机制。在饥饿或缺氧等应激状态下,自噬相关基因调控内质网或高尔基体脱落脂质双分子层形成吞噬泡,随后通过伸展变形、包裹和闭合形成双层膜结构的自噬体,再与溶酶体融合形成自噬溶酶体,最终由溶菌酶、组织蛋白酶等将受损的细胞器、错误折叠的蛋白质或入侵的微生物消化降解。虽然细胞自噬在大多数情况下有利于细胞的存活,但也可引起细胞自噬性死亡。鼠伤寒沙门菌进入巨噬细胞后,利用囊泡逃避细胞自噬,但“注射器”T3SS可破坏囊泡的完整性,逸出的鼠伤寒沙门菌被胞质中的泛素迅速识别并泛素化修饰,发出“吃我”的信号以募集自噬受体蛋白,启动细胞自噬。与此同时,暴露的半乳糖凝集素8募集自噬受体蛋白启动细胞自噬,使躲藏在囊泡中的鼠伤寒沙门菌通过自噬途径被降解。然而鼠伤寒沙门菌分泌的效应蛋白SifA能有效维持囊泡膜的完整性。鼠伤寒沙门菌还可分泌效应蛋白SseL,通过去泛素化作用抑制细胞自噬。沙门菌质粒毒力基因spvB编码的效应蛋白SpvB具有ADP一核糖基转移酶活性,可以共价修饰G一肌动蛋白(G-actin)单体,抑制其聚合形成F一肌动蛋白(F-actin),从而影响细胞骨架解聚。笔者实验室前期研究发现,效应蛋自SpvB可通过抑制白噬体的形成抑制细胞自噬川。鼠伤寒沙门菌还可利用分子伴侣介导的细胞自噬,为其在胞内的存活和繁殖提供营养物质[5]另外,鼠伤寒沙门菌分泌的效应蛋白SipB进入巨噬细胞后,可通过心肌磷脂等脂质体定位于线粒体旁,在破坏线粒体的同时,将其限制在类似自噬体的多层膜结构中,诱导巨噬细胞自噬性死亡。
细胞焦亡是一种由消皮素D(gasdermin D,GSDMD)介导的细胞程序性死亡,最初因同样受caspase家族成员的调控而归类于细胞凋亡,表现为细胞不断肿胀直至细胞膜破裂,细胞内容物的流出,进而激活强烈的炎症反应。适度炎症反应有利于病原菌的清除,不足则易造成病原菌播散和感染持续,但过度却会加重组织损伤鼠伤寒沙门菌虽然由囊泡庇护,但是巨噬细胞可通过模式识别受体(pattern recognitionreceptors,PRRs)感知微环境中病原相关分子模式(pathogen一associated molecular patterns,PAMPs),从而激活炎症反应对抗鼠伤寒沙门菌的入侵。炎症反应途径可分为依赖caspase 1的经典途径和依赖caspase 4或caspase 5(小鼠体内为caspase 11)的非经典途径。鼠伤寒沙门菌的鞭毛蛋自Flagellin、T3SS-1结构蛋白PrgJ和PrgI均可作为PAMPs被巨噬细胞的PRRs识别,激活炎性小体4(NLRC4),活化caspase 1前体,启动经典途径。鼠伤寒沙门菌的细胞壁脂多糖(lipopolysaccharide,LPS)可以直接与胞质中的caspase 4、5或11前体结合活化,并启动非经典途径。Caspase 1、4、5和11均可作为分子剪刀,对底物GSDMD进行切割,使GSDMD的自身抑制结构域羧基端(GSDMD-CT)与活性结构域氨基端(GSDMD-NT)分离。GSDMD-NT通过保守序列与细胞膜内侧的丝氨酸磷脂、磷脂酰肌醇和心肌磷脂等特定类型的磷脂结合、进而寡聚成外直径约25纳米,内直径约10~15纳米的16元聚合体孔道,即焦亡孔道。活化的caspase 1还可切割促炎细胞因子白细胞介素-1β(interleu kin-1β,IL-1β)和IL-18的前体使其成熟成熟的IL-1β和IL-18通过焦亡孔道释放至胞外引发炎症反应细胞外的水分子H2O和钠离子Na+等则由焦亡孔道进入,导致细胞肿胀破裂,胞浆及小分子物质流出加重炎症反应。在感染与抗感染过程中,鼠伤寒沙门菌亦进化了其致病机制。例如,沙门菌质粒毒力基因spvC编码的效应蛋白SpvC具有磷酸苏氨酸裂解酶活性,可使丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路中双重磷酸化的细胞外调节蛋白激酶(extracellularregulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)和p38不可逆的去磷酸化失活,通過抑制MAPK信号转导通路,降低促炎细胞因子和趋化因子的水平抑制炎症反应[6]沙门菌质粒毒力基因spuD编码的效应蛋自SpvD则具有半胱氨酸水解酶活性,可通过干扰β核素输出蛋白2(β-karyopherin exportin 2,Xpo2)阻断细胞核内蛋自p65的异位,进而抑制核因子κB(nuclear factorκB,NF-κB)信号转导通路而抑制炎症反应[7]。另外,巨噬细胞还可通过细胞焦亡,将囊泡内的鼠伤寒沙门菌一起包裹在破损的细胞残体中,形成孔诱导的胞内陷阱(pore-induced intracellular traps,PITS)使鼠伤寒沙门菌活动受限,在趋化因子的作用下募集中性粒细胞,吞噬清除PITS,从而限制鼠伤寒沙门菌播散[8]。
细胞程序性坏死同细胞焦亡一样,也是一种细胞程序性死亡方式。与不受基因调控的被动坏死(necrosis)不同,细胞程序性坏死受肿瘤坏死因子受体(tumornecrosis factor receptor,TNFR)或PRRs调控。肿瘤坏死因子(TNF)与TNFR或PAMPs与PRRS特异性结合后,在细胞内募集一系列蛋白形成包含接头互作蛋白激酶-1(receptor-interacting protein kinases-1,RIPK-I)的复合体Ⅰ和包含RIPK-3的复合体Ⅱ。复合体I的RIPK-1与复合体Ⅱ的RIPK-3相互磷酸化后组装成坏死小体(necrosome),接着募集混合系列蛋自激酶结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)使其磷酸化。磷酸化的MLKL同GSDMD-NT一样,在细胞膜上寡聚形成坏死孔道,细胞外的H2O和Na+等内流,细胞肿胀破裂死亡。鼠伤寒沙门菌感染巨噬细胞时,可下调细胞程序性坏死的经典抑制剂caspase 8的表达,同时诱导巨噬细胞自分泌I型干扰素(interferon,IFN),促进RIPK-1和RIPK-3组装成坏死小体启动细胞程序性坏死,释放出大量的炎性物质加剧炎症反应,加重组织损伤。
除巨噬细胞外,中性粒细胞作为血液中数量最多的白细胞,其胞质富含嗜天青颗粒和中性颗粒,可杀伤和消化入侵的病原菌,在抗鼠伤寒沙门菌感染中也发挥重要作用。近年来研究发现,中性粒细胞除了通过脱颗粒作用(degranulation)和ROS等方式杀伤消化吞噬的鼠伤寒沙门菌,还通过非经典炎症反应途径及GSDMD-NT破坏细胞核膜、嗜天青颗粒膜、中性颗粒膜和细胞膜等,释放染色质和颗粒蛋自等到细胞外,形成中性粒细胞胞外陷阱(neutrophil extracellular traps,NETS)捕获杀伤胞外游离鼠伤寒沙门菌[9]。NETs引起的中性粒细胞死亡(NETosis)又将胞内的鼠伤寒沙门菌释放至胞外,促进宿主对其清除。感染的发生、发展与结局是沙门菌与宿主这对矛盾体博弈的结果,随着双方力量的消长而出现动态变化。沙门菌强,则感染持续;宿主强,则感染治愈。
关于沙门菌的研究不仅局限于细菌致病机制,改造和利用沙门菌已成为近年来的研究热点。除已有的通过纯化沙门菌获得的荚膜多糖制成疫苗预防伤寒之外,人们还利用沙门菌胞内寄生的生物学特性,借助基因工程技术获得减毒株构建的新型疫苗应用于某些人畜共患病的防治;此外,还可以利用沙门菌减毒株作为基因传递载体,靶向聚集于乏氧的肿瘤组织,使外源基因得以表达,发挥抗肿瘤作用等[10]。综上,进一步研究沙门菌与宿主的相互关系,不仅有助于沙门菌感染的防治,还可为其他感染性疾病和肿瘤等的新药研发提供新思路。
[1]Besser J M.Salmonella epidemiology:A whirlwind of change.FoodMicrobiol,2018,71:55-59.
[2]Laughlin R C,Knodler L A,Barhoumi R,et al.Spatial segregationof virulence gene expression during acute enteric infection withSalmonella enterica serovar Typhimurium.MBio,2014,5(1):e00946-00913.
[3]Ao T T,Feasey N A,Gordon M A,et al.Global burden of invasivenontyphoidal Salmonella disease,2010.Emerg Infect Dis.2015,21(6)
[4]Chu Y,Gao S,Wang T,et al.A novel contribution of spvB topathogenesis of Salmonella Typhimurium by inhibiting autophagy inhost cells.Oncotarget,2016,7(7):8295-8309.
[5]Singh V,Finke-Isami J,Hopper-Chidlaw A C,et al.Salmonella co-optshost cell chaperone-mediated autophagy for intracellular growth.J BiolChem,2017,292(5):1847-1864.
[6]Haneda T,Ishii Y,Shimizu H,et al.Salmonella type 111 effector SpvC,a phosphothreonine lyase,contributes to reduction in inflammatoryresponse during intestinal phase of infection.Cell Microbiol,2012,14(4):485-499.
[7]Rolhion N,Fumiss R C,Grabe G,et al.Inhibition of nuclear transportof NF-K B p65 by the Salmonella type Ⅲ secretion system effectorSpvD.PLoS Pathog,2016,12(5):e1005653.
[8]Jorgensen 1,Zhang Y,Krantz B A.Pyroptosis triggers pore-inducedintracellular traps(PITS) that capture bacteria and lead to their clearanceby efferocytosis.J Exp Med,2016,213(10):2113-2128.
[9]Chen K W,Monteleone M.Noncanonical inflammasome signalingelicits gasdermin D-dependent neutrophil extracellular traps.SciImmunol,2018,3(26).
[10]Wang C Z,Kazmierczak R A,Eisenstark A.Strains,mechanism,andperspective:Salmonella-based cancer therapy.Int J Microbiol,2016,2016:5678702
關键词:沙门菌 致病性 入侵 巨噬细胞

