用进化的力量操纵微观世界
崔佳文 周佳海
2018年度诺贝尔化学奖授予美国加州理工学院教授阿诺德密苏里大学教授史密斯和英国医字研究理事会分子生物学实验室教授温特.以表彰他们在“酶定向进化”和“肽和抗体噬菌体展示”方面的贡献。
2018年10月3日,2018年诺贝尔化学奖揭晓。美国加州理工学院化学工程系教授阿诺德(F.H.Arnold)获得一半奖金,以表彰她在“酶定向进化”方面的贡献;另一半奖金授予美国密苏里大学教授史密斯(G.P.Smith)和英国医学研究理事会分子生物学实验室教授温特(G.P.Winter)爵士,以表彰他们在“肽和抗体噬菌体展示”方面的贡献。
酶和酶的定向进化
阿诺德是诺贝尔化学奖史上第5位获奖女性,之前4位女性是居里夫人(1911年)、居里夫人的女儿伊雷娜(Irene Joliot-Curie,1935年)、霍奇金(D.C.Hodgkin,1964年)和尤纳特(A.Yonath,2009年)阿诺德出生在一个核物理学家的家庭,受父亲的影响,本科就读于普林斯顿大学的机械工程和航天工程专业,博士阶段选择的是化学工程,然后转向生物工程。她的哥哥很早就是大学的病毒学和结构生物学教授,在她早期的成长道路上给予她许多帮助。
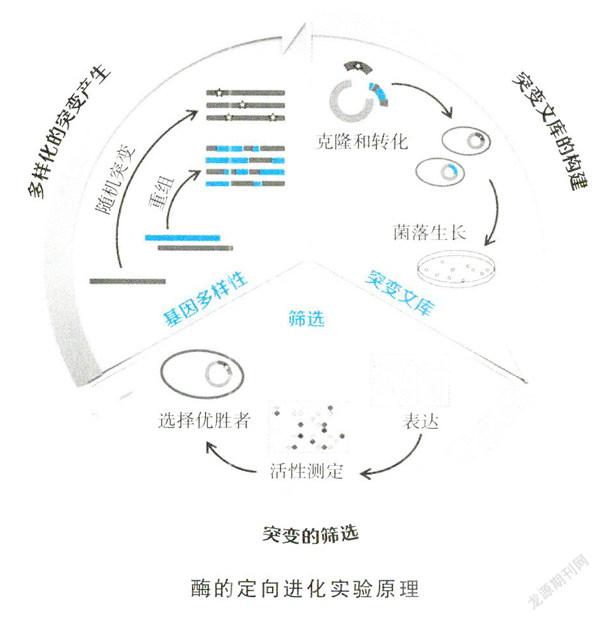
酶是一类大分子生物催化剂,目前已知的酶可催化超过5 000种生化反应。大部分的酶是蛋白质,少部分的酶是具有催化活性的RNA分子(这些酶被称作核酶)。与所有催化剂一样,酶通过降低反应活化能加快化学反应的速率。酶和其他催化剂的不同之处在于,它们的专一性要强得多几乎所有细胞内的代谢过程都离不开酶。酶能大大加快这些过程中各化学反应进行的速率,使代谢产生的物质和能量满足生物体的需求然而,一旦脱离了细胞内的环境,温度、酸碱度、盐浓度、有机溶剂等外在条件会极大程度地影响酶的稳定性、催化活性以及选择性,在体外,酶常常无法发挥其原本的性能此外,酶催化的专一性也往往决定了它作用的底物单一,难以拓展应用到其他非天然底物中为攻克这些弊端,酶的定向进化就成了必要的手段。
阿诺德从自然界的进化规律中找到灵感,率先使用定向进化技术来改造酶(这里仅指用作催化的蛋白质,不包括核酶)。她和来自中国的陈克勤博士为突破如何找到高效率方法来改变并筛选出适合特定工业环境下、具有催化活性的酶这一瓶颈问题,大胆地采用随机突变策略,通过引入突变并连续提高筛选压力获得具有多个突变组合的酶,这些酶能快速适应从来没有接触过的工业环境,实验获得了十分满意的结果[1,2]。他们从一种存在于白然界的枯草杆菌蛋白酶着手研究,率先将其编码基因进行随机突变,产生出多种存在着些许差异的枯草杆菌蛋白酶突变体库,然后分别检测它们在有机溶剂中的酶活性,从中筛选出活性最高的酶;随后针对第一轮得到的酶,再进行更多轮次的进化筛选,直到找出符合预期的活性最高的酶。在第三代枯草杆菌蛋白酶中,他们发现一种突变体溶解在60%二甲基甲酰胺中的催化效率比野生型酶高出256倍,这种活性水平与野生型酶在水溶液中的活性水平相当。基于此,阿诺德提出了“定向进化”这一概念,即通过一定程度地模拟自然进化与选择的过程,实现对蛋白质引入有益突变,从而改造蛋白质的功能[2]。
1998年,阿诺德和来自中国的博士生赵惠民发明了交错延伸技术t31通过在聚合酶链式反应(polymerasechain reaction,PCR)中把常规的退火和延伸合并为一步,并大大缩短其反应时间,达到了变换模板和交错延伸的目的。该法简便且有效,为酶的體外定向进化提供了又一强有力的工具、阿诺德和其他科学家通过定向进化提高了多种酶的催化活性、热稳定性、有机溶剂中的稳定性、对底物的立体选择性,甚至还能够创造出催化原本自然界中并不存在反应的新型酶。
酶定向进化实验的顺利开展,离不开酶突变体的产生、多样化组合和高效筛选。首先,在编码酶的基因水平上,尽可能多地人为造成随机突变或重组,形成一个庞大的基因突变库,然后再表达出相应的酶蛋白突变体库。随后在人工模拟的恶劣环境或要求下(如高温、高毒性),从库中定向筛选出具理想性状的蛋自突变体(如高活性、高选择性、高稳定性等)。最后,从选出的突变体中提取其基因作为母本,建立下一轮的酶基因突变库,实现酶的进化。
提到酶突变体的多样化组合技术,有一个人不得不提及。他就是已故的施特默尔(W.P.C.Stemmer)博士,他在1994年发展了一项新的基因改组(DNAshuflling)技术,让基因可以在试管里重新“洗牌”[4]。这种技术首先通过核酸酶将单个或一组基因随机打断,再通过基因扩增将它们连接起来,由于部分基因具有同源性,碎片基因可以实现错配杂交,当A基因和B基因连接在一起时,会形成新的组合,可高效地产生多样性的酶突变体库。如果把基因比喻成各种花色和数字的扑克牌,随机点突变就像是某一张或若干张扑克牌随机发生了改变,比如红桃7变成梅花K,小王变成了大王。而基因改组技术,则像是拿出不同的牌面洗到一起,由此得到了更丰富的多样性,也更有可能较快产生拥有优良性能的酶。同年,施特默尔利用该技术对阶内酞胺酶成功地进行了改组,经过3轮改组和两轮同野生型DNA的回交,去除了负突变,筛选到最低抑制浓度的突变子,其活性水平是野生型的32000倍[5]。
酶定向进化领域的另一位奠基人是德国科学院院士、上海有机化学研究所名誉教授雷茨(M.T.Reeetz),他于1997年首次将定向进化的概念和方法应用于对酶的手性改造,并引入到有机化学领域,用于不对称催化合成,创立了用于酶立体选择性改造的组合活性中心饱和突变[6]和迭代饱和突变技术[7],通过对定向进化的数据统计和模型设计,成功地实现了将庞大的酶突变体库缩小到1000个以内,使定向进化的工作开展得更便捷高效。为此,在第九届国际生物催化大会上,他被授予“2018生物催化奖终身成就奖”。
噬菌体展示技木
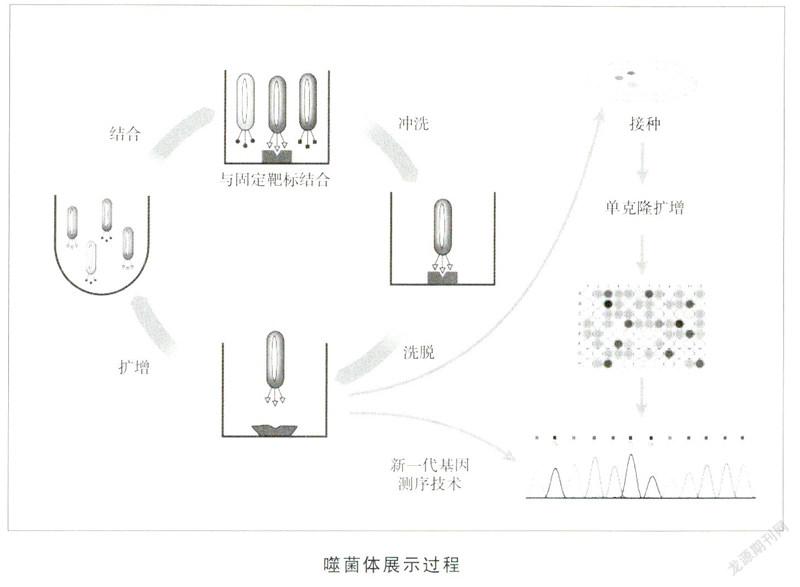
史密斯的贡献在于发明了一种名为“噬菌体展示”的新技术。他将特定蛋白质或多肽的遗传密码人工插入到编码噬菌体外壳蛋白基因的适当位置,使外源蛋白质或多肽随外壳蛋白的表达而表达,同时,它们随噬菌体的重新组装而被展示到噬菌体表面[8]。该展示技术第一次把蛋白质和对应的基因在一个极其简单的系统里直接建立了联系,解决了之前分子生物学家最为头痛的问题之一。这些展示的噬菌体可以对其他蛋自质、多肽或者DNA序列一起进行识别和筛选,从而检测展示的蛋白质与其他分子间的相互作用。在此基础上所发展而来的噬菌体展示克隆技术可应用于活性天然产物(如中药的有效组分)的靶标鉴定。
温特利用噬菌体展示技术进行抗体的定向进化,其目的是产生新的药物[9]。抗体的生产一般是用抗原免疫动物而得到,这种方法费时费力、成本高昂,此外如果用作药物,动物产生的抗体输入人体会被人体免疫系统识别为外来抗原而迅速被消灭掉。噬菌体展示技术能帮助生产可中和毒性物质、对抗自身免疫疾病的抗体,甚至治愈转移性肿瘤,如今许多畅销药品问世都有它们的功劳。温特采用这项技术制造的第一种药物“阿达木单抗”在2002年被正式批准,用于对类风湿性关节炎、牛皮癣以及炎症性肠道疾病的治疗。其注射液“修美乐”连续6年成为全球“药王”,2017年贡献了184.27亿美元营收。2017年6月,“修美乐”在中国又获批用于治疗新的适应症银屑病(俗称牛皮癣),成为中国首个用于治疗成年中重度慢性斑块型银屑病的全人源抗肿瘤坏死因子-α单克隆抗体。噬菌体展示技术正被大量用于抗体药物的研发,目前已上市的抗体药物中有近十种得益于该技术的研发。
人工進化的愿景
酶定向进化技术和噬菌体展示技术能在实验室中模拟自然界进化,采用这些技术,人们可以在体外大大加快生物进化的速度,创造出一系列具重要商业价值的基因和蛋白质,将会对人们生活的各个领域产生革命性的影响。定向进化技术为酶的改造提供了一种全新策略,经过这种方法筛选到的酶能够突破天然酶的诸多限制,大大拓展了应用范围。定向进化不仅可针对单一的酶进行,还可对一些重要天然产物的生物合成途径中的不同酶,同时进行改造和优化。目前基于定向进化技术获得的酶,已在药品制造、可再生能源、环保行业等方面得到广泛应用,极大地推动了人类的绿色化学发展。
在阿诺德的课题组里曾经有许多华人科学家的身影,他们做出了许多开创性的贡献,比如前面提到的陈克勤、赵惠民,还有现在杜克大学生物医药工程系任教授的游凌冲、华南理工大学生物和生物工程学院的林章凛教授等。他们利用酶定向进化技术在合成生物学、代谢工程、生物催化、生物制药等领域都做出了杰出贡献。
[1]Chen K,Arnold F H.Enzyme engineering for nonaqueous solvents:random mutagenesis to enhance activity of subtilisin E in polar organicmedia.Bio/Technol(N Y),1991,9(11):1073-1077.
[2]Chen K,Arnold F H.Tuning the activity of an enzyme for unusualenvironments:sequential random mutagenesis of subtilisin E forcatalysis in dimethylformamide.Proc Natl Acad Sci USA,1993,90(12):5618-5622.
[3]Zhao H,Giver L,Shao Z,et al.Molecular evolution by staggeredextension process(StEP) in vitro recombination.Nat Biotechnol,1998,16(3):258-261.
[4]Stemmer W P.DNA shuffling by random fragmentation and reassembly:in vitro recombination far molecular evolution.Proe Natl Acad SciUSA,1994,91(22):10747-10751.
[5]Stemmer W P.Rapid evolution of a protein in vitro by DNA shuffling.Nature。1994,370(6488):389-391.
[6]Reetz M T,Bocola M,Carballeira J D,et al.Expanding the range ofsubstrate acceptance of enzymes:combinatorial active-site saturationtest.Angew Chem Int Ed,2005,44(27):4192-4196.
[7]Reetz M T,Carballeira J D.Iterative saturation mutagenesis(ISM) forrapid directed evolution of functional enzymes.Nat Protoc,2007,2:891-903.
[8]Smith G P.Filamentous fusion phage:novel expression vectors thatdisplay cloned antigens on the virion surface.Science,1985,228(4705):1315-1317
[9]McCafferty J,Griffiths A D,Winter G,et al.Phage antibodies:filamentous phage displaying antibody variable domains.Nature,1990,34&(6301):552-554.
关键词:定向进化 酶工程 噬菌体展示 抗体药物

