大鼠体内的葛根素浓度及药代动力学
关彩华 招志辉 张韵
摘要 目的:评价大鼠体内葛根素浓度及药代动力学,为临床葛根素用药方案制定选择提供参考。方法:建立葛根素在大鼠体内浓度测定方法,采用该方法进行葛根素药代动力学实验室研究,分析文献报道的高效液相色谱(HPLC)分析法检测葛根素含量方法,制定色谱条件:色谱柱:AcclaimC18色谱柱(5 μm,4.6 mm×150 mm),流动相:甲醇:水,检测器:Modle 500 UV检测器;检测波长:250 nm,色谱工作站:N2000双通道工作站。配制葛根素标准液、外标物溶液、待测血浆样品液、空白对照液等。分别进样行梯度洗脱,验证方法的专属性、线性关系、回收率、精密度、稳定性。选择12只洁净大鼠,雌雄各半,随机分为2组,将采用药典葛根素推荐剂量下限给予腹腔灌胃设为低剂量组,给予药典推荐剂量上线腹腔灌胃设为高剂量组。2组大鼠分别于灌胃后不同时间采集眼眶静脉血,采用已验证的HPLC分离检测方法检测血浆葛根素药物浓度,采用DAS2.0统计软件处理葛根素浓度-时间数據,绘制药时曲线图,计算药代动力学指标并行组间比较。结果:1)拟定色谱条件下,大鼠血浆空白溶液、葛根素对照溶液、葛根素血浆样品溶液中主要成分保留时间差异明显,未发生重叠,说明该方法专属性较好。2)加入不同浓度葛根素对照品于大鼠血浆中,所得浓度-峰面积呈良好的线性关系,回归方程为:Y=3.957×106X-697.329,r=0.998 3,检测限:0.055~0.660 μg/mL。不同浓度葛根素对照品回收率为(103.110±0.521)%,高浓度和低浓度2组回收率比较,差异无统计学意义(P>0.05)。日内精密度为:3.14%,日间精密度5.26%;12 h内,放置不同时间的样品间葛根素含量检测相对偏差(RSD)为3.95%;不同灌胃剂量大鼠药时曲线均符合二室模型;大鼠灌胃葛根素后,不同剂量大鼠的AUC0-t、Cmax、MRT0-t、CL差异有统计学意义(P<0.05)。结论:采用HPLC检测大鼠体内葛根素方法可行,采用低剂量用药方案即可获得较好的药物吸收代谢效果,高剂量则影响葛根素吸收。
关键词 葛根素;结晶大鼠;高效液相色谱法;方法验证;药代动力学;临床用药指导;临床价值
Abstract Objective:To establish a method for concentration determination of puerarin in rats,and to study pharmacokinetics of puerarin in laboratory by this method,and to provide reference for formulation and selection of clinical puerarin medication scheme.Methods:Methods for determination of puerarin content by high performance liquid chromatography(HPLC)reported in literature were analyzed.Chromatographic conditions were established.Chromatographic column:Acclaim C18 chromatographic column(5 μm,4.6 mm×150 mm); mobile phase:methanol:water; detector:Modle 500 UV detector; detection wavelength:250 nm; chromatographic workstation:N2000 dual channel workstation.Puerarin standard solution,external standard solution,plasma sample solution for detection and blank control solution and other solutions were prepared.Gradient elution was used respectively.Specificity,linear relationship,recovery rate,precision and stability of the methods were validated.Twelve clean rats,half male and half female,were randomly divided into 2 groups.The group treated by intraperitoneal administration and gavage with lower limit of recommended dose of puerarin in the pharmacopoeia was taken as low dose group,and the group treated by intraperitoneal administration and gavage with upper limit of recommended dose of puerarin in the pharmacopoeia was taken as high dose group.Orbital venous blood was collected immediately,0.25 h,0.5 h,0.75 h,1 h,1.5 h,2 h,4 h,6 h and 8 h after the gavage.Plasma puerarin concentration was detected by the validated method of HPLC separation and detection.Concentration-time data of puerarin were processed by DAS 2.0 software.Drug-time curves were drawn and pharmacokinetic index was calculated and compared between the groups.Results:1)Under the proposed chromatographic conditions,retention time of main components in rat plasma blank solution,puerarin control solution and puerarin plasma sample solution was significantly different,and no overlap occurred,indicating that the method was specific.2)Different concentrations of puerarin control products were added into rat plasma,and there was a good linear relationship between the concentration and peak area.The regression equation was Y=3.957×106X-697.329,r=0.998 3; detection limit was 0.055~0.660 μg/mL.3)Recovery rate:the recovery rate of puerarin control products in different concentrations was(103.110±0.521)%,and there was no significant difference in the recovery rate between the high dose group and the low dose group(P>0.05).4)Precision:intraday precision was 3.14%,and day to day precision was 5.26%.5)Stability:within 12 h,relative deviation(RSD)of puerarin content between samples placed at different times was 3.95%.6)The drug-time curves of rats with different doses of gavage conformed to two-compartment model.7)After the gavage of puerarin,the AUC0-t,Cmax,MRT0-t and CL of rats with different doses were significantly different(P<0.05).Conclusion:It is feasible to detect puerarin in rats by high performance liquid chromatography.Good efficacy of drug absorption and metabolism can be achieved by using low dose medication scheme,while high dose can affect puerarin absorption.565BAB24-E58C-4B62-BC45-301E26F8074C
Key Words Puerarin; Clean rats; High performance liquid chromatography; Method validation; Pharmacokinetics; Clinical medication guidance; Clinical value; Research
中图分类号:R284 文献标识码:A doi:10.3969/j.issn.1673-7202.2019.10.014
葛根素(Puerarin)为豆科植物葛根中的主要有效成分。葛根为经典的解肌中药材,味甘、性辛,凉,其功效以解肌退热,透疹,生津止渴,升阳止泻为主,临床用于表证发热,项背强痛,麻疹不透,热病口渴,阴虚消渴,热泻热痢,脾虚泄泻等中医病证[1]。在《本草经疏》中有对葛根功效的描述:“葛根,解散阳明温病热邪主要药也,故主消渴,身大热,热壅胸膈作呕吐。发散而升,风药之性也,故主诸痹”。显示葛根善治各种痹证。《别录》:疗伤寒中风头痛,解肌发表出汗,开腠理,疗金疮,止胁风痛。现代药理实验显示,葛根的主要有效部位为异黄酮类衍生物,动物实验及临床实验均具有明确的扩冠、镇静的作用。精制提纯的葛根素相关制剂常用于退热、镇静、增加冠脉流量、保护因垂体后叶素导致的急性心肌出血[2-3],并广泛用于临床高血压、冠心病心绞痛患者的救治[4]。目前市售含葛根素的中成药制品较多,尤其是用于治疗高血压、冠心病慢性病的制剂[5-6]。但由于葛根素相关制品属传统中成药,不同药品厂家对于不同给药途径、用药方案的葛根素相关制品的药代动力学数据尚不完善,临床医生用药缺乏科学依据。基于此,本研究拟建立高效液相色谱法(HPLC)测定大鼠体内葛根素含量的方法,并采用该方法对葛根素在大鼠体内的药代动力学情况进行分析,为临床葛根素的用药方案选择提供参考。现将结果报道如下。
1 仪器与试药
1.1 仪器 高效液相色谱仪:日本岛津LC-20A高效液相色谱仪,搭配T进样泵,SPD-20A紫外检测器,色谱柱:Acclaim C18色谱柱,规格:孔径5 μm,尺寸:4.6 mm×150 mm,色谱工作站:岛津工作站,岛津LabSolutions工作站,玻璃器皿、超声振荡器、过滤系统、电子秤等为本实验室常规配制。
1.2 实验动物 SD大鼠购自长沙市天勒生物技术有限公司,雌雄各半,体质量为(220±20)g。
1.3 试剂试药 葛根素对照品:购自中国标准物质网:产品编号:3681-99-0,规格:20 mg/支,含量:Puerarin HPLC 98%(批号:110752-200912)。甲醇为色谱级,购自天津市康科德科技有限公司,水为实验室自制重蒸馏水。
1.4 供试品 葛根素由本实验室自制,经水提醇沉、分析柱分离精制得到。葛根鉴定由天津市药检所中药室鉴定为药典用品种。
2 方法与结果
2.1 色谱条件 分析文献报道的葛根素血浆浓度高效液相色谱(HPLC)检测方法,制定色谱条件:色谱柱:Acclaim C18色谱柱,规格:孔径5 μm,尺寸:4.6 mm×150 mm;流动相:甲醇:水(1:4),检测器:SPD-20AUV检测器;检测波长:250 nm,色谱工作站:岛津LabSolutions工作站,进样量:10 μL,流动相流速:1 mL/min,柱温:室温。
2.2 葛根素对照品溶液配制 采用减重法精密称取葛根素对照品10.000 mg,置于50 mL容量瓶中,加入色谱级甲醇约25 mL,充分振摇后,置于超声振荡器中助溶5 min,取出振摇,甲醇定容至刻度充分振摇均匀制成葛根素贮备液,保存于-20 ℃备用。分别用0.5 mL、1 mL、2 mL、3 mL、4 mL、5 mL、6 mL、7 mL大肚吸管精密吸取葛根素贮备液至25 mL容量瓶中,加甲醇定容至刻度,制作成葛根素系列浓度的标准液。
2.3 大鼠血浆空白样品配制 大鼠未灌胃葛根素前,采集大鼠眼眶静脉血样与肝素抗凝管中,以3 000 r/min、5 cm半径离心15 min,取0.2 mL上清液于装有2 mL甲醇溶液的离心管中,振摇混合,以3 000 r/min、半径5 cm离线15 min,取上清液与蒸发皿中,置于干燥箱中得残渣,取出残渣加入0.2 mL甲醇置于超声振荡器中助溶,经0.45 μm滤膜过滤得血浆空白样品溶液,按照葛根素大鼠血浆样品配制方法配制大鼠血浆空白液。
2.4 葛根素大鼠血浆样品制备 精密吸取大鼠空白血浆溶液100 μL,置于1.5 mL离心管中,精密添加10 μL葛根素标准溶液充分混合均匀,加入1 mL乙酸乙酯,混合均匀,以3 000 r/min、5 cm半径离心15 min。取上层有机层于蒸发皿中,采用氮气吹干,想蒸发皿中加入100 μL流动相复溶,离心得葛根素血浆样品。
2.5 生物样品制备 选择12只洁净大鼠,雌雄各半,随机分为2组,将采用药典葛根素推荐剂量下限给予腹腔灌胃设为低剂量组(100 mg/kg),将给予药典推荐剂量上线腹腔灌胃设为高剂量组(300 mg/kg)。2组大鼠分别于灌胃后即刻、0.25 h、0.5 h、0.75 h、1 h、1.5 h、2 h、4 h、6 h、8 h次采集眼眶静脉血,按照2.4向下方法制备供试品溶液。
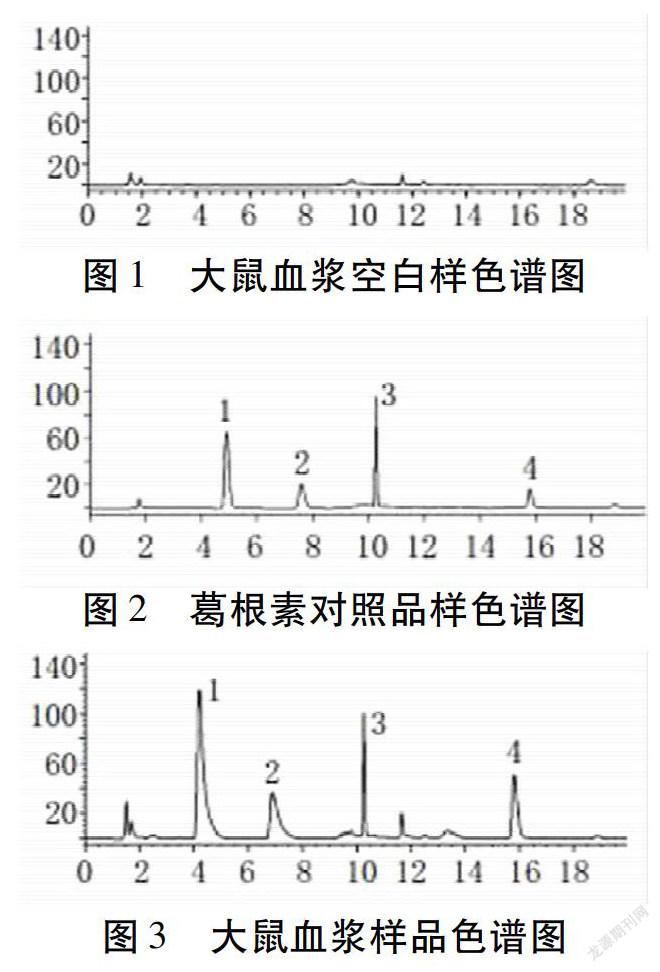
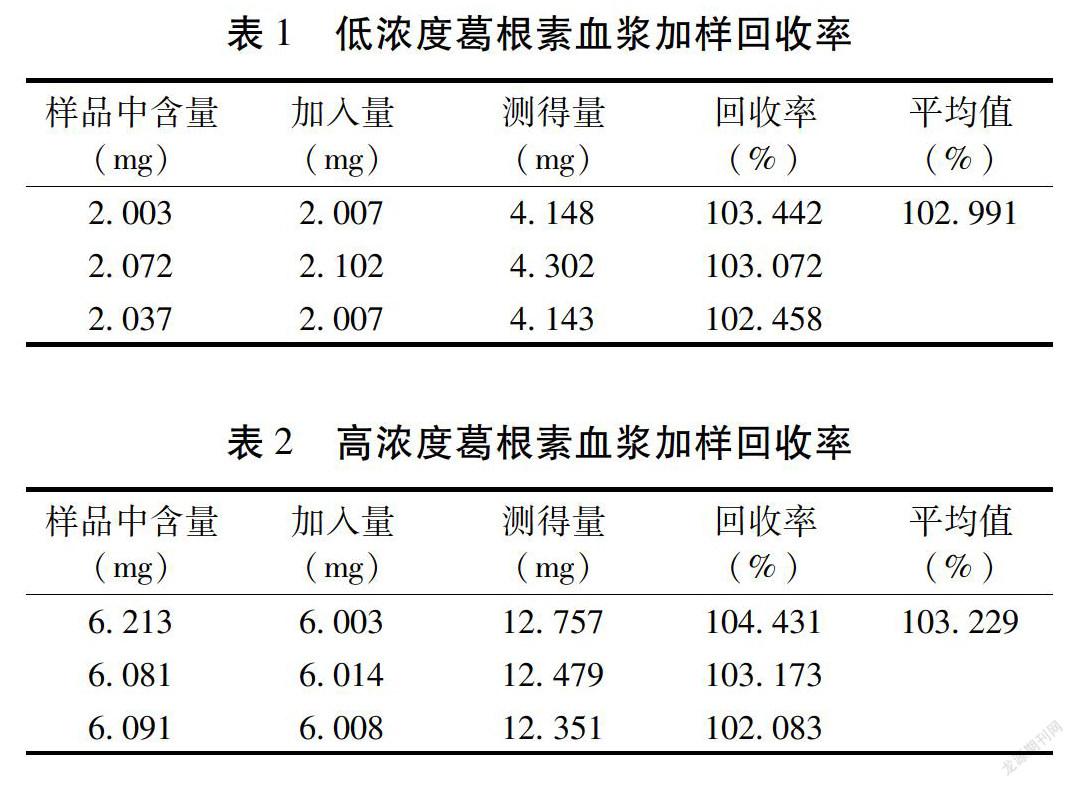
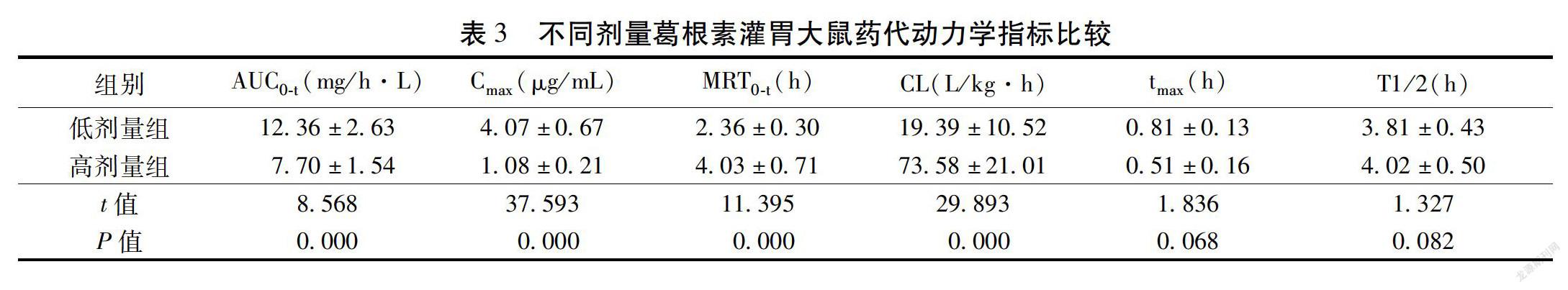
2.6 专属性验证 取12只大鼠空白血浆混合后制作成大鼠血浆空白溶液6份,每份100 μL,每份样品采用自动进样器进样10 μL,按照色谱条件进行洗脱、检测、数据分析,得到大鼠血漿空白样品色谱图。见图1。葛根素对照溶液进样检测得到葛根素对照品色谱图。见图2。葛根素对照品溶液加入大鼠空白血浆中振摇混匀定容,进样10 μL得到样品血浆色谱图。见图3。大鼠血浆空白溶液、葛根素对照溶液、葛根素血浆样品溶液中主要成分保留时间差异明显,未发生重叠,说明该方法专属性较好。565BAB24-E58C-4B62-BC45-301E26F8074C
2.7 线性关系验证 精密吸取大鼠血浆空白溶液100 μL共计8份分别于25 mL容量瓶中,按照顺序分别加入葛根素对照溶液标准系列溶液,定容至刻度,制成系列浓度的葛根素血浆供试品溶液。按色谱条件逐一进样10 μL,洗脱、检测、数据处理得到系列色谱图。以葛根素浓度为横坐标、葛根素峰面积为纵坐标绘制线性关系图,得到回归方程为:Y=3.957×106X-697.329,r=0.998 3,检测限:0.055~0.660 μg/mL。
2.8 回收率试验 取大鼠血浆空白溶液100 μL共6份分别于于50 mL容量瓶中,分成2组,一组加入100 mg/mL浓度的葛根素对照品溶液,另一组加入300 mg/mLl葛根素对照品溶液,按照2.4项下供试品溶液制备方法制成葛根素测试液。分别按照2.1项下色谱条件检测得到样品中含量检测结果。取上述2组溶液各100 μL,分别按照对应浓度加入葛根素100 mg/mL对照溶液、300 mg/mL对照溶液,按照2.1项下色谱条件进样检测,根据2次检测结果及加样结果计算葛根素回收率。试验结果,不同浓度葛根素对照品回收率为(103.110±0.521)%,高浓度和低浓度2组回收率比较,差异无统计学意义(P>0.05)。见表1、表2。
2.9 精密度验证 精密吸取浓度约20 μg/mL葛根素对照品溶液10 μL,分别在在2,1色谱条件下连续进样6次,计算每次检测得到的葛根素浓度,计算6次检测结果的日内RSD值,上述浓度的葛根素对照品溶液,分别于3 d内每天取10 μL进样检测,根据测得的葛根素浓度结果,计算日间RSD值。日内精密度为:3.14%,日间精密度5.26%。RSD均低于10%,说明整个色谱系统及操作方法具有较好的精密度。
2.10 穩定性验证 取一份葛根素供试样品溶液,具塞放于室温环境,在12 h内,分别每隔2 h进样检测1次,计算每次检测结果葛根素浓度,计算6份样品测试结果间的RSD值。12 h内,放置不同时间的样品间葛根素含量检测RSD为3.95%;说明葛根素溶液在12 h内稳定性较好。
2.11 大鼠葛根素药代动力学指标研究 2组大鼠分别于灌胃后即刻、0.25 h、0.5 h、0.75 h、1 h、1.5 h、2 h、4 h、6 h、8 h次采集眼眶静脉血,按照2.4方法制备供试品溶液。采用已验证的HPLC分离检测方法检测生物血浆葛根素药物浓度,采用DAS2.0统计软件处理葛根素浓度-时间数据,绘制药时曲线图,计算药代动力学指标并行组间比较。不同灌胃剂量大鼠药时曲线均符合二室模型。大鼠灌胃葛根素后,不同剂量大鼠的AUC0-t、Cmax、MRT0-t、CL差异有统计学意义(P<0.05)。见表3。
3 讨论
随着对葛根中药材药效学、药理学、毒理学研究的不断深入,葛根素的临床应用日趋广泛。各种不同的葛根素制剂如雨后春笋般出现。素葛根素注射液、葛根素提取的有效部位制成的各种片剂、缓释剂、控释剂、纳米制剂种类繁多,成为药物研究的热点[7]。葛根素目前广泛应用于心脑血管疾病的治疗和预防,绝大部分患者需要长期用药。近年来,葛根素相关制剂药物不良反应报道呈上升趋势,可能因为长期服用葛根素后在体内蓄积,对机体产生了一定的不良反应[8-9]。掌握葛根素在体内的吸收、分布、代谢、排泄过程相关数据,是临床医师拟定用药方案最为重要的基础参考数据,是保证药品技能发挥应有疗效,又能确保用药安全的基础[10-11]。过量过快应用葛根素可能导致的药物不良反应主要有:过敏反应(药物热、皮疹、过敏性哮喘、过敏性休克)、溶血性贫血(腰痛、排尿困难和血尿),临床有因溶血性贫血致死病例报道。葛根素对机体肝、肾损害也有报道[12-13]。而过低剂量可能不能保证药物治疗效果。对葛根素在体内的药代动力学情况进行研究,指导临床用药显得尤为重要。
高效液相色谱法(HPLC)是临床广泛应用的一种中药材及其制品的质量分析方法。因为中药材及其制品成分复杂,常规的光学检测技术检测需要所分析的成分有特异性的吸收波长,HPLC通过固液相极性差异对不同极性的成分进行分离,连接相应的检测器,在特定波长处检出处不同特性的成分,从而对所需要控制的有效成分含量进行检测[14]。中药现代化的指纹图谱以HPLC为最主要的检测手段,也可连用气相色谱、质谱等分离效果更好、检测更为精确的仪器作为检测手段[15-16]。
大鼠体内葛根素含量检测方法尚无国家标准,本研究根据临床文献[17-18]及自身多年应用HPLC分析中药及其相关之际的经验,拟定色谱条件,并对其进行方法学验证,结果显示,本方案拟定的色谱条件具检测大鼠体内葛根素浓度,具有较好的专属性、线性关系良好;同时具有较高的回收率、精密度、稳定性。按照药代动力学试验常规,对大鼠给予不同剂量的葛根素,结果显示,大鼠灌胃低剂量葛根素后,其AUC0-t、Cmax明显高于高剂量组大鼠,而MRT0-t、CL明显低于高剂量大鼠。其他药动学指标比较,差异无统计学意义。分析AUC0-t、Cmax是药物吸收程度的指标,小剂量组大鼠此两指标均高于高级2组大鼠,说明低剂量葛根素具有更好的吸收效果。而MRT0-t、CL时间长说明在体内消除速率较慢,药效时间更长。上述结果说明,低剂量给药方案在发挥药效方面更具优势,这一结果与文献[19]的研究结果一致。
综上所述,采用HPLC检测大鼠体内葛根素方法可行,采用低剂量用药方案即可获得较好的药物吸收代谢效果,高剂量则影响葛根素吸收。
参考文献
[1]虞立,张宇燕,杨洁红,等.养阴通脑颗粒中主要有效部位在脑缺血大鼠体内的药物代谢动力学研究[J].中华中医药杂志,2017,32(9):4111-4114.
[2]杨春静,张萌,崔婉华,等.黄酮类化合物药代动力学研究评述[J].中医学报,2018,33(6):1065-1070.565BAB24-E58C-4B62-BC45-301E26F8074C
[3]李青倩.超高效液相色谱串联质谱法中药多种成分在大鼠血浆的药代动力学的研究[D].南宁:广西大学,2018.
[4]杨春静,张萌,崔婉华,等.黄酮类化合物药代动力学研究现状[J].中医学报,2018,33(6),1065-1070.
[5]房伟.葛根药理作用研究进展[J].中国药物经济学,2017,12(11):159-160.
[6]董林娟,张文娟,刘诗雨,等.龙脉宁方中葛根素在心肌缺血大鼠体内药动学-药效学相关性研究[J].中国中药杂志,2016,41(8):1535-1540.
[7]赵洁,苏畅,温德广,等.葛根素及葛根提取物在大鼠体内的药动学研究[J].中国药房,2016,27(10):1311-1314.
[8]邓向涛,郝海军,贾幼智,等.葛根素磷脂复合物及其固体分散体的药代动力学及生物利用度研究[J].中药材,2015,38(9):1974-1976.
[9]姜丽,严小军,李云,等.葛根素体内药代动力学研究进展[J].江西中医药,2015,46(8):70-74.
[10]张伟,李耀华,梁臣艳.中药药代动力学研究进展[J].亚太传统医药,2015,11(14):37-38.
[11]姜丽,余兰彬,徐国良,等.天麻素和葛根素在大鼠体内联合应用的药动学研究[J].中国中药杂志,2015,40(6):1179-1184.
[12]张丽娜,雍小兰,金伟华.关注葛根素注射液的不良反应[J].西南军医,2004,6(2):84-86.
[13]李丹.葛根素注射液含量测定、体内代谢及其对CYP2E1活性的影响[D].开封:河南大学,2014.
[14]高红梅.PDD1滴丸的药代动力学研究[D].长春:長春中医药大学,2015.
[15]王锦.UHPLC-MS/MS法同时测定中药多种有效成分在大鼠体内的血药浓度及其药代动力学研究[D].南宁:广西大学,2015.
[16]姜丽,余兰彬,徐国良,等.天麻素和葛根素在大鼠体内联合应用的药动学研究[J].中国中药杂志,2015,40(6):1179-1184.
[17]梁艳,邢蓉,刘嘉莉,等.药代动力学新技术与新理论的研究进展[J].中国药科大学学报,2014,45(6):607-616.
[18]陈丽兰.葛根素自微乳在大鼠体内的药代动力学分析[J].海峡药学,2014,26(12):32-33.
[19]胥秀英,郑一敏,傅善权,等.小鼠血浆中葛根素的含量测定及其药代动力学研究[J].重庆中草药研究,2004(1):30-32.
(2018-11-30收稿 责任编辑:杨觉雄)565BAB24-E58C-4B62-BC45-301E26F8074C

