对虾养殖高效降解氨氮微生态菌的筛选与鉴定
雷阳 张倩 陈钰 范玲玉 郑毅


摘 要:氨氮污染严重影响对虾健康养殖,为了筛选适用于对虾养殖高效降解氨氮微生态菌,从实验室前期分离的25株菌株中,通过氨氮降解检测筛选得到氨氮降解效果较强的4株菌株FS007、FS008、FS017、FS025,其中FS017菌株为最佳氨氮降解菌株,对其培养24 h后进行形态学鉴定:菌落呈白色,表面湿润,边缘光滑呈圆形,中间凸起,有黏液;细胞革兰氏染色呈阳性,杆状,聚合在一起呈短链状或念珠状排列,芽孢椭圆形,中生。生理生化试验:酪素、葡萄糖、明胶、木糖、甘露醇、阿拉伯糖、淀粉、柠檬酸、硝酸盐还原、甲基红试验、过氧化氢酶、VP反应、需氧性、NaCl(2%~12%)等都表现为阳性,而产气、果糖、丙酸盐H2S等表现为阴性。通过16S rDNA分子鉴定,确定该菌为贝莱斯芽孢杆菌Bacillus velezensis。
关键词:对虾养殖氨氮降解;菌种鉴定;筛选;贝莱斯芽孢杆菌
中图分类号:S 966.9 文献标志码:A 文章编号:0253-2301(2019)10-003
DOI: 10.13651/j.cnki.fjnykj.2019.10.003
Abstract: The pollution of ammonia nitrogen has seriously affected the healthy aquaculture of shrimp. In order to screen the microecological bacteria suitable for the efficient degradation of ammonia nitrogen in shrimp aquaculture, four strains including FS007, FS008, FS017 and FS025 with the strong effect of ammonia nitrogen degradation were obtained from 25 strains isolated from the early stage of the laboratory through the detection of ammonia nitrogen degradation. Among them, FS017 was the best strain with the degradation of ammonia nitrogen. After 24 h of culture, its morphological identification was carried out: The bacterial colony was white, the surface was wetting, the edge was smooth and round, and there was mucilage in the middle, while the cells were positive for gram staining, rod-shaped and arranged in short chain or Beadlike chain together with elliptic and central endospores. And the physiological and biochemical tests were also carried out: the results of casein, glucose, gelatin, xylose, mannitol, arabinose, starch, citric acid, nitrate reduction, methyl red test, catalase, VP reaction, aerobism and NaCl(2%-12%) were all positive, while the results of aerogenesis, fructose and propionate H2S were negative. Therefore, the bacterium was identified as Bacillus velezensis by 16S rDNA molecular identification.
Key words: Degradation of ammonia nitrogen in shrimp aquaculture; Identification of strains; Screening; Bacillus velezensis
近20年來,水产养殖特别是虾养殖迅速发展,尤其在中国,已成为最重要的渔业生产之一。2018年,虾类总产量为1161340 t,占甲壳类产量的80.93%[1]。随着我国对虾养殖产业的迅速发展,养殖环境水质的恶化以及对虾疾病频发已经成为不容忽视的问题,其中养殖水体氨氮过高是影响对虾养殖产业的一个重要因素。氨氮是对虾养殖中一种主要污染物,进入组织液内会抑制对虾生长,降低繁殖能力,甚至引起死亡,严重影响了对虾养殖产业,对虾养殖池塘中的氨主要是来自于对虾排泄的结果,是蛋白质代谢的最终产物,也是粪便、未食用饲料和其他有机物中有机氮矿化的结果[2-3]。一般情况下,对虾可耐受0.4 mg·L-1的氨氮和2 mg·L-1的NO2N[4],一旦超出范围,高浓度的氨氮和NO2N,特别是非离子态NH3会直接导致对虾死亡,大量的排泄物和残留的饵料会缓慢下沉并积聚在池塘的底部,病原体将继续生长,池底底泥的缺氧严重影响了对虾的生长环境导致其成活率不断下降[5- 6],因此如何控制养殖水体中氨氮的含量,保持水质良好是对虾养殖面临重要问题,其中最有效的方法是利用微生态菌的对氨氮分解效应,实现健康养殖。本研究拟分离筛选高效降解氨氮菌株,并进行菌种鉴定,以期制成微生态制剂应用于对虾养殖。
1 材料与方法
1.1 试验材料
1.1.1 试验菌种 25株芽孢杆菌Bacillussp.,本实验室前期从对虾养殖废水中分离所得,保藏菌种(编号为FS001~FS025)。
1.1.2 菌种培养基配方 蛋白胨10.0 g·L-1、牛肉膏3.0 g·L-1、NaCl 5.0 g·L-1、琼脂1.5%~2%, pH 7.0~7.2,121℃灭菌20 min。
1.1.3 模拟养殖污水配方 葡萄糖0.170 g·L-1、可溶性淀粉0.160 g·L-1、NH4Cl 0.0255 g·L-1、无水乙酸钠0.233 g·L-1、蛋白胨0.158 g·L-1、牛肉膏0.040 g·L-1、(NH4)2SO4 0.0284 g·L-1、KH2PO4 0.020 g·L-1、无水碳酸钠0.060 g·L-1。
1.1.4 高盐度氨氮海水 MgCl2·6H2O 2.1 g·L-1、MgSO4·7H2O 4.2 g·L-1、KCl 0.9 g·L-1、CaCl2·H2O 1.2 g·L-1、NaCl 26.5 g·L-1、NH4Cl0.7638 g·L-1。
1.1.5模拟养殖氨氮污水 取100 mL高盐度氨氮海水于1000 mL容量瓶中,定容至刻度,倒出置于烧杯中,再按照模拟养殖污水配方依次加入药品,混匀静置。
1.2 试验方法
1.2.1 氨氮检测 氨氮的测定采用纳氏比色法[7-8]。
1.2.2 氨氮降解菌的筛选 将待筛选斜面菌种进行平板活化,从活化的平板上挑取单菌落接种于100 mL种子培养基中,30℃、150 r·min-1振荡培养24 h。以2%接种量将种子液接入50 mL发酵培养基中,同上培养条件培养12 h,得到菌体发酵液。取1 mL发酵液离心后的菌体接入模拟养殖氨氮污水中,30℃、150 r·min-1培养48 h,取样检测污水残余氨氮含量,从而筛选出具有高效去除氨氮能力的菌株。
1.2.3 菌落形态和细胞形态的观察 (1)菌落形态:将菌株划线于LB固体培养基上,30℃培养24 h,观察菌落特征。(2)细胞形态:在平板上挑取单菌落涂片固定,进行革兰氏染色,镜检观察细胞形态。
1.2.4 菌种的生理生化鉴定 待鉴定的菌株按照《伯杰氏细菌鉴定手册》进行糖或醇类利用试验(葡萄糖、阿拉伯糖、木聚糖)、硝酸盐还原试验、H2S产生试验、
VP试验、过氧化氢酶试验、淀粉水解试验、好氧性试验、明胶液化试验、甲基红试验(Methyl Red test,MR)、耐盐试验和不同温度下的培养试验等各项生理生化试验。
1.2.5 菌种的分子鉴定
1.2.5.1 提取基因组DNA 将分离筛选得到的菌株进行活化与发酵,发酵液镜检无杂菌后使用Ezup柱式细菌DNA抽提试剂盒提取基因组DNA。
1.2.5.2 16S rDNA PCR扩增
(1)原核生物16S rDNA的通用引物。
引物序列如下:
27F:5′AGAGTTTGATCCTGGCTCAG3′
1429R:5′GGTTACCTTGTTACGACTT3′
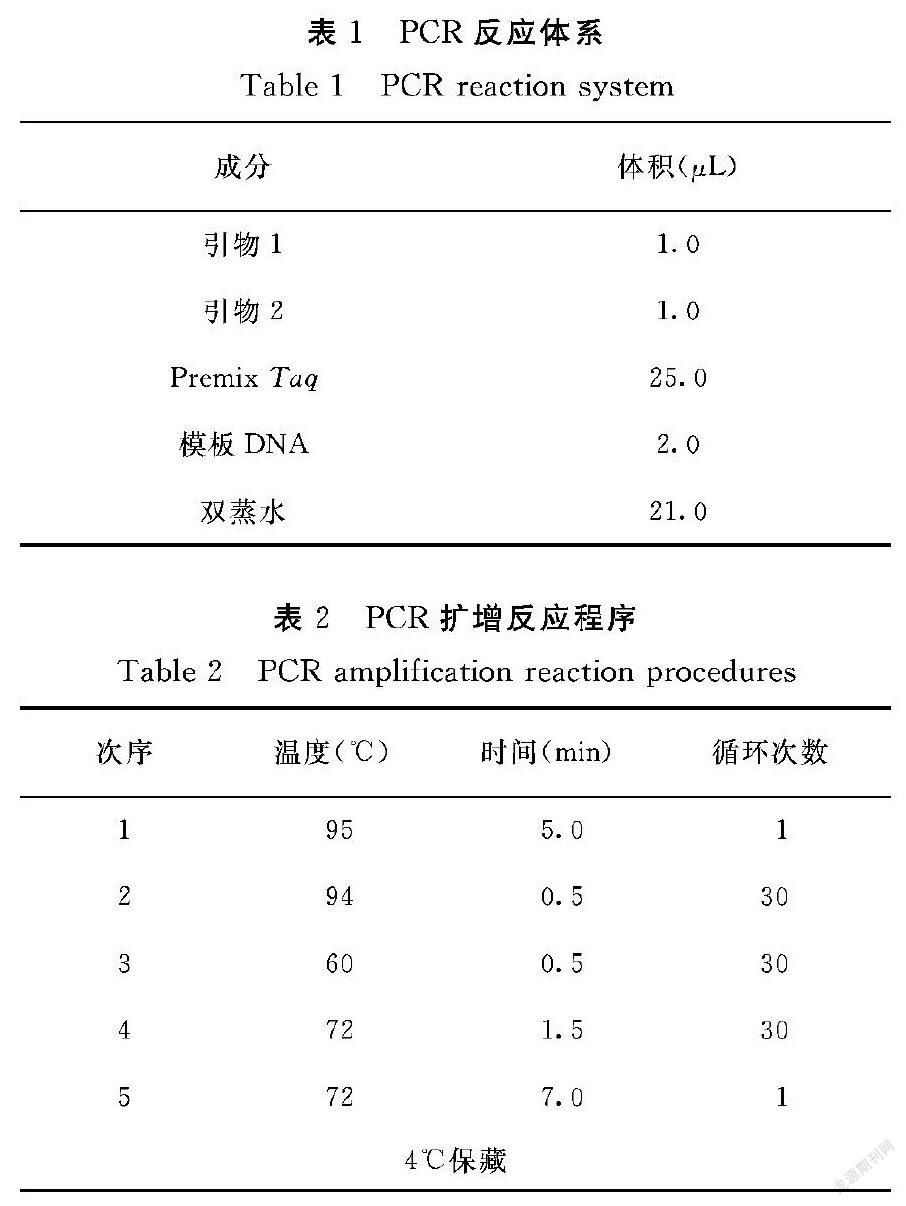
(2)PCR扩增体系
PCR扩增体系如表1所示。
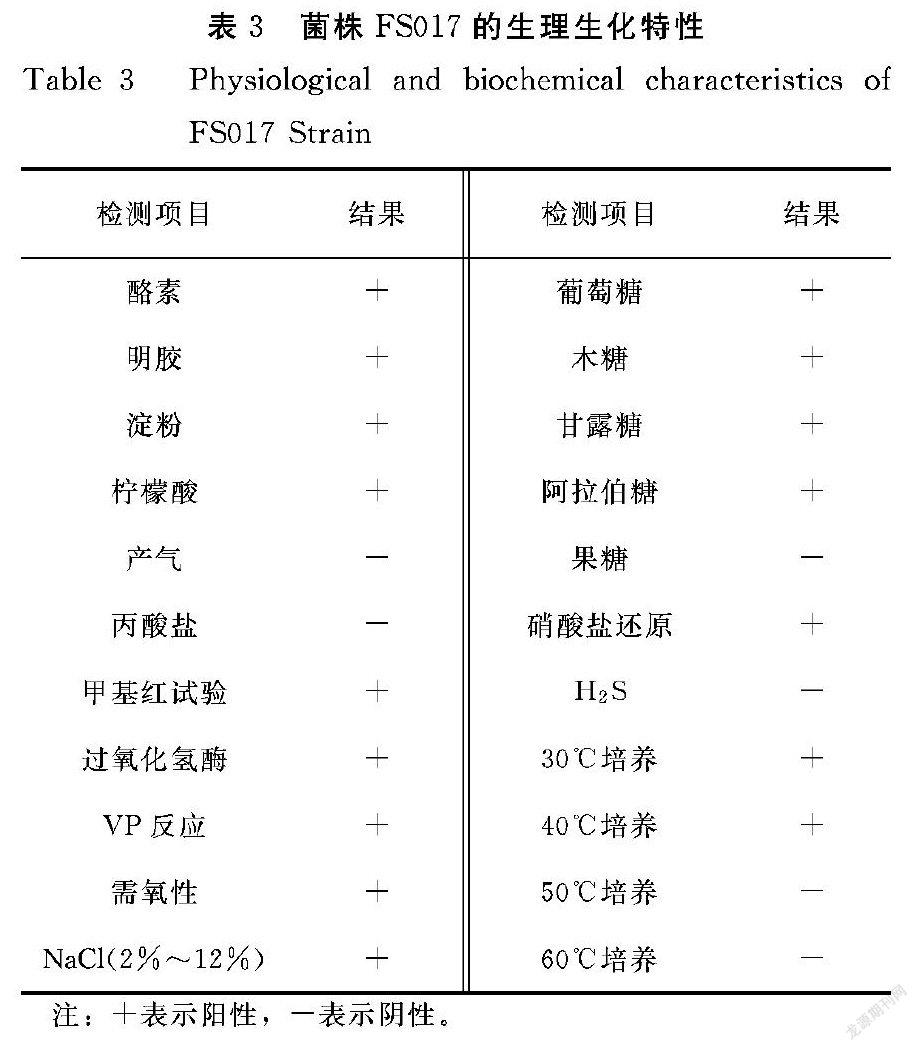
(3)PCR扩增反应程序
PCR扩增反应程序具体如表2所示。
PCR产物进行琼脂糖凝胶电泳,使用染料4S Red plus浸泡胶体15 min后紫外灯下观察结果。将体外扩增的16S rDNA基因扩增产物送到北京奥维森生物技术有限公司測序。
(4)16S rDNA进化树的构建
将得到的序列,在NCBI上进行核酸的同源性比对,选取和待测菌株的序列相似性比较高的多株菌进行序列的比对。用Mega6.06软件,采用Neighbour-Joining(邻位相连法)构建系统发育树,初步确定待测菌株的分类地位。
2 结果与分析
2.1 氨氮降解菌的筛选
取1 mL发酵液离心后菌体接入氨氮为40 mg·L-1模拟养殖氨氮污水中,30℃、150 r·min-1培养48 h,取样离心后测定上清液中残余氨氮含量,据此筛选出具有高效去除氨氮能力的菌株。从图1可以看出,编号为FS007、FS008、FS017、FS025的菌株氨氮的降解效果较理想,其中降解效果最显著的FS017菌株,氨氮降解率达到76.92%。
2.2 FS017菌种的鉴定
2.2.1 菌落特征 FS017菌株在LB培养基平板上培养24 h观察菌落形态特征,菌落呈白色,表面湿润,边缘光滑呈圆形,中间凸起,有黏液。
2.2.2 细胞形态特征 挑取活化24 h的FS017菌株,进行革兰氏染色制片,显微镜油镜下观察。FS017细胞革兰氏染色呈阳性,杆状,聚合在一起呈短链状或念珠状排列,芽孢椭圆形,中生。
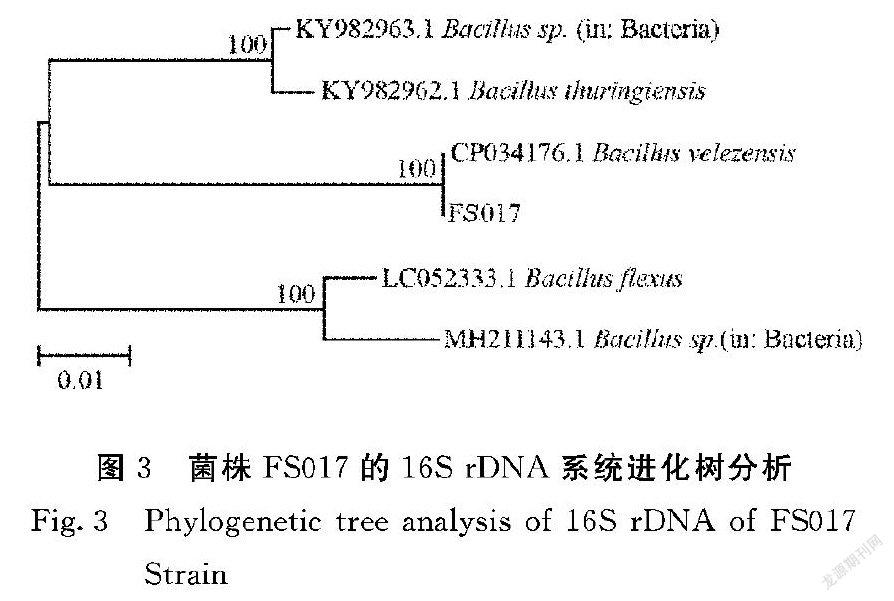
2.2.3 生理生化检测结果 根据《伯杰氏系统细菌手册》中有关芽孢杆菌的描述对FS017菌株进行各项生理生化试验。结果如表3,生理生化指标具备芽孢杆菌的典型特征。
2.2.4 菌株16S rDNA的鉴定
2.2.4.1 16S rDNA的扩增 用Ezup柱式细菌DNA抽提试剂盒提取FS017菌株的基因组DNA,并以其基因组DNA作为模板,进行16S rDNA的PCR扩增,用0.8%的琼脂糖凝胶检测PCR产物,PCR扩增电泳结果如图2所示,FS017菌株PCR的扩增条带约1500 bp,并将PCR产物进行测序。
2.2.4.2 16S rDNA序列和進化树的构建分析 菌株FS017的16S rDNA测序结果显示该序列长度为1402 bp,用Mega6.06软件对相关菌种16S rDNA进行序列比对并构建进化树。从图3可以看出,菌株FS017与Bacillus属的Bacillus velezensis的亲缘关系最近,表明菌株FS017属于Bacillus velezensis(贝莱斯芽孢杆菌)。
3 结论与讨论
芽孢杆菌作为水产微生态制剂的菌种广泛应用于对虾养殖中,由于可以分泌多种酶,具有降解水中剩余营养物质的作用,达到净化水质的目的。安健等[9]在对虾池塘中筛选到一株被命名为YX-6好氧反硝化细菌-凝结芽孢杆菌,并研究了其亚硝酸盐氮降解性能。赵坤[10]从对虾养殖环境中筛选4株降解氨氮效果较好的菌株,通过形态特征、生理生化特性以及16Sr DNA序列分析,4株菌都属于芽孢杆菌属。高海英[11]从海水池塘底泥样品分离得到228株芽孢杆菌,经过氨氮降解的筛选,亚硝酸盐氮等的筛选得到编号为T301和T905两株菌的降解能力较好,经过鉴定均为枯草芽孢杆菌。徐申波等[12]从凡纳滨对虾养殖水体中的水样、底泥以及对虾肠道和粪便样品中筛选到8株芽孢杆菌。本研究对前期分离的25株芽孢杆菌进行氨氮降解的筛选,获得4株降解氨氮效果较好的菌株FS007、FS008、FS017、FS025,其中FS017降氨氮能力最强,通过形态学、生理生化试验及16S rDNA分子鉴定方法确定该菌株为贝莱斯芽孢杆菌Bacillus velezensis,该菌株文献鲜有报道,为对虾养殖提供降氨氮的微生态菌株新资源。
参考文献:
[1]SANTHANAM P,ANANTH S,KUMAR S D,et al.Biofloc-Copefloc:A Novel Technology for Sustainable Shrimp Farming[J].Basic and Applied Zooplankton Biology,2019,(13):305-314.
[2]SANTACRUZREYES R A,CHIEN Y H,SANTACRUZREYES R A,et al.The potential of Yucca schidigera extract to reduce the ammonia pollution from shrimp farming[J].Bioresource Technology,2012,113(2):311-314.
[3]CAI J H,SHEN Q Y,ZHENG X Y.Advancement in Researches of Ammonia Pollution Hazards on Aquaculture and Its Treatment Technology[J].Journal of Zhejiang Ocean University,2010(2):167-172,195.
[4]王伟良, 李德尚, 董双林,等.养虾围隔中无机氮浓度与放养密度及环境因子的关系[J].海洋科学, 2000,24(10):44-47.
[5]吴定心.微生物制剂对南美白对虾养殖体系微生态的影响及其与藻类关系的研究[D].武汉:华中农业大学,2016.
[6]KUN W U,ZHONG Z,CHEN Y,et al.The relationship between climate change,feeding management and ammonia,nitrite and nitrate nitrogen in the Litopenaeus vannamei aquaculture ponds[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2017,56(1):102-114.
[7]中华人民共和国环境保护部.HJ535-2009 水质氨氮的测定 纳氏试剂分光光度法[S].北京:中国标准出版社,2009.
[8] 陈涛,刘永波,袁宏明.纳氏试剂比色法测定污水中氨氮的方法[J].中国新技术新产品,2010(3):18.
[9] 安健,宋增福,杨先乐,等.好氧反硝化细菌 YX6 特性及鉴定分析[J].中国水产科学,2010,17(3):561-569.
[10]赵坤.对虾养殖池塘有益芽孢杆菌的分离筛选及特性初步研究[D].青岛:中国海洋大学, 2014.
[11]高海英.海水池塘养殖净水芽孢杆菌的筛选、生物学特性及其应用研究[D].保定: 河北农业大学, 2008.
[12]徐申波,杨宁,冯玲倩,等.对虾养殖海区芽孢杆菌筛选及其水质净化研究[J].青岛农业大学学报(自然科学版),2016,33(4);317-336.
(责任编辑:柯文辉)

