鸡新城疫病毒、鸡细小病毒和禽流感病毒三重PCR检测方法的建立及应用
奉彬 谢芝勋 邓显文 张艳芳 谢丽基 谢志勤 范晴 曾婷婷 罗思思 黄娇玲






摘要:【目的】建立能同時检测鸡新城疫病毒(NDV)、鸡细小病毒(ChPV)和禽流感病毒(AIV)的三重PCR检测方法,为临床上快速诊断及有效防控NDV、ChPV和AIV的单一或混合感染提供技术支持。【方法】参考NCBI中已公布NDV的F基因(登录号DQ195265.1)、ChPV的NS1基因(登录号GU214704.1)和AIV的M基因保守区(登录号DQ485211.1),设计合成针对NDV、ChPV和AIV的特异性引物,应用这3对引物建立三重PCR检测方法,对反应体系及扩增程序进行优化,并通过特异性试验、敏感性试验、重复性试验和临床样品检测等评估其实用性。【结果】优化后的三重PCR反应体系为ChPV和AIV的上、下游引物各0.5 μL,NDV的上、下游引物各1.0 μL,NDV、ChPV和AIV的核酸模板各1.0 μL,Premix TaqTM 12.5 μL,无RNase水补足至25.0 μL。最佳扩增程序:95.0 ℃预变性5 min;94.0 ℃ 1 min,58.5 ℃ 1 min,72.0 ℃ 1 min,进行35个循环;72.0 ℃延伸10 min,12.0 ℃结束反应。建立的三重PCR能同时扩增出NDV(453 bp)、ChPV(687 bp)和AIV(239 bp)的特异性条带,对应的最低检测下限分别为2.5 pg NDV、6.4 pg ChPV和2.0 pg AIV,但扩增传染性支气管炎病毒(IBV)、禽呼肠孤病毒(ARV)、马立克病毒(MDV)、传染性喉气管炎病毒(AILTV)和禽肺炎病毒(APV)等病原体均呈阴性。应用建立的三重PCR对50份鸡喉头或泄殖腔棉拭子样品进行检测,结果显示有1份NDV阳性、9份ChPV阳性和2份AIV阳性样品,其中包含2份ChPV和AIV均呈阳性的样品,1份ChPV和NDV均呈阳性的样品,与常规PCR的检测结果一致。【结论】建立的三重PCR能同时对NDV、ChPV和AIV 3种病原进行特异性诊断,在混合感染病例鉴别诊断方面具有广阔的应用前景。
关键词: 鸡新城疫病毒;鸡细小病毒;禽流感病毒;三重PCR;特异性;敏感性
中图分类号: S854.44 文献标志码: A 文章编号:2095-1191(2019)11-2576-07
Development of a triplex PCR assay for detection of Newcastle disease virus,chicken parvovirus and avian influenza virus
FENG Bin, XIE Zhi-xun*, DENG Xian-wen, ZHANG Yan-fang, XIE Li-ji,
XIE Zhi-qin, FAN Qing, ZENG Ting-ting, LUO Si-si, HUANG Jiao-ling
(Guangxi Veterinary Research Institute/Guangxi Key Laboratory of Veterinary Biotechnology, Nanning 530001, China)
Abstract:【Objective】A triplex PCR assay for detecting Newcastle disease virus(NDV),chicken parvovirus(ChPV) and avian influenza virus(AIV) was developed to provide technical support for quick diagnosis and effective control of NDV,ChPV and AIV single or mixed infections. 【Method】According to the conserved regions of NDV F gene(GenBank: DQ195265.1), ChPV NS1gene(GenBank: GU214704.1) and AIV M gene(GenBank: DQ485211.1) in NCBI, three sets of specific primers targeting NDV, ChPV and AIV were designed. The triplex PCR for simultaneous detection of NDV,ChPV and AIV was established by optimizing the reaction conditions. The specificity, sensitivity, repeatability and clinical sample detection of the triplex PCR were detected. 【Result】The optimized triplex PCR assays were conducted as follows: 25.0 μL reaction mixtures were prepared containing 0.5 μL of each upstream and downstream primers of ChPV and AIV, 1.0 μL of each upstream and downstream primers of NDV, 1.0 μL of DNA/cDNA template of ChPV, AIV and NDV, separately, 12.5 μL of Premix TaqTM DNA polymerase, and 5.5 μL of RNase-free water. The thermal cycling conditions for amplifying the triplex PCR of NDV,ChPV and AIV were as follows: one cycle of denaturation at 95.0 ℃ for 5 min followed by 35 cycles of amplification at 94.0 ℃ for 1 min, 58.5 ℃ for 1 min and 72.0 ℃ for 1 min, and thereafter an extension at 72.0 ℃ for 10 min, and ended at 12.0 ℃. The results indicated that the triplex PCR assay successfully amplified 453 bp specific bands for NDV, 687 bp for ChPV and 239 bp for AIV. The lowest detection limit of the assay was 2.5 pg for NDV, 6.4 pg for ChPV and 2.0 pg for AIV. No specific amplification product was observed using infectious bronchitis virus(IBV), avian reovirus(ARV), Marek's disease virus(MDV), avian infectious laryngotracheitis virus(AILTV) and avian pneumonia virus(APV). To evaluate the triplex PCR, 50 cotton swabs for throat and cloa-ca clinical samples were detected. The clinical results detected by the triplex PCR was accordant with the results detected by single PCR for the NDV, ChPV and AIV separately, there were one positive NDV sample, nine ChPV positive samples and two AIV positive samples, which contained two samples positive for ChPV and AIV, one sample positive for ChPV and NDV. 【Conclusion】The triplex PCR assay can specifically diagnose NDV, ChPV and AIV at the same time, and has great potential in identification of mixed infection cases.
Key words: Newcastle disease virus; chicken parvovirus; avian influenza virus; triplex PCR; specificity; sensibility
0 引言
【研究意义】禽流感(Avian influenza,AI)又称为欧洲鸡瘟,是由A型流感病毒(Avian influenza virus,AIV)引起的禽类传染病综合征,其病程初始表现为突然发病且无明显临床症状,病程稍长则表现出明显的神经、消化、呼吸和生殖等综合病征,伴随采食量减少、产蛋率下降,且易并发感染其他疾病,给养鸡产业带来巨大经济损失(甘孟侯,2002)。AIV基因组由8个独立节段构成的单股负链RNA组成,分别编码HA、NA、M、PB1、PB2、NP、PA和NS蛋白(吴青等,2017;郑丽荣等,2019)。新城疫(Newcastle disease,ND)俗称亚洲鸡瘟,是由新城疫病毒(Newcastle disease virus,NDV)引起的一种禽类急性烈性传染病,具有高度接触性和败血性等特征(李建伟和刘强,2013)。鸡群感染NDV常出现高热、黏膜出血、呼吸困难及下痢等症状,发病急,病情重,且引起较高的死亡率(丁壮等,2015)。NDV基因组由一条不分节段的单股负链RNA组成,其基因组编码NP、P、M、F、HN和L蛋白(苏文政,2011)。目前,ND和AI已被列入一类动物疫病(殷震和刘景华,1997;张毅等,2014;刘华雷和王志亮,2015)。鸡细小病毒(Chicken parvovirus,ChPV)是引起鸡肠道疾病的主要病原体之一,可导致鸡群出现急性或慢性肠道性疾病如矮小综合症和营养不良综合症,其临床表现为腹泻、精神沉郁、体温失调、生长迟缓和饲料消耗增加等(Guy,1998),在北美、波兰、巴西、匈牙利、克罗地亚和韩国等地均有报道,给当地的养鸡业造成重大损失(Biđin et al.,2011;Palade et al.,2011;Domanska-Blicharz et al.,2012;Koo et al.,2015;Nuñez et al.,2015)。ChPV属于细小病毒科细小病毒属,其基因组为单链线状DNA,大小约5.0 kb,基因组编码NS、NP和VP蛋白(Zsak et al.,2008,2015)。目前,因NDV、ChPV和AIV引起的疾病给我国养禽业带来极大经济损失,因此,亟待建立一种能同步检测NDV、ChPV和AIV的诊断方法,为临床病原监测及防控提供技术支持。【前人研究进展】在我国,已有学者将AIV、NDV、ChPV、禽肺炎病毒(Avian pneumovirus,APV)、鸡传染性支气管病毒(Infectious bronchitis virus,IBV)和禽呼肠孤病毒(Avian reovirus,ARV)间进行两两组合,建立了多种二重PCR检测方法。袁万哲等(2015)基于NDV的M基因和AIV的M1基因保守序列,成功建立了能同时检测NDV和AIV的二重RT-PCR检测方法;奉彬等(2016)将检测ChPV与ARV的特异性引物进行组合,经过优化反应条件后建立了同时检测ChPV和ARV的二重PCR检测方法;刘金玲等(2016)建立了针对NDV和IBV的二重RT-PCR检测方法,且证实该方法具有很好的特异性;谢志勤等(2016)建立的H9亚型AIV和APV二重RT-PCR检测方法具有特异、敏感及快速的特点,可用于同时检测H9亚型AIV和APV;何莹等(2017)建立的ChPV和AIV二重PCR检测方法具有特异性好及灵敏度高的特点,对ChPV和AIV的检测下限均为100 fg;王珂等(2017)针对NDV强、弱毒株建立的双重荧光定量RT-PCR可快速区分疫苗接种动物和野毒感染动物;张曼和韩飞(2018)基于NDV的F基因、安卡拉病毒(FAV-4)的hexon基因和AIV的M基因保守序列,建立了能同时检测NDV、FAV-4和AIV的三重RT-PCR。【本研究切入点】二重及二重以上的多重PCR主要用于鉴定某些病原微生物或同时检测多种病原体,在临床应用中具有高效性、系统性和经济简便性等特点,但目前未见针对NDV、ChPV和AIV三重PCR检测方法的建立。【拟解决的关键问题】参考NCBI中已公布NDV的F基因、ChPV的NS1基因和AIV的M基因保守片段,设计并合成能同时检测NDV、ChPV和AIV的特异性引物,建立同时检测3种病毒的三重PCR检测方法并验证其特异性、敏感性及实用性,为临床上快速诊断及有效防控NDV、ChPV和AIV的单一或混合感染提供技术支持。
1 材料与方法
1. 1 试验材料
AIV(H1N1、H3N2、H4N6、H6N6、H9N2和H11N9株)、ChPV、NDV(F48E9和LaSota株)、IBV(Mass 41株)、ARV(S1133株)、传染性喉气管炎病毒(Avian infectious laryngotracheitis virus,AILTV)北京(Beijing)株、APV(MN-10株)和禽大肠杆菌(Escherichia coli O2)均由广西兽医生物技术重点实验室保存提供。H16N3、H15N9、H14N5、H9N6、H7N2和H5N2亚型AIV灭活抗原由美国康涅狄格州大学禽病诊断研究室惠赠;H13N6、H12N5、H10N3、H8N4和H2N3亚型AIV由香港大学惠赠;马立克氏病活疫苗CVI988株(MDV CVI988)购自南京梅里亚动物保健品公司;EasyPure Viral DNA/RNA Kit购自北京全式金生物技术有限公司;AxyPrep DNA凝胶回收试剂盒购自康宁生命科学(吴江)有限公司;100 bp DNA Ladder(Dye Plus)Marker、Prime ScriptTM 1st Strand cDNA Synthesis Kit反转录试剂盒、pMD18-T载体、MiniBEST Bacteria Genomic DNA Extraction Kit和Premix TaqTM(Ex TaqTM Version 2.0 Plus Dye)購自宝生物工程(大连)有限公司。
1. 2 引物设计与合成
参考NCBI GenBank中已公布NDV的F基因(登录号DQ195265.1)、ChPV的NS1基因(登录号GU 214704.1)及AIV的M基因保守区(登录号DQ485211.1),运用Primer Premier 5.0、DNASTAR引物设计软件和BLAST在线工具对引物进行比对筛选,委托深圳华大基因科技有限公司合成针对NDV、ChPV和AIV三重PCR检测方法的特异性引物(表1)。
1. 3 病毒核酸提取
根据EasyPure Viral DNA/RNA说明分别从ChPV、AIV、MDV、AILTV、ARV、APV、NDV和IBV提取DNA/RNA,参照反转录试剂盒说明将AIV、NDV、ARV、IBV和APV的RNA反转录成cDNA;同时参照MiniBEST Bacteria Genomic DNA Extraction Kit说明提取E. coli的DNA,将上述抽提产物均置于-30 ℃冰箱保存备用。
1. 4 三重PCR反应条件优化
建立的三重PCR反应体系25.0 μL:NDV、ChPV和AIV的上、下游引物(10 pmol/μL)各1.0 μL,Premix TaqTM 12.5 μL,NDV、ChPV和AIV的DNA/cDNA模板各1.0 μL(混合模板3.0 μL),以无RNase水补足至25.0 μL。分别优化三重PCR的退火温度(50.0~64.0 ℃)和各引物浓度。三重PCR扩增程序:95.0 ℃预变性5 min;94.0 ℃ 1 min,退火温度退火1 min,72.0 ℃ 1 min,进行35个循环;72.0 ℃延伸10 min,12.0 ℃结束反应。取6.0~8.0 μL的PCR扩增产物进行1.2%琼脂糖凝胶电泳验证。
1. 5 三重PCR特异性试验
采用建立的三重PCR扩增预先提取的NDV、ChPV、AIV、IBV、MDV、ARV、APV、AILTV和E. coli核酸样品,检验其特异性。
1. 6 三重PCR敏感性试验
测定NDV、ChPV和AIV的原始核酸浓度,分别对3种原始核酸模板进行10倍梯度稀释,并设阴性对照(以无RNase水代替核酸模板)和空白对照(不加任何模板),评估三重PCR的敏感性。
1. 7 三重PCR重复性试验
以建立的三重PCR检测方法对NDV、ChPV和AIV的混合模板进行检测,重复5次,验证其可靠性。
1. 8 三重PCR临床样品检测
应用建立的三重PCR对来自广西不同规模化鸡场的50份喉头或泄殖腔棉拭子样品进行检测,再用常规PCR按上述三重PCR的最佳条件对这50份喉头或泄殖腔棉拭子样品进行检测,验证二者是否具有一致性。
1. 9 序列分析
对NDV、ChPV和AIV阳性PCR扩增产物进行胶回收及纯化后,分别与pMD18-T连接,转化E. coli DH5α感受态细胞,经菌落PCR和酶切鉴定呈阳性的3种克隆质粒送至英潍捷基(上海)贸易有限公司进行测序。最后采用ClustalX 1.81整理分析测序结果,并运用MEGA 7.02构建ChPV的系统发育进化树。
2 结果与分析
2. 1 三重PCR反应条件的优化
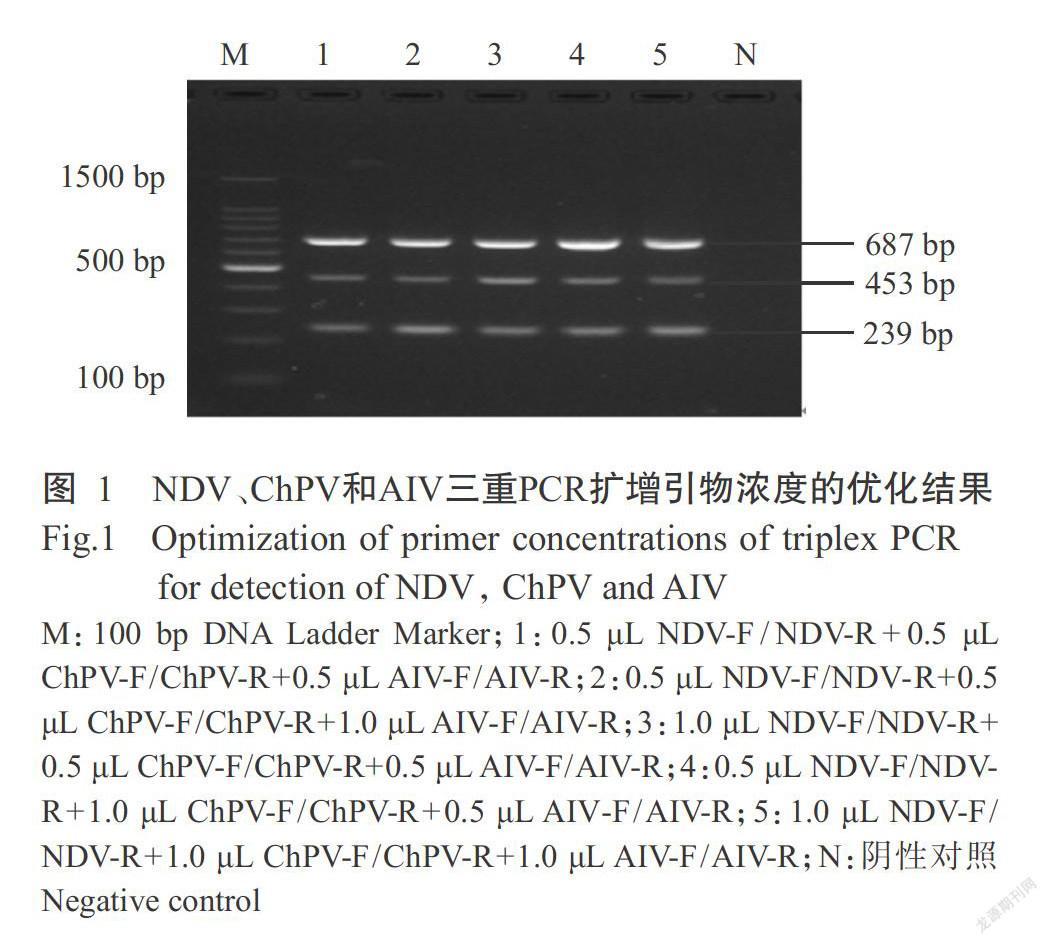
优化后的最佳三重PCR反应体系25.0 μL:ChPV和AIV的上、下游引物各0.5 μL,NDV的上、下游引物各1.0 μL(图1),NDV、ChPV和AIV的核酸模板各1.0 μL,Premix TaqTM 12.5 μL,无RNase水补足至25.0 μL。最佳扩增程序:95.0 ℃预变性5 min;94.0 ℃ 1 min,58.5 ℃ 1 min,72.0 ℃ 1 min,进行35个循环;72.0 ℃延伸10 min,12.0 ℃结束反应(图2)。
2. 2 三重PCR特异性试验结果
采用建立的三重PCR检测方法对ChPV、NDV和AIV的单一或混合模板进行检测,结果均成功扩增出NDV(453 bp)、ChPV(687 bp)和AIV(239 bp)的特异性条带(图3);而其他对照病原体均呈阴性,表明建立的三重PCR检测方法特异性良好。
2. 3 三重PCR敏感性试验结果
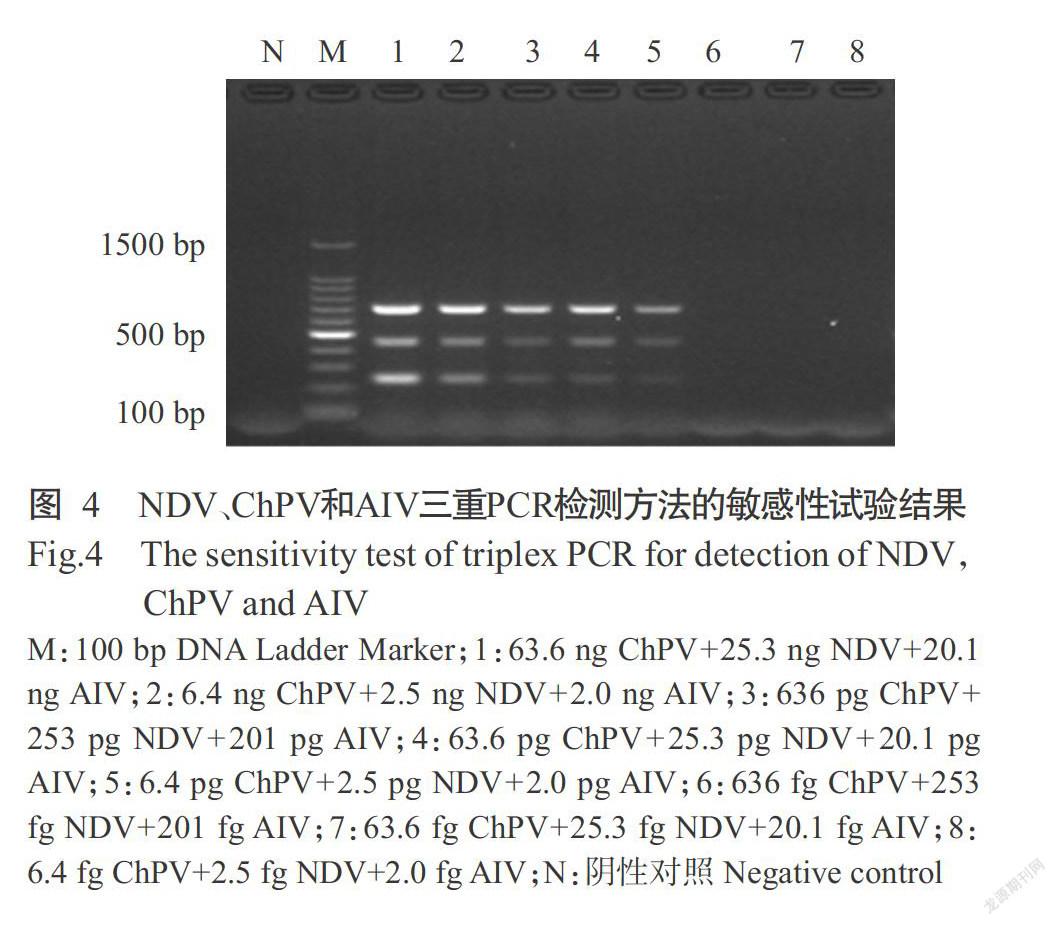
测得NDV原始核酸浓度为25.3 ng/μL,ChPV原始核酸浓度为63.6 ng/μL,AIV原始核酸浓度为20.1 ng/μL。三重PCR检测方法的最低检测下限分别为2.5 pg NDV、6.4 pg ChPV和2.0 pg AIV(图4),表明建立的三重PCR敏感性较高。
2. 4 三重PCR重复性试验结果
以建立的三重PCR检测方法对NDV、ChPV和AIV的混合模板进行检测,结果发现5次重复均能扩增出NDV(453 bp)、ChPV(687 bp)和AIV(239 bp)的特异性条带(图5),且条带均匀一致,表明建立的三重PCR重复性好。
2. 5 三重PCR的临床检测效果
应用建立的三重PCR检测方法对来自广西区内不同规模化鸡场的50份喉头或泄殖腔棉拭子样品进行检测,结果显示有1份NDV阳性、9份ChPV阳性和2份AIV阳性样品,其中包含2份ChPV和AIV均呈阳性的样品,1份ChPV和NDV均呈阳性的样品,与常规PCR的检测结果一致。图6为NDV、ChPV和AIV三重PCR检测方法对部分样品的临床检测结果。
2. 6 三重PCR扩增目的片段的测序结果
三重PCR扩增获得的目的片段经BLAST比对分析,发现测序获得的687 bp ChPV目的序列与Chic-ken parvovirus isolate ADL120686(登录号KJ486491)的同源性高达96%,453 bp NDV目的序列与Newcastle disease virus isolate HN1007(登录号KX761866.1)的同源性高达99%,239 bp AIV目的序列与Influenza A virus[A chicken/Guangxi/C227/2015(H9N2)](登录号KX130848.1)的同源性高达99%。将测序获得的一条ChPV核苷酸序列(687 bp)与GenBank中已发布不同国家的ChPV/TuPV全基因序列进行比对分析,并采用ClustalX 1.81和MEGA 7.02构建系统发生进化树,结果表明,17个ChPV/TuPV株分布在基于NS1基因系統发育进化树的不同基因亚型分支上,本研究测序获得的ChPV序列与来自韩国的Chicken parvovirus isolate ADL120686株处于同一进化分支(图7),亲缘关系最近。
3 讨论
随着我国家禽业的规模集约化发展,鸡群混合感染和二次感染现象日益增多。目前,ND和AI是影响家禽业持续健康发展的主要疾病,也是我国大型养鸡场常见多发的疾病,已引起人们的高度重视;ChPV是养禽业中一种新发现的传染病毒,在世界范围内广泛流行。鉴于NDV、ChPV和AIV对我国家禽业的危害,因此亟待建立一种特异、敏感的快速鉴别诊断方法,以便于采取有效而全面的防控措施,降低禽类传染性疾病的发生,进而提高我国的养禽业水平。当前,传统的病毒鉴定方法有病毒分离、琼脂扩散试验和ELISA等,但这些方法存在耗时长及灵敏度低等弊端。相比之下,PCR具有操作时间短、特异性高和灵敏度高等优点(肖跃强等,2018)。在临床样品中常出现多种病原体混合感染的病例,通过常规PCR难以实现快速检测和鉴别诊断。为此,本研究针对AIV、NDV和ChPV 3种病毒建立三重PCR检测方法,旨在实现快速鉴别诊断。与常规的PCR检测方法相比,多重PCR使用多对不同引物同时扩增多种不同的核酸模板,有效弥补了常规PCR的不足,同时节省人力物力,提高检测效率,且极大缩短检测时间。但在同一多重PCR反应体系中,不同引物间、不同模板间及引物与模板间均可能产生竞争性抑制反应,从而影响扩增效率。因此,需在双重或多重PCR的建立过程中尽量对各类条件进行优化,以避免因引物与模板间的非特异性结合而产生非特性扩增。此外,每个引物的退火温度应尽可能一致,以确保扩增产物量的相对平衡(Xie et al.,2014;刘婷婷等,2015)。
本研究通过设计合成NDV、ChPV和AIV的特异性引物,成功扩增出NDV(453 bp)、ChPV(687 bp)和AIV(239 bp)的特异性目的片段,表明每对引物都具有很强的扩增效率和特异性。建立的三重PCR检测方法可同时检测样品中的NDV、ChPV和AIV核酸,对掌握鸡群感染NDV、ChPV和AIV后的排毒状况十分重要,也有利于临床上NDV、ChPV和AIV的流行病学調查。在检验三重PCR的敏感性时,将三重PCR与常规PCR的最低检测下限进行对比,发现前者与后者相比相应降低1×102~1×103个数量级,但仍然高度敏感(NDV、ChPV、AIV核酸的最低检测下限分别为2.5、6.4和2.0 pg),能满足临床上的动物疫病检测要求。应用建立的三重PCR检测方法对临床样品进行检测,并与常规PCR进行比较,结果发现三重PCR检测方法的检测结果与常规PCR检测结果一致,有1份NDV阳性、9份ChPV阳性和2份AIV阳性样品,其中包含2份ChPV和AIV均呈阳性的样品,1份ChPV和NDV均呈阳性的样品,表明建立的三重PCR检测方法在混合感染病例鉴别诊断方面具有广阔的应用前景,同时说明广西鸡群已存在NDV、ChPV与AIV混合感染的现象,各养鸡场应给予重视并加强防控。
4 结论
建立的三重PCR检测方法能同时对NDV、ChPV和AIV 3种病原进行特异性诊断,在混合感染病例鉴别诊断方面具有广阔的应用前景。
参考文献:
丁壮,尹仁福,薛聪,王建忠,钱晶. 2015. 新城疫流行病学新特点及鹅新城疫防控策略[J]. 中国兽医学报,35(1):159-168. [Ding Z,Yin R F,Xue C,Wang J Z,Qian J. 2015. New features of newcastle disease and control stra-tegies for newcastle disease on goose[J]. Chinese Journal of Veterinary Science,35(1):159-168.]
奉彬,谢芝勋,邓显文,张艳芳,黄娇玲,王盛,范晴,谢志勤,黄莉,谢丽基,曾婷婷,罗思思,刘加波. 2016. 鸡细小病毒与禽呼肠病毒二重PCR检测方法的建立[J]. 动物医学进展,37(11):14-18. [Feng B,Xie Z X,Deng X W,Zhang Y F,Huang J L,Wang S,Fan Q,Xie Z Q,Huang L,Xie L J,Zeng T T,Luo S S,Liu J B. 2016. Development of a duplex PCR assay for detection of chicken parvovirus and avian reovirus[J]. Progress in Veterinary Me-dicine,37(11):14-18.]
甘孟侯. 2002. 禽流感[M]. 第2版. 北京:中国农业出版社:1-14. [Gan M H. 2002. Avian influenza[M]. The 2nd Edition. Beijing:China Agricultural Press:1-14.]
何莹,谢芝勋,罗思思,李孟,谢丽基,邓显文,谢志勤,奉彬,黄娇玲,张艳芳. 2017. 禽流感病毒与鸡细小病毒二重PCR检测方法的建立[J]. 中国畜牧兽医,44(7):2126-2131. [He Y,Xie Z X,Luo S S,Li M,Xie L J,Deng X W,Xie Z Q,Feng B,Huang J L,Zhang Y F. 2017. Development of a duplex PCR assay for detection of avian influenza virus and chicken parvovirus[J]. China Animal Husbandry & Veterinary Medicine,44(7):2126-2131.]
李建伟,刘强. 2013. 蛋鸡新城疫流行现状及其防治[J]. 家禽科学,(9):34-36. [Li J W,Liu Q. 2013. Epidemiological status of newcastle disease in broilers and strategies for prevention[J]. Poultry Science,(9):34-36.]
刘华雷,王志亮. 2015. 新城疫的流行历史与现状[J]. 中国动物检疫,32(6):1-4. [Liu H L,Wang Z L. 2015. The history and current status of newcastle disease[J]. China Animal Health Inspection,32(6):1-4.]
刘金玲,李晓静,李红杰,王晓雪,高冬生,李永涛,常洪涛,赵军,王川庆. 2016. 检测鸡新城疫病毒和鸡传染性支气管炎病毒双重RT-PCR的建立与初步应用[J]. 中国兽医学报,36(10):1701-1705. [Liu J L,Li X J,Li H J,Wang X X,Gao D S,Li Y T,Chang H T,Zhao J,Wang C Q. 2016. Establishment and application of duplex RT-PCR for detecting newcastle disease virus and infectious bronchitis virus[J]. Chinese Journal of Veterinary Science,36(10):1701-1705.]
刘婷婷,谢芝勋,宋德贵,罗思思,谢丽基,李孟,谢志勤,邓显文. 2015. H3N2亚型禽流感病毒三重RT-PCR检测方法的建立[J]. 动物医学进展,36(2):7-11. [Liu T T,Xie Z X,Song D G,Luo S S,Xie L J,Li M,Xie Z Q,Deng X W. 2015. Simultaneous detection of H3N2 subtypes and M gene of avian influenza virus by triplex PCR[J]. Pro-gress in Veterinary Medicine,36(2):7-11.]
蘇文政. 2011. 新城疫病毒分离鉴定与遗传进化分析[D]. 泰安:山东农业大学. [Su W Z. 2011. Isolation and identification of NDV and genetic evolution analysis of DNV F gene[D]. Tai’an:Shandong Agricultural University.]
王珂,袁乾亮,尹仁福,薛聪,钱晶,穆昱,张平仄,杨明曦,张晟,韩丽,丁壮. 2017. 强、弱毒力新城疫病毒双重荧光定量RT-PCR检测方法的建立[J]. 中国兽医学报,37(1):1-6. [Wang K,Yuan Q L,Yin R F,Xue C,Qian J,Mu Y,Zhang P Z,Yang M X,Zhang S,Han L,Ding Z. 2017. Establishment of a duplex fluorescence quantitative RT-PCR detection system to distinguish NDV velogenic from lentogenic strains[J]. Chinese Journal of Veterinary Science,37(1):1-6.]
吴青,李银,李祥瑞,赵冬敏,刘青涛,刘宇卓,韩凯凯,黄欣梅. 2017. 江苏H9N2亚型禽流感病毒HA和NA的遗传进化分析[J]. 江西农业学报,29(7):104-109. [Wu Q,Li Y,Li X R,Zhao D M,Liu Q T,Liu Y Z,Han K K,Huang X M. 2017. Genetic evolution analysis of H9N2-subtype avian influenza viruses HA and NA in Jiangsu Province[J]. Acta Agriculturae Jiangxi,29(7):104-109.]
肖跃强,于雪,刘吉山,杨慧,苗立中,徐晴晴,何诚,沈志强. 2018.Ⅰ亚群禽腺病毒通用PCR检测方法的建立及应用[J]. 中国预防兽医学报,40(3):206-210. [Xiao Y Q,Yu X,Liu J S,Yang H,Miao L Z,Xu Q Q,He C,Shen Z Q. 2018. Establishment and application of an universal PCR method for detecting subgroupⅠ fowl adenovirus[J]. Chinese Journal of Preventive Veterinary Medicine,40(3):206-210.]
谢志勤,谢芝勋,范晴,邓显文,谢丽基,罗思思,黄莉,黄娇玲,张艳芳,王盛,张民秀,奉彬,刘加波,庞耀珊. 2016. H9亚型禽流感病毒和禽肺病毒二重RT-PCR检测方法的建立[J]. 动物医学进展,37(12):7-12. [Xie Z Q,Xie Z X,Fan Q,Deng X W,Xie L J,Luo S S,Huang L,Huang J L,Zhang Y F,Wang S,Zhang M X,Feng B,Liu J B,Pang Y S. 2016. Development of a duplex RT-PCR for detecting avian influenza H9 subtype and avian pneumo-virus[J]. Progress in Veterinary Medicine,37(12):7-12.]
殷震,刘景华. 1997. 动物病毒学[M]. 第2版. 北京:科学出版社:37-38. [Yin Z,Liu J H. 1997. Animal virology[M]. The 2nd Edition. Beijing:Science Press:37-38.]
袁万哲,邹云婧,孙继国,陈立功,刘静,王庚南,刘聚祥. 2015. 禽流感病毒与新城疫病毒二重RT-PCR检测方法的建立[J]. 河北农业大学学报,38(6):88-91. [Yuan W Z,Zhou Y J,Sun J G,Chen L G,Liu J,Wang G N,Liu J X. 2015. Development of a duplex RT-PCR assay for detection of avian influenza virus and newcastle disease virus[J]. Journal of Agricultural University of Hebei,38(6):88-91.]
张曼,韩飞. 2018. AIV、NDV和安卡拉病毒多重PCR检测方法的建立及应用[J]. 西北农林科技大学学报(自然科学版),46(2):1-6. [Zhang M,Han F. 2018. Establishment and application of multiple PCR assay for detecting avian influenza virus,newcastle disease virus and angara disease virus[J]. Journal of Northwest A & F University(Natural Science Edition),46(2):1-6.]
张毅,王幼明,王芳,王静静,毕玉海,尹燕博,丁家波. 2014. 我国禽流感研究进展及成就[J]. 微生物学通报,41(3):497-503. [Zhang Y,Wang Y M,Wang F,Wang J J,Bi Y H,Yin Y B,Ding J B. 2014. Progress and achievements in the research on avian influenza in China[J]. Microbio-logy China,41(3):497-503.]
郑丽荣,苏海龙,张英,石火英. 2019. 禽流感病毒抗原变异的研究进展[J]. 中国家禽,41(7):47-50. [Zheng L R,Su H L,Zhang Y,Shi H Y. 2019. Research progress on antigenic variation of avian influenza virus[J]. China Poultry,41(7):47-50.]
Biđin M,Lojkic I,Biđin Z,Tišljar M,Majnarić D. 2011. Identification and phylogenetic diversity of parvovirus circulating in commercial chicken and turkey flocks in Croatia[J]. Avian Disease,55(4):693-696.
Domanska-Blicharz K,Jacukowicz A,Lisowska A,Minta Z. 2012. Genetic characterization of parvoviruses circulating in turkey and chicken flocks in Poland[J]. Archives of Virology,157(12):2425-2430.
Guy J S. 1998. Virus infections of the gastrointestinal tract of poultry[J]. Poultry Science,77(8):1166-1175.
Koo B S,Lee H R,Jeon E O,Han M S,Min K C,Lee S B,Bae Y J,Cho S H,Mo J S,Kwon H M,Sung H W,Kim J N,Mo I P. 2015. Genetic characterization of three novel chicken parvovirus strains based on analysis of their co-ding sequences[J]. Avian Pathology,44(1):28-34.
Nuñez L F,Santander Parra S H,Mettifogo E,Astolfi Ferreira C S,Piantino Ferreira A J. 2015. Isolation and molecular characterization of chicken parvovirus from Brazilian flocks with enteric disorders[J]. British Poultry Science,56(1):39-47.
Palade E A,Kisary J,Benyeda Z,Mandoki M,Balka G,Jakab C,Vegh B,Demeter Z,Rusvai M. 2011. Naturally occurring parvoviral infection in hungarian broiler flocks[J]. Avian Pathology,40(2):191-197.
Xie Z X,Luo S S,Xie L J,Liu J B,Pang Y S,Deng X W,Xie Z Q,Fan Q,Khan I M. 2014. Simultaneous typing of nine avian respiratory pathogens using a novel GeXP analyzer-based multiplex PCR assay[J]. Journal of Virological Methods,207:188-195.
Zsak L,Cha R M,Li F,Day J M. 2015. Host specificity and phylogenetic relationships of chicken and turkey parvoviruses[J]. Avian Diseases,59(1):157-161.
Zsak L,Strother K O,Kisary J. 2008. Partial genome sequence analysis of parvoviruses associated with enteric disease in poultry[J]. Avian Pathology,37(4):435-441.
(責任编辑 兰宗宝)

