棕榈蓟马消化道组织学与形态学研究
穆野 陈粉粉 魏辉 郑雪 陈勇 张洁
摘要:【目的】棕榈蓟马Thrips palmi Karny不仅可以直接取食为害作物,而且能够传播正番茄斑萎病毒属Orthotospovirus病毒病害,给我国蔬菜、花卉等经济作物造成了严重危害。本研究探讨了棕榈蓟马成虫消化道的组织学和形态学结构,旨在为今后研究正番茄斑萎病毒属病毒在棕榈蓟马体内的侵染路径提供依据。【方法】利用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察棕榈蓟马消化道整体形态结构,利用透射电子显微镜(transmission electron microscope,TEM)观察棕榈蓟马消化道超微结构。【结果】棕榈蓟马消化道由前肠、中肠、后肠和马氏管组成。前肠包括咽、食道、嗦囊和贲门。中肠分为前中肠、中中肠和后中肠3个部分;中肠没有围食膜,前中肠微绒毛表面有微绒毛膜,后中肠肠壁根据细胞形态分为褶皱端和扁平端,微绒毛没有微绒毛膜。后肠由回肠和直肠组成;回肠的肠壁肌肉发达,肠腔周围有一层角质层;直肠内部有大量微生物。马氏管有4根,着生在中肠与后肠的分界线处;马氏管处微绒毛密集但形状不规则,管壁细胞内有大量囊泡。【结论】本研究描述了棕榈蓟马消化道的形态与组成,分析了不同部位的功能,为研究病原物在蓟马体内的侵染路径奠定基础。
关键词:缨翅目;蓟马科;棕榈蓟马;消化道;形态学
中图分类号:S435 文献标志码:A 文章编号:1008-0384(2019)11-1309-06
0 引言
【研究意义】棕榈蓟马Thrips palmi Karny又名节瓜蓟马,属于缨翅目Thysanoptera,蓟马科Thripidae,蓟马属Thrips,分布于美国(夏威夷)、日本、印度、新加坡和中国(华南地区)等国家。主要危害茄科、葫芦科、豆科、十字花科作物,同时也是正番茄斑萎病毒属Orthotospovirus部分病毒的传播媒介[1-3]。正番茄斑萎病毒属病毒随着食物被动进入介体蓟马消化道,在消化道内建立侵染点并增殖,最终突破消化道和唾液腺屏障,病毒粒子随着唾液注入并侵染健康植株,影响植株生长、发育[4]。因此,了解消化道的组成和结构对进一步研究病毒在棕榈蓟马体内的侵染路径尤为重要。【前人研究进展】早期的缨翅目昆虫解剖学研究从形态学角度描述了缨翅目昆虫消化道、唾液腺、生殖系统等组织器官,明确不同种类蓟马的消化道形态结构存在差异[5]。此外,Ullman等利用透射电镜观察西花蓟马Frankliniella occidentalis唾液腺、前肠、中肠、后肠以及生殖系统的超薄切片,明确消化道的组织和形态结构,并探讨了蓟马消化道形态与病毒传播的关系,认为消化道形态可能决定蓟马病毒传播能力[6]。棕榈蓟马能传播番茄斑萎病毒(Tomato spotted wiltvirus,TSWV)、甜瓜黄斑病毒(Melon yellow spot virus,MYSV)、花生芽枯病毒等病毒(Peanut bud necrosisvirus,PBNV,)。若虫取食带毒植株5min即可携带花生芽枯病毒,带毒成虫有效传播病毒需要取食健康植株1h[7-10]。【本研究切入点】棕榈蓟马传播病毒的种类多,对番茄斑萎病毒、花生芽枯病毒的传播效率较高,但尚不清楚病原物在其体内的传播路径。对棕榈蓟马消化道的研究有助于更深入了解病原物的发生、复制和侵染。【拟解决的关键问题】本研究利用激光共聚焦显微镜和透射电镜在形态学和组织学上对棕榈蓟马消化道的各个部位进行研究和描述,为进一步明确病原物在消化道内的侵染路径提供依据。
1 材料与方法
1.1 供试昆虫
棕榈蓟马于2018年4月采自云南昆明晋宁区柳坝村蔬菜大棚,鉴定后用四季豆与黄瓜饲养在人工气候箱中。饲养条件为温度27±1℃,相对湿度70%±5%,光照周期L:D=14:10。
1.2 消化道解剖
挑取棕榈蓟马成虫置于4℃冰箱内5~10min,待其无活力取出放置在滴有PBS溶液(0.1mol·L-1,pH 7.2)的载玻片上,在体视显微镜(SZ660,重庆奥特)下用镊子摘除棕榈蓟马腹部最后一节,再用镊子夹住腹部,用另外一把镊子夹住头部,将消化道从虫体中缓慢拉出,摘除多余组织。
1.3 免疫荧光样品制备
免疫荧光技术是将已知的抗原或抗体标记上荧光,再用这种荧光抗体作为探针检查细胞或组织内的相应抗原。因此,可利用该技术观察棕榈蓟马消化道组织的形态结构。将解剖出的成虫消化道迅速转移到4%多聚甲醛(Sigma)溶液中固定2h,PBS漂洗3次后将消化道转移到2% Triton X-100(Sigma)溶液中渗透0.5h,PBS漂洗3次后将消化道转移到含有0.5%免疫荧光染料Alexa FluorTM633 Phalloidin(Thermo Fisher)和3%牛血清的PBS溶液中370C孵育2h。孵育后的消化道用PBS溶液漂洗3次,将漂洗过的消化道转移到滴有甘油的载玻片上并封片,置于Leica SP8激光共聚焦显微镜(德国Leica)下观察。
1.4 常规TEM样品制备
将解剖出的成虫消化道不同组织(前肠、中肠、后肠和马氏管)分别放入2.5%戊二醛(E-MERCK)中室温固定2h或4℃过夜,然后用PBS溶液漂洗3次,每次15min;再转入1%的饿酸(SPI-CHEM)溶液中固定1-2h,PBS溶液漂洗3次,每次15min;依次用50%、70%、80%、90%、95%的乙醇脱水,每次15min,最后100%乙醇和100%丙酮各脱水20min;用spurr包埋剂(SPI-CHEM)与丙酮1:1、1:3分別渗透样品1h和3h,再用100% spurr包埋剂渗透12h:在BJ0010聚合器(北京中兴百瑞)中70℃下聚合24h;聚合后的样品用ULTRACUT E超薄切片机(美国AO)切片;用醋酸双氧铀(SPI~CHEM)溶液染色15min,柠檬酸铅染色5min,双蒸水漂洗3次,晾干后在FEI TECNAI G2透射电子显微镜(美国FEI)下观察。
2 结果与分析
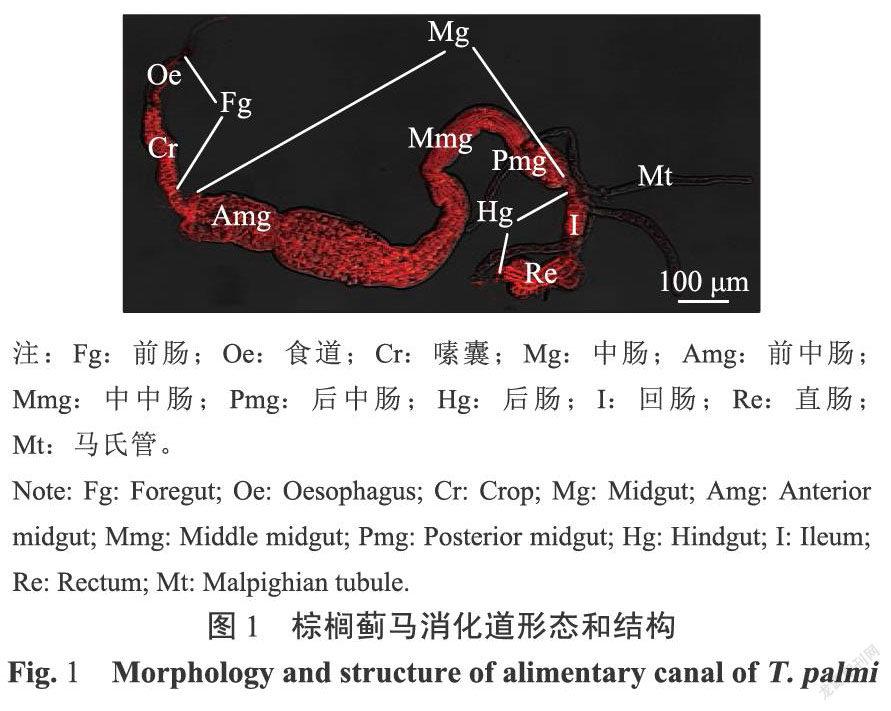
棕榈蓟马消化道始于咽部,结束于肛门,纵贯于血腔之中。根据功能不同分为前肠、中肠、后肠和马氏管(图1)。
2.1 前肠(Foregut)
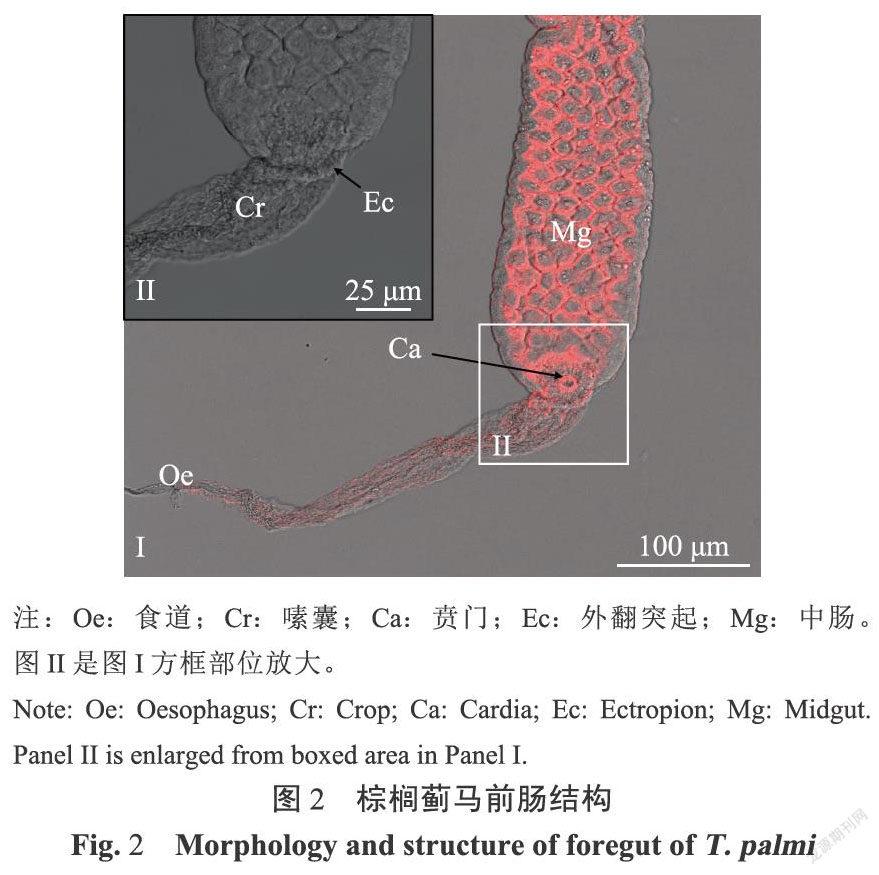
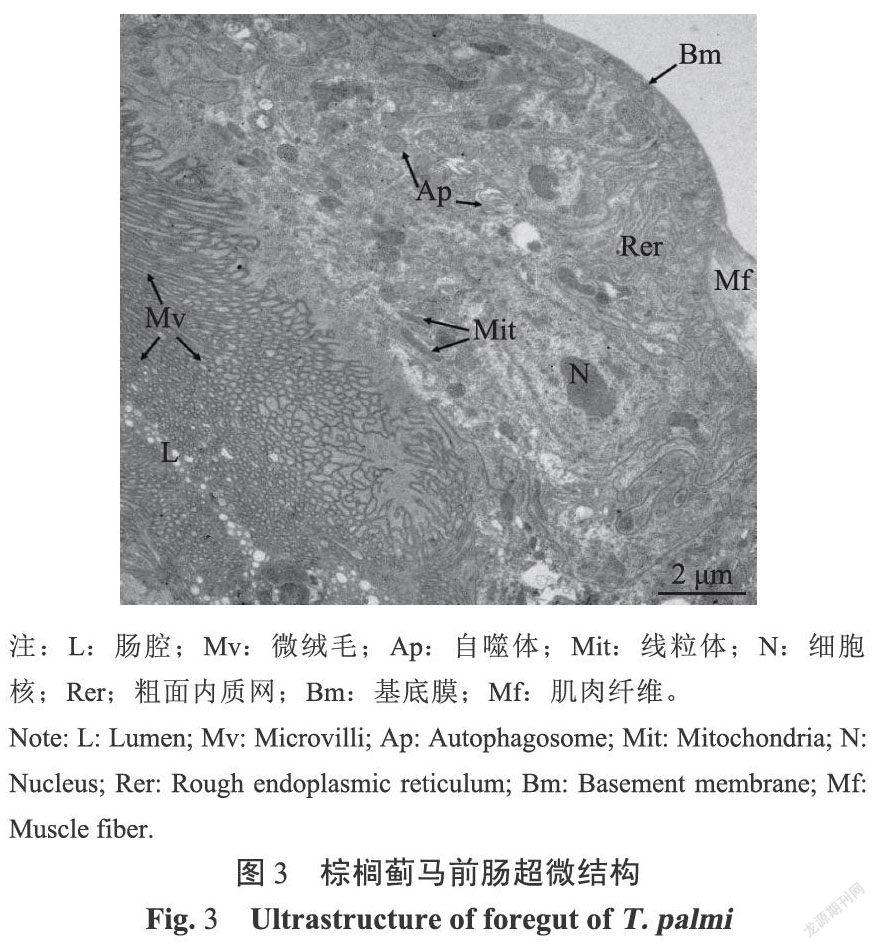
前肠位于消化道前端,长约300~350μm,直径约15~25μm,由咽、食道、嗦囊和贲门组成。食道较短、细,为膜质管状结构,肠腔由窄逐渐变宽,直到与嗦囊连接。嗦囊细胞和肠腔变大,肌肉组织丰富、膨大(图1)。嗦囊在与中肠连接处表皮凹陷,形成控制食物进出的圆环状贲门(图2)。通过透射电镜观察,发现前肠微绒毛多且密集,肠腔被微绒毛挤压呈缝隙状,线粒体分布在微绒毛附近,内质网靠近肠壁细胞的基膜(图3)。
2.2 中肠(Midgut)
中肠为棕榈蓟马消化道中最长的组织结构,长约900~1000μm,直径约40~120μm,是消化食物和吸收营养的主要场所,可分为前中肠,中中肠和后中肠,以中肠在腹内的弯曲为分界线,前中肠最粗,直径约90~120μm,其余粗细相似,直径约70~80μm(图1)。前中肠肠壁由内向外分别为肠壁细胞、基膜、肌肉纤维,肠腔周围着生形状规则、细长且密集的微绒毛,微绒毛外包裹微绒毛膜(图4)。在微绒毛附近聚集大量的线粒体,形状为圆形或不规则的条形。细胞核形状不规则,在其周围分布大量粗面内质网(图4)。
后中肠与中中肠相似,直径较前中肠小,约40~55μm,在末端内敛,与后肠连接(图1)。肠腔周围有微绒毛,无微绒毛膜,肠壁细胞在靠近微绒毛附近密集分布有线粒体。与前中肠不同的是肠壁褶皱状,肌肉镶嵌在褶皱中(图5)。
2.3 后肠(Hindgut)
后肠粗细居于前肠和中肠之间,长约300~400μm,直径约30~40μm,分为回肠和直肠,直肠连接肛门(图1)。回肠的形状为规则的管状,肠壁薄,只有一层扁平的肠壁细胞和一层肌肉纤维,内壁有一层致密的角质层,无微绒毛,角质层与细胞质膜之间有空隙,细胞内线粒体较少且分布无规则,肌肉发达,肌肉细胞与肠壁细胞厚度相似(图6)。直肠较回肠膨大,肠壁薄,细胞形态扁平,细胞核大,有类似微绒毛的长条突起,无角质层,肠腔内有大量微生物(图7)。
2.4 马氏管(Malpighian tubules)
马氏管着生于中肠与后肠的连接处,长约400-600μm,直径约10~15μm,共有4条,游离于血淋巴中,无分节或分支(图1)。管壁由单层的中空细胞构成,管腔周围有密集分布的特化的微绒毛,胞内细胞核和核仁都很大,紧挨微绒毛,线粒体大量分布于管壁细胞,中间有很多大小不一的囊泡,最外层为基膜,基膜上无肌肉纤维(图8)。
3 讨论与结论
昆虫消化道结构形态由自身的食性和发育阶段决定。不同种类的蓟马消化道在各组织的长度、宽度和形状上存在差异[5]。蓟马类昆虫以锉吸式口器吸食植物汁液,病毒首先随植物汁液进入消化道内,随后在消化道内建立侵染点并增殖,最后突破消化道和唾液腺屏障随着唾液注人并侵染健康植株[4]。本研究结果表明,棕榈蓟马消化道结构相对简单且与已报道的其他缨翅目昆虫消化道结构大体相同,主要分为前肠、中肠、后肠和马氏管,但与已报道的西花蓟马在前肠形态和中肠超微结构上有差别。棕榈蓟马前肠的食道仅起到运输食物的作用,不能进行消化和吸收,嗦囊位于前肠食道后明显变粗的部分,与食道的区别为细胞变大,肠道直径变大,尚不明确是否具有分泌消化液、初步消化食物和吸收营养物质的功能[11]。在前肠和中肠的表皮连接处有一圈突起结构,在肠腔连接处,有一环形肌肉群为贲门,在中肠蠕动时,该结构周围肌肉紧张,会使其关闭,防止食物倒流[12]。Ulhnan等用扫描电镜观察了西花蓟马的前肠以及周围管状结构,在对西花蓟马前肠与中肠连接处的描述中,没有观察到前肠的外翻突起,仅在贲门处有一圈向肠腔内凹陷的瓣膜,且研究中没有提到类似嗦囊的结构[6]。
中肠是昆虫消化食物和吸收营养的主要器官。本研究表明,棕榈蓟马的中肠在腹部形成两个弯曲,以增加中肠与血淋巴的营养交换面积,使营养物质交换更充分。前中肠、中中肠与后中肠的细胞形态不同,前中肠是消化道最粗的部分,细胞大,向肠腔凸起,微绒毛密集有微绒毛膜包裹,是营养吸收的主要器官。后中肠根据细胞形态可分为扁平端和褶皱端,扁平端微绒毛稀疏,肌肉处于放松状态,褶皱端紧张时微绒毛密集。在后中肠处微绒毛未发现微绒毛膜。据此推测褶皱端细胞在肌肉放松时,细胞形态与扁平端相似,在后中肠细胞中没发现Ullman等发现的同心圆环[6]。棕榈蓟马中肠肌肉比较发达,又可分为环肌和纵肌,它们垂直交叉分布,在肠道蠕动时,原本平铺在基底膜上的肌肉会横向或者纵向收缩,与其连接的细胞形态和肠道形态也会随之改变。此外,棕榈蓟马中肠无围食膜,围食膜比较发达的昆虫的食物里微生物含量比较高,因为植物汁液中微生物较少,棕榈蓟马只进化出了一层微绒毛膜[13-14]。
大部分昆虫的回肠都是由一层角质层和不发达的肠壁细胞构成,本研究表明,棕榈蓟马回肠肌肉十分发达,几乎与肠壁细胞厚度相同[15]。此外,棕榈蓟马直肠内部还有大量的微生物,这与Ullman等在西花蓟马后肠中观察到的结果一致,在电镜下的微生物形态观察也类似[6]。
不同昆虫的马氏管形态、数量都有不同,4根马氏管是缨翅目昆虫共有的特征。本研究表明,棕榈蓟马的马氏管一端与中后肠连接处链接,一端游离在血腔中。马氏管由中空的管壁细胞构成,管壁细胞内有大量的液泡,胞内的液泡被认为是由内质网或高尔基体包裹的排泄产物[16]。
综上所述,本研究利用激光共聚焦显微镜和透射电鏡解剖观察了棕榈蓟马的消化道,初步明确了棕榈蓟马消化道的构成和功能,为研究病原物在棕榈蓟马体内侵染路径提供基础依据,也可以为不同种蓟马之间传毒差异比较研究提供理论支持。
参考文献:
[1]孙士卿,邓裕亮,李惠,等.棕榈蓟马研究综述[J].安徽农业科学,2010,38(23)12538-12541,12587.
[2]张维球,韩诗畴,符立乾.棕榈蓟马生物学特性初步观察[J].昆虫知识,1985,22(3):110-111.
[3]侯海霞,刘永杰,于毅,等.棕榈蓟马传播番茄斑萎病毒属病毒研究进展[J].山东农业科学,2016,48(2):157-160.
[4]WHITFIELD A E,ULLMAN D E,GERMAN T L.Tospovirus-ThripsInteractions[J].Annual Review of Phytopathology,2005,43(1):459-489.
[5]SHARGA U S.On the internal anatomy of some thysanoptera[J].Transactions of the Royal Entomological Society of London,2009,81(2):185-204.
[6]ULLMAN D E,WESTCOT D M,HUNTER W B,et al.Internalanatomy and morphology of Frankliniella occidentalis(Pergande)(Thysanoptera:Thripidae)with special reference to interactionsbetween thrips and Tomato spotted wilt virus[J].InternationalJournal of Insect Morphology and Embryologl,1989,18(5):289-310.
[7]YEH S D,LIN Y C,CHENG Y H,et al.Identification of TomatoSpotted Wilt-like Virus on Watermelon in Taiwan[J].Plant Disease,1992,76(8):835-840.
[8]CHAO C H,CHEN T C,KANG Y C,et al.Characterization of Melonyellow spot virus infecting cucumber(Cucumis sativus L.)inTaiwan[J].Plant Pathology Bulletin,2010,19(1):41-52.
[9]PALMER J M,DVR R,WIGHTMAN J A,et al.New information onthe thrips vectors of tomato spotted wilt virus in groundnut crops inIndia[J].International Arachis Newsletter,1990(7):24-25.
[10]LAKSHMI K V,WIGHTMAN J A,REDDY D V R,et al.Transmission of Peanut Bud Necrosis Virus by Thrips palmi inIndia[M].Bruce L P.Thrips Biology and Management.US:SpringerPress,1995:179-184.
[11]许再福.普通昆虫学[M].北京:科学出版社,2009:93-94.
[12]孙少轩.斑蜡蝉Lycorma delicatula White消化系统的组织学与组织化学研究[J].昆虫学报,1964,13(2):177-192.
[13]相静波,刘惠霞,吴文君.昆虫围食膜的研究进展[J].应用昆虫学报,2004(2):116-122.
[14]SILVA C P,SILVA J R,VASCONCELOS F F,et al.Occurrence ofmidgut perimicrovillar membranes in paraneopteran insect orders withcomments on their function and evolutionary significance[J].Arthropod Structure & Development,2004,33(2):139-148.
[15]CHAPMAN R F.The insects:structure and function[M].New York:Academic Press,1998:788.
[16]DALLAI R,BENE G D,MARCHINI D.The ultrastructure ofMalpighian tubules and hindgut of Frankliniella occidentalis(Pergande)(Thysanoptera:Thripidae)[J].International Journal ofInsect Morphology and Embryologl,1991,20(4-5):223-233.
(责任编辑:林海清)
收稿日期:2019-10-08初稿;2019-11-12修改稿
作者简介:穆野(1994-),男,硕士研究生,主要从事植物保护研究(E-mail:929249361@qq.com)
通信作者:陈勇(1983-),男,副研究员,主要从事植物病毒与介体昆虫互作研究(E-mail:cheny0903@163.com);张洁(1983-),男,研究员,主要从事植物保护研究(E-mail:zhengjun2314@126.com)
基金项目:国家自然科学基金项目(31871936,31560499);云南省應用基础研究计划面上项目(2016FB063);云南省应用基础研究计划重点项目(2018FA020);云南省中青年学术技术带头人后备人才项目(2015HB081);福建省科技重大专项(2017NZ0003-1-4);福建省科技计划公益类专项(201781025-9);福建省农业科学院科技项目(STIT2017-3-2、AGY2018-5、YC2016-5)

