京海黄鸡白介素8基因5
王晓慧 于海亮 邹文斌 糜长浩 戴国俊 张涛 张跟喜 谢恺舟 王金玉 施会强

摘要:【目的】研究白介素8(1L-8)基因5'调控区单核苷酸突变对鸡柔嫩艾美耳球虫(E.tenella)抗性指标的影响。【方法】本试验利用DNA直接测序技术,检测京海黄鸡IL-8基因5'调控区单核苷酸多态性(SNPs),并对5'调控区的SNPs突变前后的转录因子进行预测,然后分析SNPs与柔嫩艾美耳球虫抗性指标的关联性。【结果】测序结果表明:IL-8基因5'调控区共检测到3个突变位点(T-550C、G-398T和T-360C),均形成了3种基因型,杂合度在0.4360.471,PIC值在0.250.50,均属于中度多态,且3个突变位点均处于哈代一温伯格平衡状态。生物信息学分析表明:3个突变位点均改变了其原有的转录因子结合位点。关联分析显示:T-550C突变位点的TC型个体的IL-8表达量与TT型差异显著,TC型GSH-PX、CAT、IL-2、IL-6、IFN-γ指标均高于其他2种基因型,但差异不显著。G-398T突变位点的TT型个体SOD活性和GT型个体CAT活性均显著高于GG型;TT型个体NO含量与GG型差异极显著,与GT型差异显著;TT型IL-2表达量显著高于GT型。T-360C突变位点的TT型和TC型个体SOD活性与CC型差异极显著或差异显著;TT型和TC型个体的NO含量均显著高于CC型;TT型个体的IL-2、IL-8表达量均显著高于CC型。【结论】G-398T和T-360C突变位点的 TT型个体球虫抗性优于其他基因型个体,T-550C突变位点的杂合型个体球虫抗性优于纯合型个体,表明IL-8基因5'调控区的突变对球虫抗性指标有显著的调控作用,可作为球虫病抗性鸡新品种或新品系的育种参考依据。
关键词:京海黄鸡;柔嫩艾美耳球虫;白介素8基因;5'调控区SNPs;抗性指标
中图分类号:S831.2 文献标志码:A 文章编号:1008-0384(2019)11-1262-08
0 引言
【研究意义】球虫病是由原生动物寄生虫引起的一种重要的肠道疾病,可导致家畜体重下降、营养不良、失血、脱水和对其他疾病因子的易感性增加,降低动物生产性能,给养殖业带来巨大的经济损失[1-2]。鸡对艾美耳球虫属易感,寄生于盲肠的柔嫩艾美耳球虫感染尤为严重,病理表现为肠道黏膜损伤、盲肠肿胀、出血及排出血便[3-4]。迄今为止,药物防治和活疫苗是两种主要的球虫病控制策略[5],但抗球虫药和接种疫苗会引起鸡只的药物残留、抗药性及虫株变异等风险[6]。因此在分子水平上研究球虫病抗性基因,通过遗传选育、培育抗病品种是解决这一问题的有效途径。【前人研究进展】白介素8(IL-8)是一种趋化性细胞因子,一方面能激活嗜中性粒细胞,诱导中性粒细胞释放溶酶体酶,清除病原菌[7],另一方面参与免疫反应,实现免疫细胞的抵抗功能,促进伤口愈合[8]。Cornelissen等[9]研究表明IL-8能够有效地招募Thl CD4+、巨噬细胞和单核细胞,进而诱导IFN-γ的产生。Swaggerty等[10]通过连续3个世代选择外周血白细胞促炎性细胞因子白介素6(IL-6)、IL-8和趋化因子CCLi2的高水平表达(非球虫感染)的肉鸡个体进行配种,发现其后代柔嫩艾美耳球虫的抵抗能力极显著高于低表达水平群体。陈仁金等[11]采用混合动物模型将IL-8基因遗传多态性与荷斯坦奶牛7个性状进行关联分析,发现ILS基因连锁突变对荷斯坦牛泌乳性状以及抗病性状有较大的遗传效应,可用于中国荷斯坦牛的分子标记辅助选择。林雨鑫等[12]采用RNA-seq技术对E.tenella感染鸡和非感染对照鸡的盲肠组织进行转录组分析,筛选到许多显著富集的通路和差异表达基园,主要有IL-6、IL-8、IL-12β、IL-15、IL-17和TGFB2等。辛世杰等[8]研究发现,IL-8基因在感染柔嫩艾美耳球虫的京海黄鸡脾脏和盲肠组织中表达量显著升高,表明IL-8基因在鸡球虫感染中发挥一定的作用。【本研究切入点】虽然已有研究发现IL-8参与免疫应答、具有诱导中性粒细胞释放溶酶体酶和清除病原体等作用,但关于IL-8基因5'调控区单核苷酸多态性对球虫抗性指标的影响的研究鲜见报道。【拟解决的关键问题】本试验采用DNA直接测序技术,检测京海黄鸡IL-8基因5'调控区单核苷酸多态性(SNPs),并对5'调控区的SNPs突变前后转录因子进行预测,同时还分析这些SNPs与球虫抗性指标的关联性,旨在筛选与京海黄鸡柔嫩艾美耳球抗性选育有利的突变基因型,为培育球虫病抗性新品种或新品系提供参考依据。
1 材料与方法
1.1 试验动物
选购江苏省海门集团1日龄京海黄鸡共92只,公母各半,饲养于无病原的鸡舍中,所食饲料中不含任何球虫及抗球虫性药物,试验鸡预试期内经粪检无球虫。E.tenella孢子化卵囊为扬州大学兽医学院寄生虫教研室保存虫种,经非球虫免疫健康鸡体内传代一次后收集獲得。
1.2 样本处理及采集
30日龄时,每只鸡灌饲1.5万个柔嫩艾美耳球虫孢子化卵囊。记录感染期间0~8d体增重。在感染后的第8d翅静脉采血,肝素钠抗凝,立即4000r·min-1离心5min,分离血浆和血细胞后于-20℃冰箱中保存。
1.3 基因组DNA提取及检测
根据文献[8]的方法提取所有试验鸡的全血基因组DNA,用微量紫外可见光分光光度计对基因组DNA进行OD值以及浓度测定,经测定所提取的DNA样品OD260nm/OD280nm值在1.8~2.0,质量浓度在500~1000μg·μL-1,均符合试验要求。将合格样品稀释至100ng·μL-1,4℃或-20℃(长期)保存备用。
1.4 引物设计及PCR扩增
根据GenBank中已公布的鸡IL-8基因序列(GeneID:396495),使用Primer Premier 5.0对IL-8基因上游-2000 by至-1bp的核苷酸序列共设计4对引物。引物由上海生工生物工程有限公司合成,引物设计详细信息见表1。
PCR反应体系:10μL的2×Taq Master Mix,上下游引物各1μL,DNA模板1μL,最后加入水补足至20μL体系。PCR扩增程序:95℃预变性5min;95℃变性30s,引物最佳退火温度退火30s,72℃延伸1min,35个循环;72℃延伸10min,4℃保存。
1.5 基因测序
PCR产物送至上海生物工程技术服务有限公司进行测序。使用仪器为ABI测序仪(3730x1DNA Ana-lyzer)。DNA序列拼接后,用MEGA6.06和DNA-MAN5.2软件对测序结果进行比对分析,并确定京海黄鸡IL-8基因的SNPs。
1.6 转录因子预测
使用在线软件AliBaba2.1(http://gene-regulation.com/pub/programs/alibaba2/index.html)进行预测IL-8基因5'调控区核苷酸序列突变后可能存在的转录因子结合位点和可能结合的转录因子。
1.7 抗性指标测定
血浆抗氧化指标按试剂盒(购自南京建成生物工程研究所)说明书采用生物素双抗体夹心酶联免疫吸附法(ELISA)法测定[13-14],测定指标包括:超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化氢酶(CAT)、一氧化氮(NO)、白介素1-β(IL-1β)、白介素2(IL-2)、白介素6(IL-6)、白介素8(IL-8)、干扰素-γ(IFN-γ)。
1.8 数据统计分析
使用Popgene1.32软件对IL-8基因5'调控区SNPs数据进行群体遗传多样性分析,包括杂合度(H)、有效等位基因数(Ne)和多态信息含量(PIC),统计整理各突变位点的基因型频率、等位基因频率,用χ2检验方法对群体Hardy-Weinberg进行平衡检测。运用SPSS25.0对各抗性指标数据进行关联分析。
2 结果与分析
2.1 IL-8基因PCR测序结果
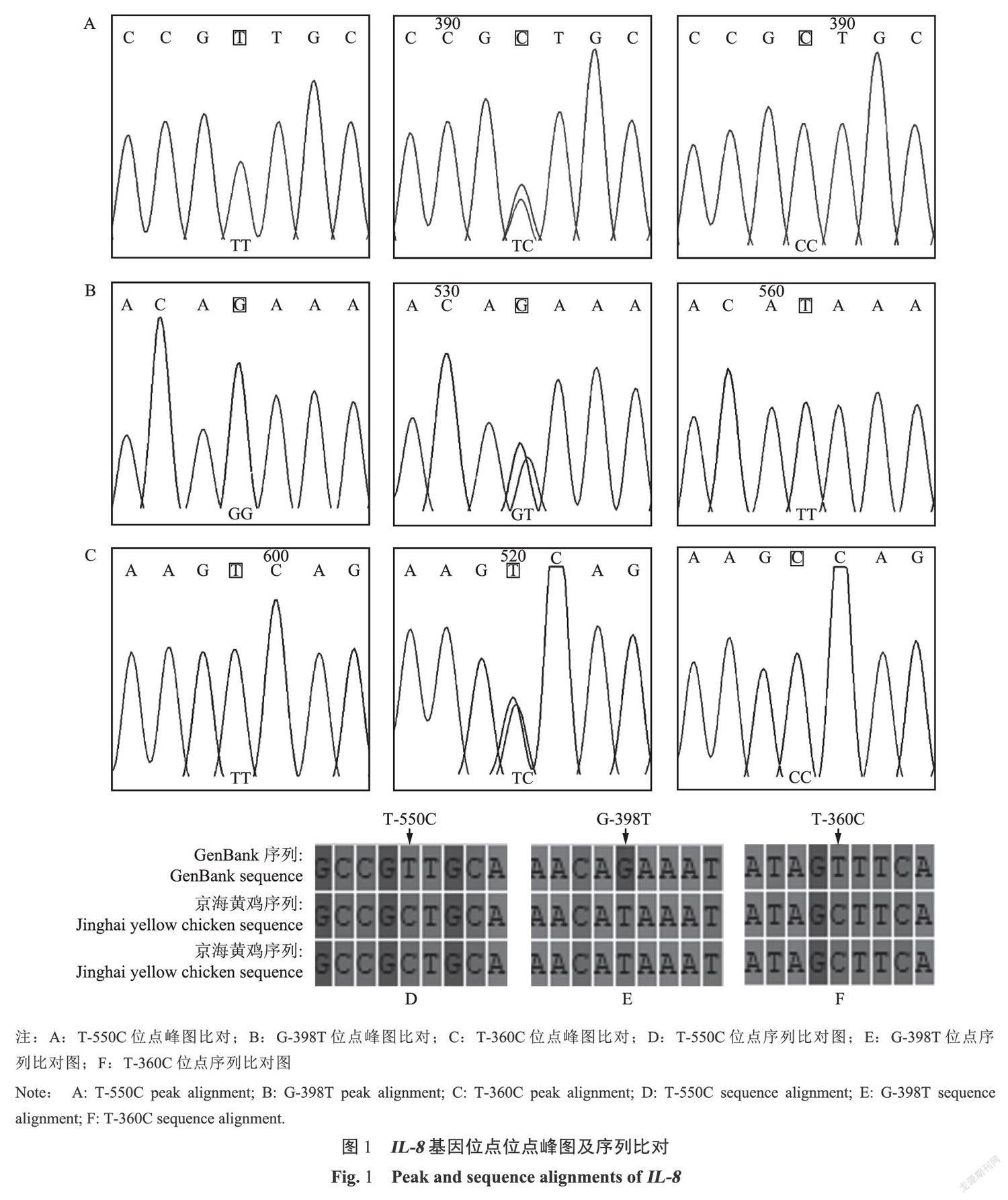
以提取的92只京海黄鸡基因组DNA为模板,依据NCBI数据库中鸡(Gallus gallus)IL-8基因上游-2000bp至-1bp的核苷酸序列设计的引物进行PCR扩增测序及拼接。测序共发现了3个SNPs突变位点(见表2),1号突变位点在一550碱基发生T→C的突变,命名为T-550C。2号突变位点在-398碱基发生G→T的突变,命名为G-398T。3号突变位点在-360碱基发生T→C的突变,命名为T-360C。详细信息见图1。
2.2 IL-8基因5'调控区SNPs突变引起的转录因子改变预测结果
由表3可见,IL-8基因5'调控区在-550bp发生了T→C的突变,此处突变导致原有的Oct-1转录因子结合位点消失;在-398bp发生了G→T的突变,导致此处原先C/EBPalp转录因子的结合位点发生位置改变,且新增了1个Pit-1a转录因子的结合位点;在-360bp的突变(T→C)导致原有的NF-1转录因子结合位点消失。
2.3 IL-8基因5'调控区多态性分析
对IL-8基因5'调控区发现的3个SNPs位点进行多态性及遗传多样性分析(表4),结果表明:3个突变位点均形成了3种基因型,杂合度均在0.436~0.471,PIC值在0.25~0.50,均属于中度多态,遗传差异性较大。卡方检验结果显示,3个突变位点均处于哈代-温伯格平衡状态。其中,除了G-398T突变位点外,原等位基因相对于突变后的等位基因均为优势等位基因,而G-398T突变位点突变后的等位基因为优势等位基因。
2.4 IL-8基因5'调控区多态性与血浆抗性指标的关联分析
2.4.1 T-550C突变位点各基因型与鸡球虫杭性指标关联分析T-550C突变位点各基因型与鸡球虫抗性指标关联分析显示(表5),除了SOD、MDA、NO和IL-1β指标外,TC型个体的其他指标均高于其他2种基因型,但差异不显著(P>0.05);TC型的IL-8表达量显著高于TT型(P<0.05),其加性效应值和显性效应值分别为9.10和19.15ng·L-1;TT型个体的NO含量极显著高于CC型(P<0.01),其加性效应值和显性效应值分别为10.12和7.39μmol·L-1。
2.4.2 G-398T突变位点各基因型与鸡球虫杭性指标关联分析由表6可知,TT型个体SOD活性和GT型个体CAT活性均显著高于GG型(P<0.05),SOD与CAT活性的加性效应值分别为46.77和0.035U·mL-1,显性效应值分别为10.99和0.175U·mL-1;TT型个体NO含量均高于其他两种基因型,且与GG型差异极显著(P<0.01),与GT型差异显著(P<0.05),其加性效应值和显性效应值分别为10.86和2.365μmol·L-1;TT型IL-2表达量显著高于GT型(P<0.05),其加性效应值和显性效应值分别为0.67和2.18ng·L-1;TT型IL-1β、IL-8表達量均高于GG型个体,但未达到显著水平(P>0.05)。
2.4.3 T-360C突变位点各基因型与鸡球虫抗性指标关联分析 由T-360C突变位点各基因型与鸡球虫抗性指标关联分析(表7)可知,除MDA、CAT、IL-1β、IFN-γ指标以外,TT型个体的其他指标均高于其他2种基因型;对于SOD活性,TT型个体与CC型差异极显著(P<0.01),TC型个体与CC型个体差异显著(P<0.05),其加性效应值和显性效应值分别为64.43和10.55U·mL-1;对于NO含量,TT型和TC型个体均显著高于CC型个体(P<0.05),其加性效应值和显性效应值分别为5.94和4.53μmol·L-1;对于IL-2、IL-8表达量,TT型个体均显著高于CC型个体(P<0.05),IL-2与IL-8活性的加性效应值分别为1.68和10.02ng·L-1,显性效应值分别为0.32和1.87ng·L-1;对于IFN-γ含量,CC型个体显著高于其他2种基因型个体(P<0.05),其加性效应值和显性效应值分别为15.015和9.55ng·L-1;TT型GSH-PX、IL-6指标均高于其他2种基因型,但差异不显著(P>0.05)。
3 討论与结论
3.1 IL-8基因5'调控区的多态性检测
5'调控区是基因转录调控的核心区域,该区域突变形成的SNPs可改变原有的转录因子结合位点和转录因子,从而影响与该基因有关性状的表达。因此研究基因5'调控区SNPs及其与相关性状的关联分析是发掘新的分子遗传标记的重要途径之一[4,15]。宁娟[16]研究表明结构蛋白N和非结构蛋白Nsp2Marc-145细胞中表达能激活转录因子NF-κB,而活化的NF-κB进入核内与IL-8启动子上的NF-κB位点结合后,能诱导IL-8的表达。Wu等[17]体外试验结果表明,转录激活因子3(ATF3)的抑制可显著提高人支气管上皮细胞中促炎细胞因子IL-6和IL-8的表达。本研究在5'调控区共检测到3个SNP位点:T-550C、G-398T和T-360C。这3个突变位点均形成了3种基因型,杂合度均在0.436~0.471,PIC值在0.25~0.50,均属于中度多态,遗传差异性较大,有利于鸡育种中的群体遗传分化。其中,T-550C和T-360C突变位点均是杂合型所占比例较高,TC为优势基因型,T为优势基因,而G-398T位点突变后的等位基因为优势等位基因,杂合型为优势基因型。卡方检验结果显示,3个突变位点均处于哈代一温伯格平衡状态,这可能是由于群体规模较大,突变位点没有受到选种选配的影响或是在选育过程中达到了新的平衡。生物信息学分析发现:在-550bp发生了T→C的突变,导致原有的Oct-1转录因子结合位点消失;在-398bp发生了G→T的突变,导致此处原先C/EBPalp转录因子结合位点发生位置改变,且新增了1个Pit-1a转录因子的结合位点;在-360bp的突变(T→C)导致原有的NF-1转录因子结合位点消失。本研究发现的这3个突变位点均改变了其原有的转录因子结合位点,转录因子结合位点的改变可能使IL-8基因表达发生变化,进而影响血浆中IL-8的浓度。IL-8参与免疫反应,在炎症和免疫应答中起着重要作用。有研究表明鸡感染球虫后,体内IL-8表达量越高,其抗球虫能力越强[10]。因此推测转录因子结合位点的改变可能会影响鸡抗球虫能力,但具体机制有待进一步研究。
3.2 IL-8基因5'调控区的多态性与鸡球虫抗性指标的关系
目前有关鸡IL-8基因的SNPs与球虫抗性指标关联分析的研究较少。本研究将5'调控区发现的3个SNPs与鸡球虫抗性指标关联分析,结果表明:在T-550C位点突变后形成的3种基因型中,大多数指标均是TC型高于其他2种基因型,且TC型个体IL-8表达量显著高于TT型。对于G-398T突变位点,TT型个体显著或极显著高于GG型的SOD、NO指标,显著高于GT型的IL-2表达量,并且TT型IL-1β、IL-8表达量也都高于GG型个体,因此突变后的TT型个体可能抵抗球虫病能力较强。对于T-360C突变位点,除了对MDA、GSH-Px、CAT、IL-1p、IL-6指标无显著影响外,TT型和TC型个体的SOD活性极显著或显著高于CC型,TT型和TC型个体的NO含量均显著高于CC型个体,TT型个体的IL-2、IL-8表达量均显著高于CC型。IL-8参与免疫应答,能诱导中性粒细胞释放溶酶体酶和清除病原体,在炎症和免疫应答中发挥关键调节作用。本研究在IL-8基因5'调控区检测到的3个SNPS均改变了其原有的转录因子结合位点,进而影响IL-8基因的表达,导致血浆中IL-8的表达量升高,有效地提高鸡体内的免疫水平,增强抵抗E.tenella的能力。
参考文献:
[1]WANG G P,TANG X L,BI F F,et al.Eimeria tenella InfectionPerturbs the Chicken Gut Microbiota from the Onset of OocystShedding[J].Veterinary Parasitolog3,2018,258:30-37.
[2]BLAKE D P,TOMLEY F M.Securing poultry production from theever-present Eimeria challenge[J].Trends in Parasitolog7,2014,30(1):12-19.
[3]林雨鑫,张菁菁,戴国俊,等.京海黄鸡杂交配套系亲本对柔嫩艾美耳球虫的敏感性[J].中国兽医学报,2015,35(7):1074-1078.
[4]王诗琴,辛世杰,王晓慧,等.IL-6基因启动子区单核苷酸多态对京海黄鸡柔嫩艾美尔球虫抗性指标的影响[J].扬州大学学报(农业与生命科学版),2018,39(1):36-41.
[5]JANG S I,LILLEHOJ H S,LEE S H,et al.Immunoenhancing effectsof MontanideTMIsa oil-based adjuvants on recombinant Coccidiaantigen vaccination against Eimeria acervulina infection[J].Veterinary Parasitology,2010,172(3/4):221-228.
[6]ABBAS R Z,IQBAL Z,BLAKE D,et al.Anticoccidial drugresistance in fowl Coccidia:the state of play revisited[J].World'sPoultry Science Journal,2011,67(2):337-350.
[7]COUSSENS L M,WERB Z.Inflammation and cancer[J].Nature,2002,420(6917):860-867.
[8]辛世杰,王晓慧,戴国俊,等.京海黄鸡柔嫩艾美尔球虫感染对脾脏和盲肠IL-6、IL-8、CCLi2基因表达量的影响及其相关性[J].浙江农业学报,2019,31(1):39-46.
[9]CORNELISSEN J B W J,SWINKELS W J C,BOERSMA W A,et al.Host response to simultaneous infections with Eimeria acervulina,maxima and tenella:A cumulation of single responses[J].VeterinaryParasitolog),2009,162(1/2):58-66.
[10]SWAGGERTY C L,PEVZNER I Y,KOGUT M H.Selection for pro-inflammatory mediators produces chickens more resistant to Eimeriatenella[J].Poulb]Science,2015,94(1):37-42.
[11]陈仁金,杨章平,毛永江,等.中国荷斯坦牛IL-8基因遗传多态性与泌乳性状以及体细胞评分的关联[J].遗传,2010,32(12):1256-1262.
[12]林雨鑫.京海黄鸡柔嫩艾美耳球虫感染后盲肠转录组分析及其杂交配套系亲本的抗性评价[D].扬州:扬州大学,2015.
[13]杨军.益生菌对柔嫩艾美尔球虫感染雏鸡免疫水平的影响及免疫保护效果评价[D].长春:吉林农业大学,2015.
[14]李玲秀.茶多酚与茶皂素对隐性感染球虫的肉鸡生长、免疫力及抗氧化性能的影响[D].合肥:安徽农业大学,2014.
[15]李秀秀,王文文,郝园丽,等.寿光鸡AANAT基因5调控区的单核苷酸多态性及其与产蛋性状的关联分析[J].农业生物技术学报,2017,25(6);921-929.
[16]宁娟.猪繁殖与呼吸综合征病毒感染Marc-145细胞激活白细胞介素8的表達的研究[n].武汉:华中农业大学,2009.
[17]WU Y P,CAO C,WU Y F,et al.Activating transcription factor 3represses cigarette smoke-induced IL6 and IL8 expression viasuppressing NF-κB activation[J].Toxicology Letters,2017,270:17-24.
(责任编辑:张梅)
收稿日期:2019-06-21初稿;2019-10-26修改稿
作者简介:王晓慧(1994-),女,硕士,研究方向:家禽生产及抗病育种(E-mail:1216688368@qq.com)
通信作者:戴国俊(1963-),男,博士,教授,研究方向:家禽生产及抗病育种(E-mail:daigj@yzu.edu.cn)
基金项目:江苏现代农业产业技术体系建设专项(JATSf20181303);“十二五”国家科技支撑计划项目(2014BAD131302);江苏省高校优势学科建设工程(PAPD);国家现代农业产业技术体系建设专项(CARS-41-G23)

