长裙竹荪菌丝体凝集素的分离纯化及其理化性质
林勇 刘俊锋 唐小峦 张月芬 戴推彬

摘要:【目的】凝集素是竹荪的一类生理活性物质,为进一步明确其药用功效,开展了长裙竹荪凝集素理化性质研究。【方法】长裙竹荪菌丝体通过生理盐水抽提、20%~75%饱和度的硫酸铵沉淀、DEAE-Sepharose和SephadexG-100柱层析纯化得到长裙竹荪菌丝体凝集素(DIL);并通过血细胞凝集活性、糖抑制试验、酸碱稳定性、热稳定性分析以及金属离子等因素来测定长裙竹荪菌丝体凝集素的理化性质。【结果】经PAGE显示单一条带,测得其亚基相对分子质量为43.6kDa。该凝集素对供试的鸽、兔、鸭和鸡血红细胞具有凝集作用,对兔红细胞的凝集作用可被D-半乳糖和N-乙酰胺基-葡萄糖所抑制。长裙竹荪凝集素对热不稳定,经50℃处理10min,活性明显降低;该凝集素在pH 4.0-8.0都保持着较高的凝集活性,其凝血活性依赖于Ca2+和Mg2+二价金属离子,Mn2+和Zn2+则无影响。[结论]长裙竹荪菌丝体凝集素对动物血红细胞具有较好的凝集活性,而且凝集活性需要在一定浓度的Ca2+和Mg2+才会起作用。
關键词:凝集素;长裙竹荪;分离纯化;理化性质
中图分类号:S646 文献标志码:A 文章编号:1008-0384(2019)11-1342-05
0 引言
【研究意义】竹荪,亦称竹参、竹菌、竹笙,是一类大型真菌。长裙竹荪Dictyophora indusiata为竹荪属模式种,在真菌分类学上,属担子菌亚门,腹菌纲,鬼笔菌目,鬼笔菌科[1],具有较好的食用、保健兼药用价值。凝集素是一种可以从植物、动物或微生物中提纯的糖蛋白或结合糖的蛋白,在信号转导、细胞凝集、免疫功能、抑制肿瘤细胞生长、血型鉴定和高分子化合物的筛选、纯化等方面都发挥着重要的作用[2],而凝集素也是竹荪中所含的一类重要的生理活性物质,具有重要的研究和开发价值。【前人研究进展】近年来,国内外有报道表明,从食用菌子实体或菌丝体中分离得到的特异构型的活性蛋白和多糖类物质,这些物质在免疫功能的调节、肿瘤因子的抑制以及抑菌防腐功能中都扮演着重要的角色,其功效都与凝集素有着密切的关系[3-8]。目前从动植物中已分类纯化的凝集素有100多种,其中大部分做成产品[4];从真菌广泛分布地区采集了403种,用人红细胞和兔红细胞检测凝集素,其中50%含有凝集素[9],其研究价值不断提高,受到国内外学者的高度关注。【本研究切入点】因此,对食用菌凝集素的深入研究,可以更好地开发应用这一宝贵生物资源提供科学依据。目前,对竹荪的研究主要集中在其栽培及抗菌活性上,对竹荪凝集素的研究仅发现林玉满和苏爱华对其子实体凝集素的报道[4,10],而从长裙竹荪菌丝体中分离纯化凝集素的相关研究,至今还尚未见到报道。【拟解决的关键问题】利用液体发酵培养长裙竹荪,开展长裙竹荪菌丝体凝集素提取分离和理化性质的研究,以期为长裙竹荪菌丝体凝集素生物学活性研究利用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株 长裙竹荪Dictyophora indusiata Fisscher菌株由福建农业科学院食用菌研究所提供。
1.1.2 培养基 玉米淀粉20g,黄豆粉10g,葡萄糖20g,酵母膏5g,磷酸二氢钾3g,硫酸镁1.5g、维生素B150mg·L-1,调整pH至6.0,分装三角瓶中高压灭菌(121℃,20min)。
1.1.3 动物血红细胞及其悬液制备 兔血、鸽血、鸡血、鸭血采购自福州农贸市场。各种动物血样中分别加入柠檬酸钠抗凝剂,通过离心去除血浆,用生理盐水将血红细胞洗涤4~5次,配制的红细胞悬液的含量最终达到2%。
1.1.4 试剂 试剂Sephadex G-100、DEAF-SephroseFast Flow、蛋白质Marker分别购自Pharmacia公司、北京鼎国生物技术有限公司和购自Fermentas公司;其他常规药品、试剂为国产分析纯。
1.1.5 仪器 ZHWY-200B恒温培养振荡器、冷冻干燥机、L-550型低速台式离心机。
1.2 试验方法
1.2.1 长裙竹荪菌丝体的培养 将试管斜面长裙竹荪菌种接人装有已灭菌冷却50mL培养基的250mL三角瓶中,28℃静置培养5d,而后采用180r·min-1摇床28℃培养7d,终止发酵,用4层纱布过滤,菌丝体用高纯水冲洗,重复3次,放入-20℃冰箱保存备用。
1.2.2 长裙竹荪菌丝体凝集素的分离和纯化 长裙竹荪菌丝体按质量/体积比为1:3(即w/v=1/3)加入生理盐水在4℃下浸泡18h,用高速组织捣碎机匀浆后在4℃下继续浸提6h,匀浆4℃下冷冻离心(8000r·min-1,20min),取出上清液备用。通过20%~75%饱和度的硫酸铵沉淀,收集沉淀部分,将沉淀溶于少量的PBS缓冲液(0.05mol·L-1,pH=6.8)中,并装入透析袋除盐,随后用同一种缓冲液再透析,直到外透析液中SO42-离子低于检测限以下为止。聚乙二醇浓缩后上DEAE-Sepharose Fast Flow柱(1.6cm×30cm)以磷酸盐缓冲液(0.05mol·L-1,pH=6.8)进行梯度洗脱,分管收集,检测波长为280nn,采用鸽子血检测各洗脱峰的血凝活性,收集活性峰。第一次收集的活性峰经Sephadex G-100柱(1.6cm×60cm)柱再次进行层析提纯,以4mL·管-1的流速进行,时间为10min·管-1,以磷酸缓冲液(0.05mol·L-1,pH=7.2)进行洗脱,分管收集后依次检测各峰的凝血活性,采用冷冻干燥处理活性峰,得菌丝体凝集素纯品。
1.2.3 SDS-PAGE测定长裙竹荪菌丝体凝集素亚基相对分子质量 凝胶电泳参考Laemmli[11]的方法,分离胶和浓缩胶的含量分别为15%和5%,采用考马斯亮蓝R-250染色[12]。
1.2.4 長裙竹荪菌丝体凝集素的血凝活性 根据孙册的方法[2],采用“V”型血凝板进行血凝活性测定,首先用等量的PBS对20μL质量浓度为10mg·mL-1的凝集素溶液进行不同倍比的稀释,然后分别加20μL2%的不同动物血红细胞,在室温下将混合液振荡摇匀后放置2h,对试验结果进行实时观察和记录,当凝集反应出现时记录下此时的最大稀释倍比。
1.2.5 糖抑制试验 将10mg·mL-1长裙竹荪菌丝体凝集素不同倍数稀释后,分别添加在“V”型血凝板上,然后加入40mmol·L-1的各种糖溶液混合1h后,再加入20μL2%鸽血红血细胞,振荡摇匀后放置于室温下2h,观察其凝集结果。
1.2.6 酸碱稳定性分析 参照Ahmed and Chatterjee的方法配制pH4.0~10.0的不同系列缓冲液,在设定的pH条件下测定长裙竹荪菌丝体凝集素的血凝活力。pH4.0~6.0,采用0.015mol·L-1的柠檬酸-磷酸二氢钠缓冲液;pH6.5~7.5,采用0.015mol·L-1的磷酸盐缓冲液;pH8.0~9.0,采用0.015mol·L-1的三乙醇胺盐缓冲液,pH10.0采用0.015mol·L-1的碳酸钠-碳酸氢钠缓冲液。将长裙竹荪菌丝体凝集素分别在上述各种盐缓冲液中配制成质量浓度为10mg·mL-1的溶液,然后用2%的鸽血红细胞在“V”型血凝板上检测其凝集活性。
1.2.7 热稳定性分析 设置8个温度梯度,每10℃为1个梯度,即30,40,50,60,70,80,90,100℃。将质量浓度为1mg·mL-1的长裙竹荪菌丝体凝集素溶液,分别置于以上不同温度的水浴下处理10min,然后用纯水对样品进行冷却至室温为止,同时对凝集素的血凝活性进行检测。
1.2.8 金属离子对长裙竹荪菌丝体凝集素的影响根据林玉满等[10]的方法,设定温度为4℃,在透析袋中加入10mg·mL-1的长裙竹荪菌丝体凝集素,同时把透析袋放置于20mmol·L-1的EDTA-Na2溶液中进行充分透析,获得不含金属离子的菌丝体凝集素溶液,再通过生理盐水作不同倍比稀释后,分别加入10mmol·L-1的4种二价金属离子(Ca2+,Mn2+,Zn2+,Mg2+),各自检测凝集素对鸽血红细胞的凝血活性。将没有处理的长裙竹荪菌丝体凝集素溶液和经EDTA处理的菌丝体凝集素溶液作为对照。
2 结果和分析
2.1 长裙竹荪菌丝体凝集素的分离和纯化
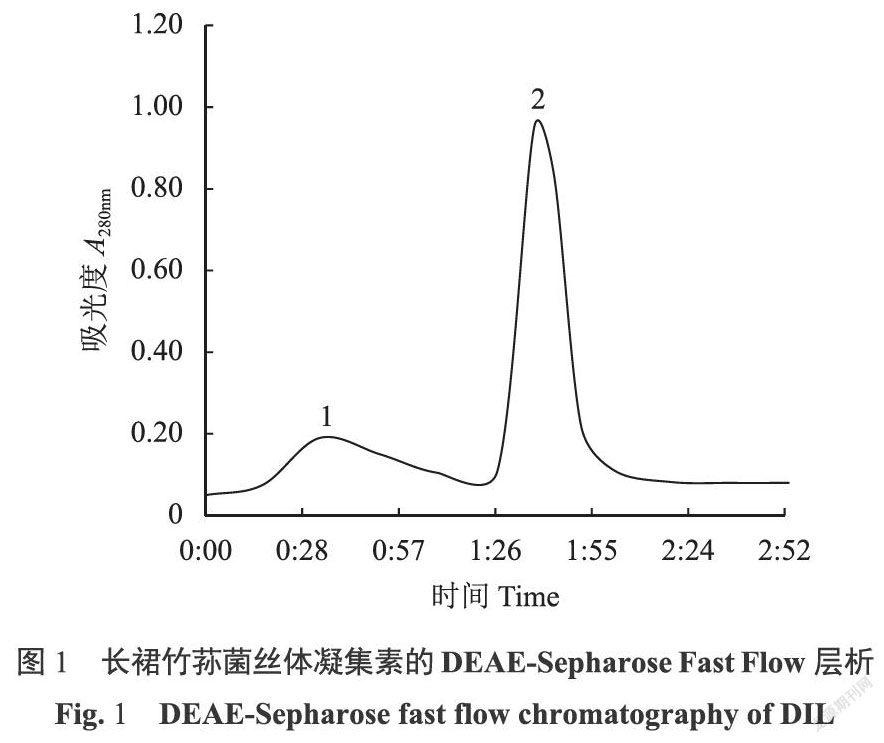
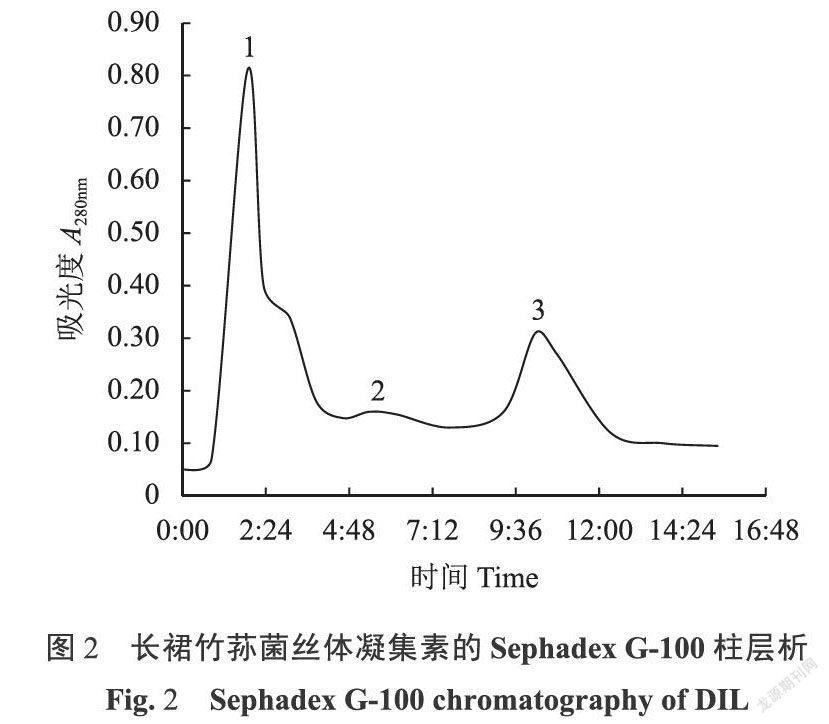
长裙竹荪菌丝体凝集素粗品经DEAE-Fast Flow离子交换层析,得到2个洗脱峰(图1),经血凝活性测定,其中峰2部分具有凝血活性,该活性部分经Sephadex G-100柱进一步纯化,得到3个洗脱峰(图2);经血凝活性试验,发现第2峰具有血凝活性,而第1峰则无活性。将第2洗脱峰的洗脱液收集后进行透析除盐,经冷冻干燥后得到长裙竹荪菌丝体凝集素纯品DIL。
2.2 长裙竹荪菌丝体凝集素亚基相对分子质量测定
如图3所示,经SDS-PAGE电泳检测,长裙竹荪菌丝体凝集素所得为单一条带,根据标准蛋白质分子质量制作标准曲线,通过计算得到长裙竹荪菌丝体凝集素亚基的相对分子质量为43.6kDa。
2.3 长裙竹荪菌丝体凝集素的血细胞凝集活性分析
将长裙竹荪菌丝体凝集素配制成初始质量浓度为10mg·mL-1的溶液,经过不同倍数稀释后测定其对鸽、兔、鸡、鸭血的凝血活性,结果表明:长裙竹荪菌丝体凝集素对4种供试动物血细胞均有一定的凝集作用(表1),但凝集素对不同种类血细胞的凝集能力有差异,其对鸽血血细胞的凝集活性最强(活性达到210),最低凝集质量浓度为9.8μg·mL-1,对鸡血细胞的凝集作用最差(活性仅为23),最低凝集质量浓度为1.25mg·mL-1。
2.4 长裙竹荪菌丝体凝集素的糖抑制实验
如表2所示,经过倍比稀释,起始质量浓度为10mg·mL-1的长裙竹荪菌丝体凝集素的糖抑制试验结果表明:凝集素对鸽红细胞的凝集活性可被D-半乳糖和N-乙酰胺基-葡萄糖所抑制,但抑制程度有差异,而其他供试的4种糖对长裙竹荪菌丝体凝集素的凝集活性无抑制作用。
2.5 长裙竹荪菌丝体凝集素的酸碱稳定性分析
长裙竹荪菌丝体凝集素起始质量浓度为10mg·mL-1,如表3所示,在pH3.0~10.0缓冲系统中的稳定性测定结果表明,其凝集活性在pH4.0~8.0,凝集活性最高;但当pH为3.0或9.0~10.0时,其凝集活性下降较为明显。
2.6 长裙竹荪菌丝体凝集素的热稳定性分析
经过30℃~80℃的不同温度处理后,菌丝体凝集素对鸽血细胞的凝集活性结果如表4所示,当处理温度达到50℃时低质量浓度凝集素的凝集活性开始部分下降;当处理温度达到70℃,长裙竹荪菌丝体凝集素对鸽血红细胞失去凝集活性,这表明长裙竹荪菌丝体凝集素对温度的耐受性较低。
2.7 金属离子对长裙竹荪菌丝体凝集素凝集活性的影响
测定二价金属离子对长裙竹荪菌丝体凝集素凝集活性影响的结果,如表5所示,结果表明:长裙竹荪菌丝体凝集素对鸽血红细胞的凝集活性与金属离子有一定相关性。采用EDTA-Na2将长裙竹荪菌丝体凝集素中的金属离子去除后,则凝集素活性隨之消失,然而在去除金属离子的长裙竹荪菌丝体凝集素溶液中,分别再加入Ca2+、Zn2+、Mg2+、Mn2+二价金属离子,Ca2+和Mg2+的离子浓度为10mmol·L-1,可恢复长裙竹荪菌丝体凝集素至较高的活性水平,而Zn2+和Mn2+对其活性则无影响,这说明长裙竹荪菌丝体凝集素凝集活性需要一定浓度的Ca2+和Mg2+才会起作用。
3 讨论与结论
本研究利用液体发酵培养得到长裙竹荪菌丝体,从菌丝体中提取并分离纯化得到长裙竹荪菌丝体凝集素(DIL)。与传统的人工栽培长裙竹荪(子实体)相比,通过液体发酵培养获取长裙竹荪菌丝的模式培养周期短、不受气候影响的优点,能较容易地提供大量原料资源用于提取长裙竹荪菌丝体凝集素,为今后可能的工业化生产提供了保证。本研究测定的长裙竹荪菌丝体凝集素亚基的相对分子质量为43.6kDa,略小于林玉满等[10]报道的棘托竹荪子实体凝集素的亚基;并且长裙竹荪菌丝体凝集素对温度的耐受性较低,对热不稳定,结果与相关文献报道的一致,但是本研究分离纯化的长裙竹荪菌丝体凝集素在温度70℃时失去活性,略高于林玉满等[10](60℃)的报道。
凝集素能与糖类分子专一性结合,这也是凝集素重要的特征之一,凝集素的糖结合位点的形状、大小、糖决定簇在糖链中的位置及配体糖的构象在这种专一性结合中起着决定性的作用[14]。糖对长裙竹荪菌丝体凝集素抑制试验表明,供试的D-半乳糖和N-乙酰胺基-葡萄糖能抑制其对鸽血红细胞的凝集活性,而D-甘露糖、D-海藻糖、L-鼠李糖和L-阿拉伯糖对长裙竹荪菌丝体凝集素的凝集活性无抑制作用,这与长裙竹荪菌丝体凝集素结合细胞受体的糖结合专一性有关。根据这一特性,以后对长裙竹荪菌丝体凝集素的纯化可以采用含有D-半乳糖或N-乙酰胺基-葡萄糖单糖链的亲和层析,以提高纯化效率。
在测定二价金属离子Ca2+、Zn2+、Mg2+、Mn2+对长裙竹荪菌丝体凝集素的凝集活性影响的过程中发现,长裙竹荪菌丝体凝集素对鸽血红细胞的凝集活性依赖于一定浓度的Ca2+和Mg2+,Mg2+和Mn2+对其活性则无影响,这与林玉满和苏爱华[14]所报道的二价金属离子对短裙竹荪凝集素凝集活性的影响结果一致。
有关真菌凝集素对小鼠的急性毒性的研究报道较少,而且有报道指出,棘托竹荪凝集素[10]对小鼠的半致死剂量显著低于草菇凝集素[15]和杨树菇凝集素[16]。因此,后续的工作我们将重点开展长裙竹荪菌丝体凝集素对小鼠的急性毒性的研究,为进一步研发相关系列产品奠定理论基础。
参考文献:
[1]罗信昌,陈士瑜.中国菇业大典[M].北京:清华大学出版社,2016.
[2]孙册,朱政,莫汉庆.凝集素[M].北京:科学出版社,1986.
[3]郭渝南,唐礴,熊彬,等.长裙竹荪托盖液修复大鼠免疫损伤的实验研究[J].中药材,2006,29(2):174-176.
[4]林玉满,苏爱华.长裙竹荪凝集素的分离纯化与部分生化性质[J].中国生物化学与分子生物学报,2003,19(2):261-263.
[5]林玉满.短裙竹荪多糖Dd-S3P的分离纯化及其性质研究[J].生物化学杂志,1997,13(1):99-102.
[6]韩慧,张刚,郝景雯,等.长裙竹荪抑菌作用研究[J].食品研究与开发,2008,29(5):129-131.
[7]谭敬军.竹荪抑菌特性研究[J].食品科学,2001,22(9):73-75.
[8]陈晓宁,郑丽珠,魏奇,等.长裙竹荪抑菌物质乙醇提取工艺及其抑菌效果[J].福建农业学报,2017,32(6):645-651.
[9]PEMBERTON R T.Agglutinins(lectins)from British higherfungi[J].Mycological Research,1994,98(3):277-290.
[10]林玉满,苏爱华.棘托竹荪凝集素的纯化及其生化特性[J].植物资源与环境学报,2004,13(3):1-6.
[11]LAEMMLI U K.Cleavage of structural proteins during the assemblyof the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[12]余萍,黄德棋,林玉满.韭菜凝集素的纯化及部分性质的研究[J].福建师范大学学报,1995,11(3):71-75.
[13]AHMED H,CHATTERJEE B P.Further characterization andinununochemical studies on the carbohydrate specificity of jackfruit(Artocarpus integrifolia)lectin[J].Journal of Biological Chemistry,1989,264(16):9365-9372.
[14]林玉满,苏爱华.短裙竹荪(Dilyophora duplicata)凝集素纯化与生fUtm[J].中国生物化学与分子生物学报,2005,21(1):101-107.
[15]LIN J Y,CHOU T B.Isolation and characterization of a lectin fromedible mushroom,Volvariella volvacea[J].The Journal ofBiochemistry,1984,96(1):35-40.
[16]孙慧,赵辰光,全鑫,等一种新杨树菇(Agrocybe aegerita)凝集素的纯化及生化特性[J].中国生物化学与分子生物学报,2003,19(1):96-102.
(责任编辑:林海清)
收稿日期:2019-10-30初稿;2019-11-15修改稿
作者简介:林勇(1970-),男,副研究员,研究方向:天然产物研究与应用(E-mail:lforesty@163.com)
基金项目:福建省科技计划公益类专项(201581020-4);福建省科技特派员项目(闽财指[2019]476号)

