基于生物絮团技术构建的零换水养殖系统对凡纳滨对虾高密度养殖效果分析
范鹏程 徐武杰 文国樑 徐煜 许云娜 李卓佳 杨铿 张建设 曹煜成

摘要:【目的】探討在零换水条件下开展凡纳滨对虾高密度养殖的可行性,为后续推动对虾零换水高效健康养殖模式的规模化产业应用提供参考依据。【方法】采用封闭式串联养殖池系统,凡纳滨对虾虾苗放养密度690尾/m3,养殖周期91 d(13周),以生物絮团技术调控养殖水质,养殖全程不换水,定期监测与分析养殖水体主要水质指标及细菌数量的动态变化特征。【结果】经13周的零换水养殖后,凡纳滨对虾平均存活率为(83.90±2.74)%,收获规格平均为14.50±0.99 g/尾,单位水体对虾产量平均为8.39±0.48 kg/m3,饲料系数平均为1.25±0.06,养殖对虾单产平均耗水量为120.00±6.38 L/kg。从养殖第7周起,水体中生物絮团量维持在18.2~30.4 mL/L,pH基本维持在7.31~7.60,总碱度在116~224 mg/L范围内波动变化,总氨氮(TAN)浓度降低至0.45 mg/L以下并保持至试验结束,亚硝酸盐氮(NO2--N)浓度保持低于0.70 mg/L,硝酸盐氮(NO3−-N)浓度呈持续上升趋势,至试验结束时接近135.0 mg/L。养殖水体中的异养细菌和弧菌数量均呈先升高后降低的变化趋势,其中,异养细菌从第9周后一直维持在×106 CFU/mL的数量级水平,弧菌从第7周后一直维持在×102 CFU/mL的数量级水平。【结论】科学运用生物絮团技术对凡纳滨对虾养殖水质进行原位调控能实现高密度零换水的高效健康养殖,还可有效提高水资源的利用效率,有助于推动对虾养殖产业的绿色健康发展。
关键词: 凡纳滨对虾;高密度养殖;零换水;微生物调控;生物絮团
中图分类号: S966.129 文献标志码: A 文章编号:2095-1191(2019)12-2833-08
Production trial and analysis of Litopenaeus vannamei based on biofloc technology at a high density in zero-water exchange systems
FAN Peng-cheng1,2, XU Wu-jie2,3, WEN Guo-liang1,2, XU Yu2,3, XU Yun-na2, LI Zhuo-jia2, YANG Keng2, ZHANG Jian-she1, CAO Yu-cheng1,2,3*
(1Zhejiang Ocean University/National Marine Facility Breeding Engineering Technology Research Center,Zhoushan, Zhejiang 316022, China; 2South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences/ Guangdong Key Laboratory of Fishery Ecology and Environment/Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture and Rural Affairs, Guangzhou 510300, China; 3Shenzhen
Experimental Base, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences,Shenzhen,Guangdong 518121, China)
Abstract:【Objective】This study discussed the feasibility of zero-water exchange for high density culture of Litopenaeus vannamei, in order to provide reference for future promotion of large-scale industrial application of the environment friendly and high effective aquaculture. 【Method】In this trial, a closed cascaded ponds system was adopted, the stocking density of L. vannamei was 690 ind/m3, and the culture period was 91 d(13 weeks). Biofloc technology was used to control the water quality of pond systems, and no water was exchanged during the whole culture period. Key water quality parameters and dynamic change of bacteria volume were regularly monitored and analyzed. 【Result】After the 13 weeks(91 d) zero-water exchange culture, the average yield was 8.39±0.48 kg/m3 with an average weight of 14.50±0.99 g/ind, and an average survival rate of (83.9±2.74)%. The feed coefficient was 1.25±0.06 and average water volume used for producing 1 kg shrimps was 120.00±6.38 L/kg. Seven weeks after the start of the trial, the bioflocs volume in the culture water was 18.2-30.4 mL/L, pH remained at 7.31-7.60, total alkali showed no obvious fluctuation regulation within the range of 116-224 mg/L. The concentrations of ammonia nitrogen(TAN) and nitrite nitrogen(NO2--N) were kept below 0.45 mg/L and 0.70 mg/L respectively till the end of the experiment. The concentration of nitrite nitrogen(NO3--N) showed an escalating trend, reaching 135.0 mg/L in the end. The quantity variation of the heterotrophic bacteria and vibrio in water increased at the initial stage and then decreased, with the former maintaining at the level of ×106 CFU/mL since the 9th week and the latter at the level of ×102 CFU/mL since the 7th week. 【Conclusion】Scientific application of biofloc technology for water quality control in situ can realize efficient and healthy aquaculture of L. vannamei in zero-water exchange systems, and meanwhile improve the utilization efficiency of water resources, thereby helping to drive the sustaina-ble development of shrimp aquaculture industry.
Key words: Litopenaeus vannamei; high density production; zero-water exchange; microbial regulation; biofloc
0 引言
【研究意义】近年来,因对虾养殖病害频发及水体环境不断恶化(曹伏龙等,2015),传统的池塘养虾产量和稳定性受到明显影响。在传统的集约化养殖过程中一旦管理不善或受不良天气条件影响,池塘极易形成以微囊藻或颤藻等有害微藻为优势的水体环境,或形成以副溶血弧菌等病原菌为优势的微生物环境,进而严重影响养殖对虾的成活率及产量。在水体环境管理良好的池塘中,其养殖对虾成活率及产量分别较管理不善的池塘提高18.0%~19.4%和19.7%~23.3%(Cao et al.,2014)。据报道,2013年因受不良菌藻环境诱发的对虾肝胰腺坏死综合症影响,全球对虾养殖产量下降23%,其中,我国养殖对虾产量下跌超过13%,泰国下降幅度超过54%,越南对虾养殖区减产68%(文国樑等,2015)。因此,发展并推广对虾零换水养殖模式以提高对虾养殖产量与节约水资源,降低对虾养殖对周边水环境的影响及减少病原微生物侵入,已势在必行。【前人研究进展】零换水养殖模式主要通过循环水养殖系统来实现,分原位水处理和异位水处理两种方式(曹煜成等,2006;宿墨,2017)。异位水处理系统虽然实现养殖过程零换水且自动化水平相对较高,但该模式的水处理过程需配备大量相关设备设施,初次成本投入高,占地面积大,对养殖管理人员的技术水平要求也相对较高(张庆文等,2002;刘鹰等,2005),其高投入、高技术和高风险的特点限制了该系统大规模推广应用(孟庆武等,2008;刘晃等,2009)。基于生物絮团技术的对虾原位水处理养殖模式可将对虾养殖过程中产生的代谢产物及水体中的氨氮和亚硝酸盐等有毒有害物质,直接在养殖池中及时分解转化,无需再经过滤、生物基反应和消毒等复杂处理环节(罗亮等,2013;Avnimelech,2015)。国外已有研究表明,生物絮团技术在水产养殖中能起到有效的水质净化作用(Hari et al.,2006;Azim and Little,2008)。Crab等(2007)研究认为,与传统的生物滤池、固着生物等水处理技术相比,生物絮团技术不仅可保持养殖水体良好的水质,还能提供天然营养来源和提高饲料营养利用。在国内,赵大虎等(2014)研究表明,生物絮团在对虾养殖过程中能有效降低水中的氨氮含量,进而提高虾体免疫活性和解毒代谢能力;李奕雯和徐武杰(2016)报道,采用单池100 m3的跑道池结合生物絮团技术进行对虾养殖,其产量可达6.0 kg/m3,且在未配置复杂水处理设施的条件下仅利用微生物定向培养也能实现养殖全程零换水;李晓梅和郭体环(2017)研究表明,生物絮团在凡纳滨对虾养殖过程中发挥去除氨氮和亚硝酸氮的作用,并建议利用生物絮团技术进行水产养殖时应提前培养好生物絮团再投苗,使生物絮团对氨氮和亚硝酸氮的去除作用得到更好的发挥。【本研究切入点】目前,我国沿海地区众多养殖户将原用于苗种繁育的水泥池改为对虾养殖池,其生产过程中主要以大量换水方式进行水质控制,既不符合产业绿色可持续发展的要求,也不利于对虾病害的防控,因此亟需对该养殖技术模式进行改造升级。生物絮团技术可实现零换水的集约化养殖,为上述问题的解决提供良好技术解决方案。【拟解决的关键问题】在前人研究(赵大虎等,2014;李奕雯和徐武杰,2016;李晓梅和郭体环,2017)的基础上,对废旧的水产育苗水泥池进行改造升级,构建由室内水泥池、循環水泵、气水混合射流器增氧系统和絮团颗粒去除装置等组成的封闭式高效养殖系统,并进行凡纳滨对虾高密度养殖试验,定期监测与分析养殖水体主要水质指标及细菌数量的动态变化特征,探讨在零换水条件下开展对虾高密度养殖的可行性,为后续推动对虾零换水高效健康养殖模式的规模化产业应用提供参考依据。
1 材料与方法
1. 1 零换水养殖试验系统
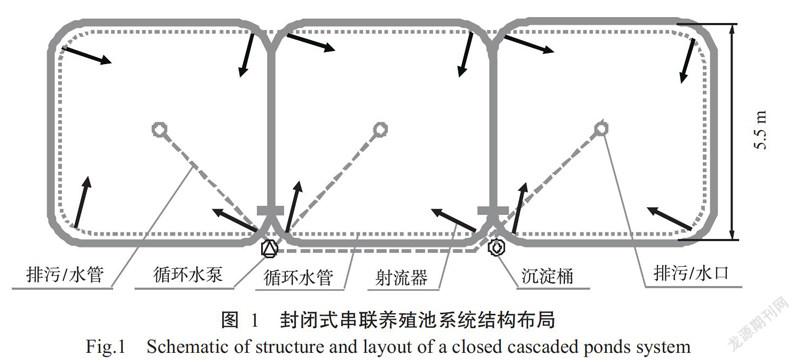
试验在广东汕尾市施公寮村对虾养殖基地进行。12个试验池均为圆弧切角正方形水泥池,池内边长5.5 m,边高0.8 m,中间高1.05 m,池中间留有排水口,养殖过程中以文丘里射流器进行水体增氧,使水体溶解氧稳定在4~8 mg/L。共设4组简易型内循环水养殖池系统(各组均为平行组),各试验池系统均由3个池串联组成(图1),配置1台1.5 kW的循环水泵,1个120 L的生物絮团沉淀桶,每个池布置4个射流器,分别安装在池底四角位置,每个射流器均与循环水管及循环水泵联通,养殖中后期利用沉淀桶调控水体中的生物絮团数量。养殖池系统顶部设钢架大棚,棚顶覆盖半透明塑料膜,四周敞开通风,以避免雨水对养殖水体的影响。
1. 2 凡纳滨对虾养殖管理
各组池于4月17日引入28‰的砂滤海水,池水深0.8 m,以8 mg/L二氧化氯消毒水体24 h,曝气36 h,待水中余氯散除后,各池均添加芽孢杆菌、光合细菌及硝化菌制剂(用于人工诱导培育水体初始菌群),每类菌的添加浓度均为103 CFU/mL,同时添加5 g/m3红糖用于益生菌培养。添加的功能益生菌包括地衣芽孢杆菌(Bacillus licheniformis)、沼泽红假单胞菌(Rhodopseudomonas palustris)、玫瑰红红球菌(Rhodococcus rhodochrous)、嗜盐碱外硫红螺菌(Ectothiorhodospira haloalkaliphila)和海水硝酸盐还原菌(Nitratireductor aquimarinus)等;以上菌种均由中国水产科学研究院南海水产研究所海水池塘养殖生态调控功能实验室提供。5 d后各池按690 尾/m3的密度分别放入凡纳滨对虾PL7虾苗。试验期间每天定时观察对虾摄食、活动及蜕皮等情况,投喂优质配合饲料(5次/d),并根据水体生物絮团形成情况,在放苗后30 d内每天按饲料投喂量的50%补充投入红糖,同时接入实验室驯化培养的硝化菌,待水体形成以硝化菌团为优势的生物絮团后逐步停止添加红糖。养殖过程中,通过添加碳酸钠溶液和生石灰水调节水体pH和总碱度;养殖中后期以沉淀桶控制水体中的生物絮团浓度稳定在15~20 mL/L。养殖全程不换水,仅以少量淡水补充因蒸发损失的水量。
1. 3 水质监测及微生物测定
试验期间每天定时测定各组池水的温度、盐度、溶解氧浓度及pH;每周取水样分别测定水体中的生物絮团、总碱度、总氨氮(Total ammonium-nitrogen,TAN)、亚硝酸盐氮(NO2−-N)、硝酸盐氮(NO3−-N)及异养细菌和弧菌的浓度。其中,生物絮团量参考Xu等(2013)的方法进行测定,其他指标参考GB 17378.4—2007《海洋监测规范第4部分:海水分析》进行测定。
1. 4 对虾生产性能指标测定
养殖91 d后进行对虾个体称重,并计算存活率、单位产量、饲料系数及耗水量等相关指标。
存活率(%)=初始放苗数量/(收获虾产量/收获
虾均重)×100
单位产量(kg/m3)=收获虾产量/养殖水体体积
饲料系数=饲料投入量/收获虾产量
耗水量(L/kg)=养殖水体使用量/收获虾产量
1. 5 统计分析
采用Excel 2010对试验数据进行统计分析,并绘制水质指标和细菌数量变动曲线图。
2 结果与分析
2. 1 凡纳滨对虾养殖生产性能分析
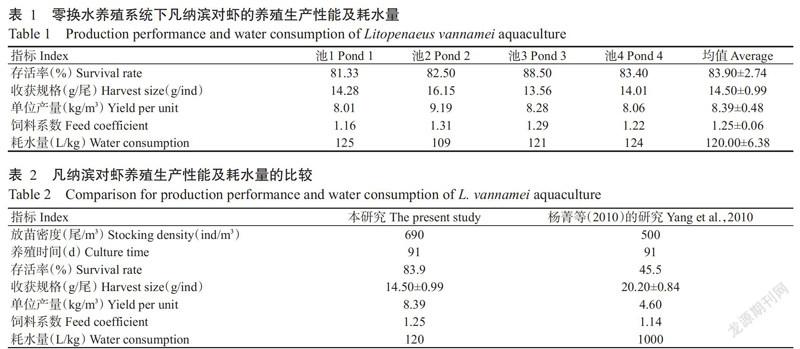
试验初始放养对虾虾苗密度为690尾/m3,经13周(91 d)的零换水系统养殖后,对虾平均存活率为(83.90±2.74)%,收获规格平均为14.50±0.99 g/尾,单位水体对虾产量平均为8.39±0.48 kg/m3,饲料系数平均为1.25±0.06,养殖对虾单产平均耗水量为120.00±6.38 L/kg(表1)。与杨菁等(2010)报道的对虾工程化循环水养殖试验结果相比,本研究的总体养殖效果良好,尤其是在养殖全程零换水的条件下,养成对虾单位产量耗水量明显降低,有效提升水资源的利用效率(表2)。
2. 2 主要水质指标的变动趋势
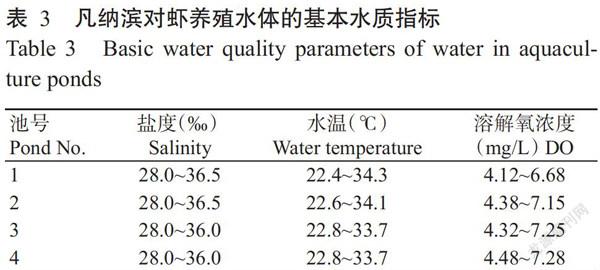
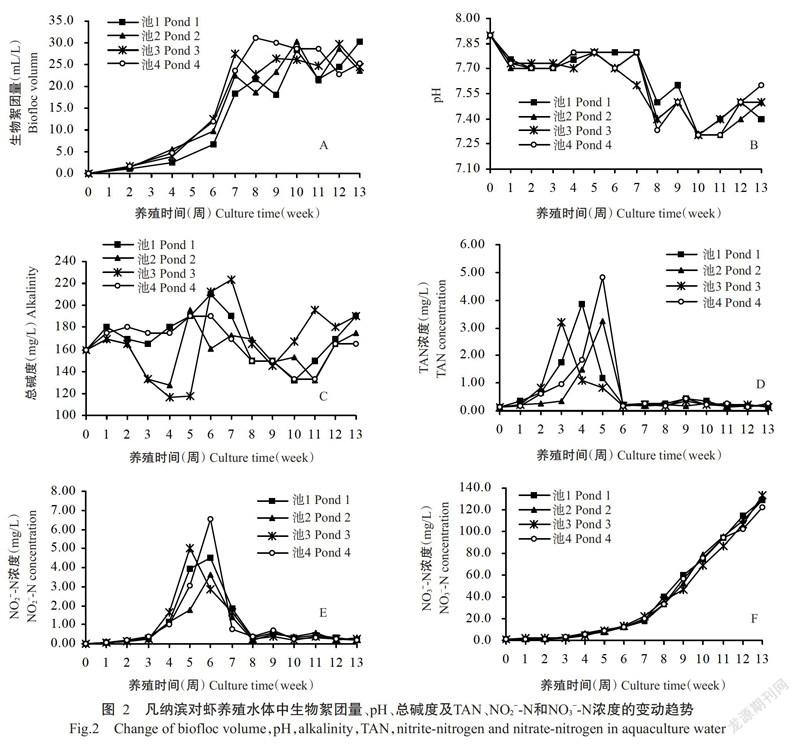
养殖期间,各试验池水体的盐度、水温及溶解氧浓度变动范围如表3所示,均可满足凡纳滨对虾健康生长的需求。各试验池水体中生物絮团量在前期呈逐渐上升趋势,从第7周起维持在18.2~30.4 mL/L(图2-A);pH整体上呈逐渐下降趋势,至7周后基本维持在7.31~7.60(图2-B);总碱度在116~224 mg/L范围内波动变化(图2-C);TAN浓度在6周前均呈先上升后下降的变化趋势,分别于第3~5周时相继出现峰值,最高值为4.80 mg/L,至第6周时均降低至0.45 mg/L以下,并保持至试验结束(图2-D);NO2−-N浓度在前2周时相对较低,随后呈逐渐上升趋势,于第5~6周时相继出现峰值,最高达6.55 mg/L,此后大幅下降,至第8周时相继降低至0.70 mg/L以下,并保持至试验结束(图2-E);NO3−-N浓度在前4周相对较低,于第5周开始持续升高,至试验结束时接近135.0 mg/L(图2-F)。
2. 3 养殖水体中异养细菌和弧菌的数量变动规律
养殖期间,养殖水体中的异养细菌数量在第3~5周时不断升高至×107 CFU/mL的数量级水平,之后逐渐下降,从第9周后一直维持在×106 CFU/mL的数量级水平(图3-A);养殖水体中的弧菌数量在第3~5周时升高至×104 CFU/mL的数量级水平,从第6~7周起呈大幅下降趋势,第7周后一直维持在×102 CFU/mL的数量级水平(图3-B)。
3 讨论
3. 1 凡纳滨对虾高密度零换水养殖的可行性分析
Zhao等(2012)通过106 d的零换水生物絮团应用养殖试验,证实生物絮团在高集约化、零换水养殖系统中的应用效果良好;Rego等(2017)、Maciel等(2018)研究报道,在对虾养殖生产中引进生物絮团技术后,对虾生长快、产量高、效益好。本研究进行13周的凡纳滨对虾高密度零换水养殖,收获对虾规格平均为14.50±0.99 g/尾,单位水体对虾产量平均为8.39±0.48 kg/m3,对虾生长速度不低于传统池塘的精养模式,对虾平均成活率为(83.90±2.74)%,与Reid和Arnold(1992)的研究结果较接近,但略低于国内其他学者(徐纪萍等,2012;索建杰等,2015)的相关报道;养殖对虾单产平均耗水量为120.00±6.38 L/kg,全程零换水,总体效果优于国内的已有研究报道(徐如卫等,2015),用水量远低于工厂化循环水养殖系统模式(Timmons and Ebeling,2006;杨菁等,2010)。养殖期间,水体TAN和NO2−-N浓度在第3~6周相继出现峰值,分别达4.80和6.55 mg/L,但随后大幅下降并保持至試验结束,与李晓梅和郭体环(2017)的研究结果相似。Furtado等(2015)研究指出,在盐度为23‰且零换水的养殖条件下,即使水体中的NO3−-N浓度达177.0 mg/L也不会对凡纳滨对虾的健康养殖产生明显影响。此外,生物絮团中含有的益生菌及生物活性多糖类物质可增强对虾免疫力(孙振等,2013;Xu and Pan,2013)。可见,在海水条件下进行凡纳滨对虾高密度零换水养殖具有可行性,尤其是基于该技术模式的零换水养殖管理,可大幅提升水资源利用效率,有效减轻养殖生产对水域环境的潜在负面影响。
3. 2 养殖水质原位调控技术的重要环节
养殖前期通过添加一定量的碳源,可有效促进功能菌团生长(Avnimelech,1999;邓吉朋等,2014;Xu et al.,2016;Deb et al.,2017),调节养殖水体C/N,而有利于生物絮团形成(Xu and Pan,2014;万国强等,2015)。本研究前期按菌浓度103 CFU/L分别在池水中添加芽孢杆菌、光合细菌及硝化菌,同时添加5 g/m3红糖用于益生菌培养;在放苗后30 d内每天按饲料投喂量的50%补充投入红糖,同时接入实验室驯化培养的硝化菌,待水体形成以硝化菌团为优势的生物絮团后逐步停止添加红糖。结果显示,养殖期间水体中生物絮团量在前7周逐渐上升,之后保持在相对稳定的水平上;同时,养殖期间水体中的异养细菌和弧菌数量变化趋势基本一致,在第4~5周内相继出现峰值,随后大幅下降,与水体中TAN和NO2−-N浓度的变动趋势基本吻合。说明在调节水体C/N的同时通过添加特定功能的微生物,有利于对水体菌群生态功能进行定向诱导。
随着生物絮团量的增加,养殖水体pH和总碱度逐渐下降,主要是微生物的硝化效应过程所致(郑春华等,2017)。陈旭良等(2006)研究表明,以Na2CO3调节水体总碱度的效果优于NaOH。王大鹏等(2014)研究指出,加强养殖水体pH和总碱度调节有利于微生物和凡纳滨对虾的生长。为此,本研究通过添加Na2CO3溶液和生石灰水以调节水体pH和总碱度,并辅以沉淀桶将水中的生物絮团浓度数量稳定控制在15~20 mL/L,旨在为水体中的微生物和养殖对虾提供相对稳定的水质条件。邓应能等(2012)将生物絮团技术应用于凡纳滨对虾试验性封闭养殖系统中,在84 d的养殖期内养殖水体TAN和NO2−-N浓度均维持在较低水平,对虾存活率则在80%以上。索建杰等(2015)通过对比常规换水、循环水和生物絮团3种凡纳滨对虾养殖模式下其水质指标的变化规律及凡纳滨对虾的存活与生长情况,也发现以生物絮团养殖模式的效果最优。可见,在养殖水体中构建和培育以优势功能菌群为核心的水质原位调控技术,不仅能保障养殖水质满足养殖生物健康生长的需求,还可实现养殖全程零换水的目标。
3. 3 对虾零换水高效健康养殖模式的优势
对虾零换水高效健康养殖模式的优势主要表现为:(1)实现养殖全程零换水,与传统池塘养殖的大量及频繁换水相比,可有效调控养殖水质,提高水资源利用效率。(2)可有效减少养殖对虾病害暴发,提高养殖效益。由于养殖全程零换水,可避免通过换水引入外来病原的风险;且生物絮团技术可有效抑制有害病原菌的生长繁殖,部分益生菌团还能分泌特定的抑菌因子如细菌素、溶菌酶等而抑制致病微生物(Verschuere et al.,2000)。(3)提高饲料蛋白利用率,降低养殖成本。投喂的饲料一部分被养殖对虾利用,还有部分残留在水体中或通过代谢效应进入养殖环境中,生物絮团中的微生物对其碳水化合物和氮素进行转换利用,形成菌体蛋白再被养殖对虾摄食利用(Epp et al.,2002;Abreu et al.,2007),从而实现养殖环境系统中物质的高效利用,同时降低饲料系数及提高养殖综合效益。(4)水体中的生物絮团有利于增强养殖对虾的消化吸收及抗病能力(Xu and Pan,2012;Sajali et al.,2019)。Suita等(2015)对在零换水系统中的对虾肝胰腺发育及生理状态进行分析,发现与常规生产系统相比,生物絮团零换水养殖系统更有利于促进对虾肝胰腺的正常发育,进而增强其生理功能;Cardona等(2016)研究发现,生物絮团零换水养殖系统中的对虾肠道细菌群落与换水养殖系统中的存在显著差异;陈文斌等(2017)研究表明,生物絮团中的功能菌株不仅能高效降解水体TAN和NO2−-N,还可抑制部分致病弧菌的生长,显著提高对虾的生长发育、免疫防御能力及饲料利用率。
4 结论
科学运用生物絮团技术对养殖水质进行原位调控,可实现凡纳滨对虾高密度零换水的高效健康养殖,还可有效提高水资源的利用效率,有助于推动对虾养殖产业的绿色健康发展。
参考文献:
曹伏龙,夏丽华,郭治兴,冯海媛. 2015. 海水养殖污染研究进展[J]. 广东农业科学,42(22):97-105. [Cao F L,Xia L H,Guo Z X,Feng H Y. 2015. Advances in mariculture contamination[J]. Guangdong Agricultural Sciences,42(22):97-105.]
曹煜成,李卓佳,贾晓平,文国樑,李纯厚. 2006. 对虾工厂化养殖的系统结构[J]. 南方水产,2(3):72-76. [Cao Y C,Li Z J,Jia X P,Wen G L,Li C H. 2006. System configuration of industrial shrimp farming[J]. South China Fisheries Science,2(3):72-76.]
陈文斌,潘鲁青,黄飞. 2017. 对虾生物絮团中亚硝态氮降解菌分离鉴定与安全性评价[J]. 海洋湖沼通报,(3):121-129. [Chen W B,Pan L Q,Huang F. 2017. Isolation,identification and safety evaluation of efficient nitrite-N degradation strain from biofloc-based shrimp culture ponds[J]. Transactions of Oceanology and Limnology,(3):121-129.]
陳旭良,蔡靖,郑平,周尚兴,丁革胜. 2006. 硝化系统碱度特征与调控对策的研究[J]. 浙江大学学报(农业与生命科学版),32(3):318-322. [Chen X L,Cai J,Zheng P,Zhou S X,Ding G S. 2006. Alkalinity characteristics and control strategy in nitrification system[J]. Journal of Zhejiang University(Agriculture & Life Sciences),32(3):318-322.]
邓吉朋,黄建华,江世贵,李涛,杨其彬,周发林,邱丽华. 2014. 生物絮团在斑节对虾养殖系统中的形成条件及作用效果[J]. 南方水产科学,10(3):29-37. [Deng J P,Huang J H,Jiang S G,Li T,Yang Q B,Zhou F L,Qiu L H. 2014. Conditions for bio-floc formation and its effects on Penaeus monodon culture system[J]. South China Fishe-ries Science,10(3):29-37.]
邓应能,赵培,孙运忠,杨丛海,黄倢. 2012. 生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果[J]. 渔业科学进展,33(2):69-75. [Deng Y N,Zhao P,Sun Y Z,Yang C H,Huang J. 2012. Conditions for bio-floc formation and its effects in closed culture system of Litopenaeus vannamei[J]. Progress in Fishery Sciences,33(2):69-75.]
李奕雯,徐武杰. 2016. 生物絮团零换水养虾模式[J]. 海洋与渔业,(1):46-47. [Li Y W,Xu W J. 2016. Biofloc-based zero water exchange shrimp culture model[J]. Ocean and Fishery,(1):46-47.]
李晓梅,郭体环. 2017. 生物絮团对凡纳滨对虾养殖过程中氨氮和亚硝酸氮含量的影响[J]. 渔业研究,39(4):283-286. [Li X M,Guo T H. 2017. Impact of biological floc on ammonia nitrogen and nitrite nitrogen content in the process of Litopenaeus vannamei culture[J]. Journal of Fishe-ries Research,39(4):283-286.]
刘晃,张宇雷,吴凡,倪琦,徐皓. 2009. 美国工厂化循环水养殖系统研究[J]. 农业开发与装备,(5):10-13. [Liu H,Zhang Y L,Wu F,Ni Q,Xu H. 2009. Study on recircula-ting aquaculture systems in USA[J]. Agricultural Deve-lopment and Equipments,(5):10-13.]
刘鹰,杨红生,刘石林,游奎,张福绥. 2005. 封闭循环系统对虾合理养殖密度的试验研究[J]. 农业工程学报,21(6):122-125. [Liu Y,Yang H S,Liu S L,You K,Zhang F S. 2005. Experimental study on the appropriate breeding density for the production of prawn in closed-recirculating system[J]. Transactions of the Chinese Society of Agricultural Engineering,21(6):122-125.]
羅亮,徐奇友,赵志刚,祖岫杰,闫有利,缴建华. 2013. 基于生物絮团技术的碳源添加对池塘养殖水质的影响[J]. 渔业现代化,40(3):19-24. [Luo L,Xu Q Y,Zhao Z G,Zu X J,Yan Y L,Jiao J H. 2013. Effect of the adding of carbon resource on water quality of pond aquaculture in bio-flocs technology[J]. Fishery Modernization,40(3):19-24.]
孟庆武,王圣,赵玉洁,朱建峰. 2008. 我国对虾工厂化养殖的特点、发展趋势及前景[J]. 海洋开发与管理,25(3):124-127. [Meng Q W,Wang S,Zhao Y J,Zhu J F. 2008. Characteristics, development trends and prospects of industrialized shrimp farming in China[J]. Ocean Development and Management,25(3):124-127.]
宿墨. 2017. 我国水产养殖产业供给侧改革的思考——推广工厂化循环水养殖技术的机遇与动力[J]. 中国水产,(1):40-44. [Su M. 2017. Reflections on the supply-side reform of aquaculture industry in China—Opportunities and motivation for promoting industrial recycling aquaculture technology[J]. China Fisheries,(1):40-44.]
孙振,王秀华,黄倢. 2013. 一种微生物絮团的生化分析及其对凡纳滨对虾免疫力的影响[J]. 水产学报,37(3):473-480. [Sun Z,Wang X H,Huang J. 2013. The biochemical analysis of a microbial floc and its effect on the immunity of Litopenaeus vannamei[J]. Journal of Fisheries of China,37(3):473-480.]
索建杰,王玉玮,姜玉声,李晓东,司永国,刘谞,吴俊,孙娜. 2015. 三种凡纳滨对虾养殖模式的水质特征及养殖效果[J]. 水产学杂志,28(5):12-17. [Suo J J,Wang Y W,Jiang Y S,Li X D,Si Y G,Liu X,Wu J,Sun N. 2015. Characterization of water quality and growth performance of pacific white leg shrimp Litopenaeus vannamei reared in three culture systems[J]. Chinese Journal of Fis-heries,28(5):12-17.]
万国强,陈文斌,潘鲁青. 2015. 不同C/N对生物絮团形成和凡纳滨对虾生长、养殖效果的影响[J]. 齐鲁渔业,32(9):1-4. [Wan G Q,Chen W B,Pan L Q. 2015. Effects of different C/N ratios on bioflocculation and growth and culture of Litopenaeus vannamei[J]. Shandong Fisheries,32(9):1-4.]
王大鹏,何安尤,韩耀全,施军,陈晓汉. 2014. 碱度调节对凡纳滨对虾室内高密度养殖固定化微生物处理效果的影响[J]. 中国水产科学,21(2):330-339. [Wang D P,He A Y,Han Y Q,Shi J,Chen X H. 2014. Alkalinity-regula-ting effect of immobilized microorganisms on indoor high-density culture of Litopenaeus vannamei[J]. Journal of Fishery Sciences of China,21(2):330-339.]
文国樑,曹煜成,徐煜,胡晓娟,徐武杰,李卓佳. 2015. 养殖对虾肝胰腺坏死综合症研究进展[J]. 广东农业科学,42(11):118-123. [Wen G L,Cao Y C,Xu Y,Hu X J,Xu W J,Li Z J. 2015. Review on hepatopancreas necrosis syndrome of shrimp[J]. Guangdong Agricultural Sciences,42(11):118-123.]
徐纪萍,谈小兰,钱辉仁. 2012. 凡纳滨对虾高密度零换水高产养殖技术[J]. 水产科技情报,39(1):26-29. [Xu J P,Tan X L,Qian H R. 2012. High-density aquaculture technology of Litopenaeus vannamei in the zero-water exchange system[J]. Fisheries Science & Technology Information,39(1):26-29.]
徐如卫,杨福生,俞奇力,陈菲,王亚妮. 2015. 凡纳滨对虾循环水养殖可行性研究[J]. 河北渔业,(3):25-28. [Xu R W,Yang F S,Yu Q L,Chen F,Wang Y N. 2015. Feasibility study on recirculating aquaculture of Litopenaeus vannamei[J]. Hebei Fisheries,(3):25-28.]
杨菁,倪琦,张宇雷,徐宝荣. 2010. 对虾工程化循环水养殖系统构建技术[J]. 农业工程学报,26(8):136-140. [Yang J,Ni Q,Zhang Y L,Xu B R. 2010. Construction technology on RAS for shrimp culture[J]. Transactions of the Chinese Society of Agricultural Engineering,26(8):136-140.]
張庆文,田景波,黄滨,唐贤明. 2002. 对虾封闭循环式综合养殖系统的规划设计[J]. 海洋水产研究,23(4):29-34. [Zhang Q W,Tian J B,Huang B,Tang X M. 2002. The design of experimental base of shrimp in comprehensive culturing and circulating-closed systems[J]. Marine Fishe-ries Research,23(4):29-34.]
赵大虎,潘鲁青,王超. 2014. 生物絮团对养殖环境的清洁作用及对虾生理指标的影响[J]. 海洋湖沼通报,(1):67-73. [Zhao D H,Pan L Q,Wang C. 2014. Effects of biofloc on the breeding environment cleanings and shrimp physiological indicators[J]. Transactions of Oceanology and Limnology,(1):67-73.]
郑春华,耿安锋,李金国. 2017. 碱度对生物脱氮工艺的影响及其调控[J]. 中国给水排水,33(10):34-36. [Zheng C H,Geng A F,Li J G. 2017. Role and control of alkalinity in the process for biological nitrogen removal[J]. China Water & Wastewater,33(10):34-36.]
Abreu P C,Ballester E L C,Odebrecht C,Jr W W,Cavalli R O,Graneli W,Anesio A M. 2007. Importance of biofilm as food source for shrimp(Farfantepenaeus paulensis) eva-luated by stable isotopes(δ13C and δ15N)[J]. Journal of Experimental Marine Biology and Ecology,347(1-2):88-96.
Avnimelech Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture systems[J]. Aquaculture,176(3-4):227-235.
Avnimelech Y. 2015. Biofloc technology-A practical guide book[M]. The 3rd Edition. Baton Rouge:The World Aquaculture Society.
Azim M E,Little D C. 2008. The biofloc technology(BFT) in indoor tanks:Water quality,biofloc composition,and growth and welfare of Nile tilapia(Oreochromis niloticus)[J]. Aquaculture,283(1-4):29-35.
Cao Y C,Wen G L,Li Z J,Liu X Z,Hu X J,Zhang J S,He J G. 2014. The effects of dominant microalgae species and bacterial quantity on shrimp production in final culture season[J]. Journal of Applied Phycology,26(4):1749-1757.
Cardona E,Gueguen Y,Magré K,Lorgeoux B,Piquemal D,Pierrat F,Noguier F,Saulnier D. 2016. Bacterial community characterization of water and intestine of the shrimp Litopenaeus stylirostris in a biofloc system[J]. BMC Microbiology,16:157.
Crab R,Avnimelech Y,Defoirdt T,Bossier P,Verstraete W. 2007. Nitrogen removal techniques in aquaculture for a sustainable production[J]. Aquaculture,270(1-4):1-14.
Deb S,Noori M T,Rao S P. 2017. Experimental study to eva-luate the efficacy of locally available waste carbon sources on aquaculture water quality management using biofloc technology[J]. Aquaculture International,25(6):2149-2159.
Epp M A,Ziemann D A,Schell D M. 2002. Carbon and nitrogen dynamics in zero-water exchange shrimp culture as indicated by stable isotope tracers[J]. Aquaculture Research,33(11):839-846.
Furtado P S,Campos B R,Serra F P,Klosterhoff M,Romano L A,Jr W W. 2015. Effects of nitrate toxicity in the Paci-fic white shrimp,Litopenaeus vannamei, reared with biofloc technology(BFT)[J]. Aquaculture International,23(1):315-327.
Hari B,Kurup M B,Varghese J T,Schrama J W,Verdegem M C J. 2006. The effect of carbohydrate addition on water quality and the nitrogen budget in extensive shrimp culture systems[J]. Aquaculture,252(2-4):248-263.
Maciel J C,Francisco C J,Miranda-Filho K C. 2018. Compensatory growth and feed restriction in marine shrimp production,with emphasis on biofloc technology[J]. Aquaculture International,26(1):203-212.
Rego M A S,Sabbag O J,Soares R,Peixoto S. 2017. Risk analysis of the insertion of biofloc technology in a marine shrimp Litopenaeus vannamei production in a farm in Pernambuco,Brazil:A case study[J]. Aquaculture,469:67-71.
Reid B,Arnold C R. 1992. The intensive culture of the penaeid shrimp Penaeus vannamei boone in a recirculating raceway system[J]. Journal of the World Aquaculture Society,23(2):146-153.
Sajali U S B A,Atkinson N L,Desbois A P,Little D C,Murray F J,Shinn A P. 2019. Prophylactic properties of biofloc or Nile tilapia-conditioned water against Vibrio parahaemolyticus infection of whiteleg shrimp(Penaeus vannamei)[J]. Aquaculture,498:496-502.
Suita S M,Cardozo A P,Romano L A,Abreu P C,Jr W W. 2015. Development of the hepatopancreas and quality analysis of post-larvae Pacific white shrimp Litopenaeus vannamei produced in a BFT system[J]. Aquaculture International,23(2):449-463.
Timmons M B,Ebeling J M. 2006. The role for recirculating aquaculture systems(RAS).I.[J]. Aquaculture Magazine,32(3):26-31.
Verschuere L,Rombaut G,Sorgeloos P,Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaculture[J]. Microbiology and Molecular Biology Reviews,64(4):655-671.
Xu W J,Pan L Q. 2012. Effects of bioflocs on growth performance,digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed[J]. Aquaculture,356-357:147-152.
Xu W J,Pan L Q. 2013. Enhancement of immune response and antioxidant status of Litopenaeus vannamei juvenile in biofloc-based culture tanks manipulating high C/N ratio of feed input[J]. Aquaculture,412-413:117-124.
Xu W J,Pan L Q. 2014. Dietary protein level and C/N ratio manipulation in zero-exchange culture of Litopenaeus vannamei:Evaluation of inorganic nitrogen control,biofloc composition and shrimp performance[J]. Aquaculture Research,45(11):1842-1851.
Xu W J,Pan L Q,Sun X H,Huang J. 2013. Effects of bioflocs on water quality,and survival,growth and digestive enzyme activities of Litopenaeus vannamei(Boone) in zero-water exchange culture tanks[J]. Aquaculture Research,44(7):1093-1102.
Xu W J,Morris T C,Samocha T M. 2016. Effects of C/N ratio on biofloc development,water quality,and performance of Litopenaeus vannamei juveniles in a biofloc-based,high-density,zero-exchange,outdoor tank system[J]. Aquaculture,453:169-175.
Zhao P,Huang J,Wang X H,Song X L,Yang C H,Zhang X G,Wang G C. 2012. The application of bioflocs technology in high-intensive,zero exchange farming systems of Marsupenaeus japonicas[J]. Aquaculture,354-355:97-106.
(責任编辑 兰宗宝)

