食品中硒的总量及化学形态分析研究进展
赵谋明 郑泽洋 刘小玲

摘要:硒是生物體内必需的微量元素,其毒性和生物活性与化学形态相关,文章结合国内外研究情况从食品中总硒的测定和硒化学形态分析两个方面进行综述。在总硒测定方法中,采用超声辅助提取总硒,并以原子吸收作为检测器时,方法的灵敏度高,检测限低;而在硒化学形态分析中,固相萃取是效率高、准确性高、应用范围广的提取方法,结合气相色谱—质谱联用法(GC-MS)进行测定硒化物含量时,方法的检测限较低。由于其他形态的硒含量低或结构复杂,难以从基质中分离鉴定,目前主要关注5种形态的硒[Se(VI)、Se(IV)、SeMet、SeCys和Se-MeSeCys],且存在总硒测定和硒形态分析的过程均耗时较长等问题,因此今后需关注更多未知形态的硒,以便更好地利用硒,并开发绿色快速提取、分离及检测一体化的自动化检测技术。
关键词: 硒;含量;形态分析;预处理;检测技术
中图分类号: S-03;TS201.4 文献标志码: A 文章编号:2095-1191(2019)12-2787-10
Total content determination and chemical speciation analysis of selenium in food: A review
ZHAO Mou-ming1,2, ZHENG Ze-yang1, LIU Xiao-ling1,3*
(1College of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China; 2College of Food Science and Engineering, South China University of Technology, Guangzhou 510640, China; 3Guangxi Buffalo Milk Engineering and Technology Center, Nanning 530004, China)
Abstract:Selenium is an essential trace element in organisms, whose toxicity and biological activity are related to its morphology. This article reviewed the two aspects of the determination of total selenium and selenium chemical speciation analysis in food from home and abroad. In case of total selenium determination, the determination method with high sensitivity and low detection limit is consisted of ultrasound-assisted extraction as a extraction way and the atomic absorption as a detector. While in case of selenium speciation analysis, solid-phase extraction is an efficient, accurate and popular way to extraction the selenium speciation. After that, used the gas cromatography-mass spectrometry(GC-MS) as the detector would obtain the lower detection limit in all methods. Due to the low content and complex structure of selenium compounds, it is difficult to separate and identify them from the matrix. And five forms of selenium are mainly concerned now[Se(VI), Se(IV), SeMet, SeCys and Se-MeSeCys]. Moreover, it has spending a long time in the process of total selenium determination and selenium form analysis. To resolve these problems, firstly, the researchers should pay attention to find more unknown selenium compounds in order to make better use of them; secondly, researchers should develop an integrated detection technology of green and fast extraction, separation and detection.
Key words: selenium; content; speciation analysis; pretreatment; detection technology
0 引言
1817年一种有毒的微量元素硒(Se)被瑞典化学家Berzelius发现。1973年联合国世界卫生组织宣布硒是生物体中必需的、不可缺少的营养元素之一。诸多研究已表明,在不同物种中,硒扮演着一个重要角色,参与许多生命基础代谢(Donovan and Copeland,2010;Mariotti et al.,2012)。在机体中,硒通过掺入到蛋白质中构成硒蛋白,具有避免细胞膜过度氧化(夏弈明,2011)、抗氧化(Steinbrenner and Sies,2009)、提高免疫力(Hoffmann et al.,2010)和预防脑部疾病(帕金森病、阿尔兹海默病和癫痫等)发生(Naziroglu,2009;Cardoso et al.,2015;Solovyev,2015)等多种生物学功能。但硒的安全摄入剂量范围窄,摄入过量会引起硒中毒,摄入量不足则会导致“克山病”的发生,2013版《中国居民膳食营养素参考摄入量》中推荐成人对硒的摄入量为60 μg/d(程义勇,2014),美国国家科学院医学研究所规定成人每天对硒的最大摄入量不超过400 μg(Boyd,2011)。
硒在自然界存在的形态包括Se(VI)、Se(IV)、Se(0)和Se(-II),其中无机硒包括亚硒酸盐(HSeO3- 和SeO32-)和硒酸盐(SeO42-)等,而通过生物转化与氨基酸等物质结合而成的有机硒包括硒代氨基酸[硒代蛋氨酸(SeMet)和硒代半胱氨酸(SeCys)]、各种硒蛋白和硒多糖等。硒与人体内的多种疾病相关(Rayman,2012),目前我国除硒中毒区(在湖北省恩施州成人硒摄入量高达4990 μg/d)以外的大部分地区成人硒摄入量均显著低于推荐摄入量60 μg/d(袁丽君等,2016),即缺硒现状较普遍。现有的硒强化剂分为无机硒强化剂和有机硒强化剂,其中无机硒的毒性较大(Saygi et al.,2007;Tuzen et al.,2007;Rao et al.,2010;Chen et al.,2015),生物利用率低,大多发达国家已禁止使用无机硒强化剂,但在严重缺硒时无机硒可快速提高人体内硒含量,长期食用则存在较高的毒性风险(Thiry et al.,2012);以富硒酵母和硒蛋白为代表的有机硒强化剂与无机硒强化剂相比,毒性低,生物利用率和安全性高。研究表明,硒在人体中主要以硒蛋白的形式发挥作用,特别是以SeMet形式存在的有机硒能更有效地防止硒缺乏(Thiry et al.,2012)。硒的形态直接关系到食品中硒的安全性、生物利用率等,为此,本文重点综述食品中硒的总含量测定及形态分析的预处理和检测方法,以期为食品中硒强化剂的开发利用提供参考。
1 总硒的测定
1. 1 预处理方法
1. 1. 1 湿法消解 湿法消解的消化液常用硝酸(HNO3)和高氯酸(HClO4)。单独使用HNO3作消化液时结果通常偏低,其原因有两方面:一是在消化期间由于食品高温碳化导致硒损失;二是消解后硒形态不满足测定需求的硒形態[一般为Se(IV)]。湿法消解能完全将硒转化为无机形式,但其耗时较长,通常需要过夜消解,且消解过程会使大量的酸挥发,实验室污染严重。
1. 1. 2 微波消解 微波消解中常用硝酸—过氧化氢(HNO3-H2O2)作为消化液,其中H2O2主要起到加快反应速度及氧化脱色的作用。单独使用HNO3消解,溶液呈黄色透明,而加入H2O2后,由于H2O2受热分解,增大管内压力从而加快反应速率,溶液最终呈无色透明。对于一些简单的样品(水或成分较简单的饮料),可直接加入盐酸(HCl)将Se(VI)还原为Se(IV),直接测定其总硒含量(Tuzen and Pekiner,2015)。与常规的湿法消解相比,微波消解因其控温、密闭,具有硒损失率低、耗时短、试剂用量少及自动化等优点,常用于食品中总硒的测定。但在消解过程中不能将所有的硒转化为Se(IV),需加入还原剂将Se(VI)还原为Se(IV),通常选用HCl作为还原剂,特别是用原子荧光光谱法(AFS)进行检测时,其他还原剂(盐酸羟胺和尿素)可能会形成硒的氮氧化物,而影响测定结果(Garcia et al.,2005)。
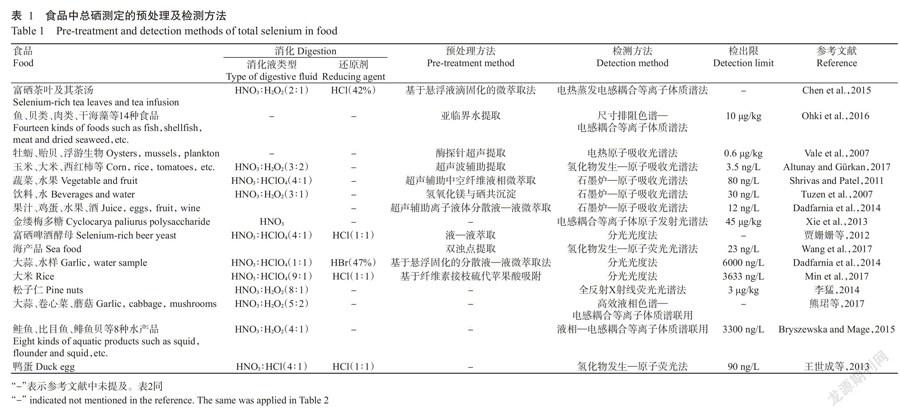
1. 1. 3 其他方法 与传统的消解方法相比,一些新兴总硒提取方法的试剂用量减少,条件温和,且显著降低提取过程中硒的损失,提高准确性。Tuzen等(2007)利用氢氧化镁与Se(IV)形成共沉淀,测定经酸处理后水样和饮料中的总硒含量,该方法适用于成分简单的样品。Vale等(2007)开发了一种快速、可重复的酶探针超声萃取方法,成功从牡蛎、贻贝和浮游生物中萃取总硒,其结果与微波消解的结果无显著差异,提取时间极短,条件温和(室温,pH 7.5),有效防止硒元素损失,减少酸碱试剂使用;但该方法使用的是蛋白酶XIV,不适用于提取以碳水化合物为主的食品中的硒,且在提取过程中要稳定酶活性。这些方法与传统的消解方法相比,较少使用酸碱试剂,绿色环保,且能有效减少硒的损失,提高方法的准确性。Shrivas和Patel(2011)使用超声辅助中空纤维液相微萃取法测定蔬菜和水果中总硒含量,样品经酸处理后pH调至0.8~3.0,加入到中空纤维中,然后在超声辅助下用N-辛基乙酰胺洗脱,15 min即可完成硒提取;结果发现提取过程几乎不受样品基质的影响,能简单快速提取复杂生物体中的Se(IV),且检测限(80 ng/L)比超声辅助固相萃取(100 ng/L)低;其缺点是不能提取Se(VI),总硒的提取需加入还原剂将Se(VI)还原为Se(IV)。Ohki等(2016)在220 ℃下用亚临界水处理14种食物样品(包括鱼、贝类、肉类和干海藻等),从中提取总硒并对其含量进行测定,结果与微波消解测量结果一致;该方法仅使用水,不使用强酸或酶,提取速度快,仪器成本低,操作简单。Altunay和Gürkan(2017)用酸处理多种海产品(鲑鱼、虾和吞拿鱼等)及农产品(大米、西红柿和蘑菇等)后,使用超声波辅助提取方法提取总硒,该方法10 min即可将Se(IV)与非离子表面活性剂形成复合物从水相转移至表面,该过程无需热处理,减少了硒的损失;测定结果与标准参考材料相比无显著差异,方法回收率为95%~103%,该提取方法有望代替传统的消解方法。超声辅助提取及富集纯化能有效提高硒提取率,减少硒损失,有望在食品中硒提取液富集纯化中广泛应用。
1. 2 检测技术
根据检测技术的不同,经过消解的样品可直接进行总硒测定或将游离状态的Se预浓缩后再进行检测。AFS、电感耦合等离子体质谱法(ICP-MS)和原子吸收光谱法(AAS)等方法操作简单,检测速度快,检出限低,适合超痕量硒的样品检测,但仪器价格昂贵。其中,氢化物发生—原子吸收法(HG-AAS)可快速从食品基质中将硒分离出来,避免其他物质的干扰,是测定硒元素最常见的方法之一(马作江等,2011),其原理是在酸性介质中,用硼氢化钠将Se(VI)还原为挥发性的Se2H,通过载气将氢化物蒸气导入加热的T形石英管中,Se2H受热后迅速分解,将硒离解为基态原子蒸气,从而吸收该元素的特征发射信号。与HG-AAS相比,石墨炉—原子吸收法(GF-AAS)具有相近的检测灵敏度,但基体干扰和灰化导致硒损失较严重,因此消除基体干扰和选择最佳条件是保证测定结果可靠性的关键。其中,Rybínová等(2016)利用紫外催化Se(VI)迅速转化成挥发性硒物质(2 min内),然后直接进入原子吸收光谱检测器中进行检测,该方法未使用高纯硼氢化钠和HCl,能源洁净且检测限低(27~102 ng/L),是一种有望应用于测定食品中总硒含量的方法。
在食品中硒含量的测定中,GB 5009.93—2017《食品安全国家标准 食品中硒的测定》在旧国标的基础上增加了ICP-MS为第三法,与两种分光光度法和电感耦合等离子体发射光谱法(ICP-OES)相比,具有更快速、灵敏、试剂毒性低等优点。其原理是在酸性环境下将样品以水溶液的气溶胶形式引入氩气流中,然后进入氩等离子体中心区,等离子体的高温使得样品去溶剂化、汽化、解离和电离,通过质谱仪分离及检测质分析样品中的硒。王莹等(2009)在测定富硒蛹虫草菌丝体中硒含量时,对比了ICP-MS、高效液相色谱—荧光法和3,3-二氨基联苯胺分光光度法3种方法,测定结果相似,检测线分别为0.18、0.26和10.49 μg/L,其中高效液相色谱—荧光法和ICP-MS的灵敏度较高,但ICP-MS具有更广的线性范围(1.0~500.0 μg/L),适用范围广。ICP-MS已发展成为现今最普遍的总硒检测方法之一,但具体的检测方法可根据试验条件及样品的硒含量进行选择。
可见分光光度法与荧光分光光度法测定总硒时,需将游离态的硒与带有生色基团的物质反应,常用显色剂分别为3,3-二氨基联苯胺(DAB)和2,3-二氨基萘(DAN),在特定波长下测定生成物吸光值或荧光强度(邹涛等,2011;Dadfarnia et al.,2014)。这两种方法检测的线性范围广,重现性好,仪器价格便宜,已得到广泛应用,但前处理操作过程复杂,需用到有毒试剂,空白干扰较大,需除去试剂中的荧光物质,且检测灵敏度低,不适用于痕量硒的检测(王莹等,2009;贾姗姗等,2012)。近年来,中子活化分析(Zembrzuska et al.,2014)、能量色散X射线分子荧光色谱(Li and Yu,2016)和尺寸排阻色谱—电感耦合等离子体质谱法(Ohki et al.,2016)等方法在食品中總硒含量的测定中也得到应用。结合样品预处理方法和检测技术方法,预处理时使用超声辅助提取食品中总硒能有效提高方法的检测限,尤其是以原子吸收作为检测器时,与ICP-MS相比,具有更低的检出限,在3.5~80.0 ng/L范围内,可用于检测食品中痕量的硒元素。表1总结了食品中总硒含量测定的预处理方法及检测技术。
2 硒化学形态分析
2. 1 样品的预处理
样品预处理是硒形态分析中的关键步骤,样品经预处理后,必须保证硒形态不发生改变,且要防止硒的损失,以保证实验的准确性。样品的预处理过程包括对样品中硒化物的提取、浓缩及衍生等。对于含硒量极少的样品(水和饮料等),在测硒之前还需进行分离富集。在硒的形态分析中,不同食品的预处理方法如表2所示。
食品中常用于提取硒的方法包括液相萃取、液相微萃取和固相微萃取等(Dadfarnia et al.,2014;Min et al.,2017;Wang et al.,2017)。在提取过程中,不同形态的硒很容易受到提取溶液或介质的影响而发生形态转变或损失,故准确获得食品中硒的形态及其含量的关键在于提取前后硒的形态不发生任何改变,同时要降低硒的损失率。从食品基质中提取不同形态的硒通常需要一步或多步萃取,一步萃取相对较简单,形态发生变化较小,但提取效率较低;而多步萃取可根据各种硒的形态特点采取不同的萃取方法,能显著提高样品的提取效率,但经过多步萃取后,很难保持样品中硒形态的完整性。
2. 1. 1 液相萃取 液相萃取主要包括水提、酸提、醇提和酶解提取等,单独使用液相萃取法萃取不同形态硒,提取率与效率通常较低,与一些辅助方法结合使用可提高提取效率,如微波消解技术、紫外光和超声波等。水提法是一种较简单的提取方法,用去离子水作为溶剂,为提高提取效率,da Silva等(2013)用超声辅助水提法从巴西坚果中提取SeMet和硒代胱氨酸(SeCys2)。酸提法是氨基酸分析中最常用的方法,但含硒氨基酸极不稳定,需通过温和条件进行提取,例如在50 ℃下使用4 mol/L HCl浸提50 h,经标准物质(BCR-414)验证,该提取方法的加标回收率为91%(da Silva et al.,2013),但提取时间较长。醇提常用于有机硒的测定,Rao等(2010)用75%乙醇提取啤酒酵母中游离的硒化物(特别是硒醇类物质)。酶解提取条件温和,不改变硒原本的形态,但其提取时间长,提取率不高,不能使不同形态的硒完全提取出来,还可能存在硒的形态转化。Bryszewska和Mage(2015)在磷酸缓冲液中使用蛋白酶XIV提取不同水产品中6种形态的硒[Se(IV)、Se(VI)、SeMet、硒甲基硒代半胱氨酸(Se-MeSeCys)、SeCys2和氧化硒代蛋氨酸(SeOMet)],与在37 ℃下用微波辅助蛋白酶XIV提取SeMet、Se-MeSeCys、Se(VI)和Se(IV)(Grijalba et al.,2017)相比,加标回收率相近(90%~108%)。还有采用超声辅助热水提取和蛋白酶XIV分步提取6种营养补充剂中6种形态的硒,将经热水提取后的残渣再进行酶解,A产品的SeMet含量是单一提取法的10倍,说明分步顺序提取可有效提高硒的提取率(Zembrzuska et al.,2014)。
2. 1. 2 液相微萃取(LPME) 液相微萃取是一种微型液相萃取方法,包括直接液相微萃取、顶空液相微萃取和分散液—液相微萃取等,特别适用于痕量的微量元素测定。Tuzen和Pekiner(2015)使用超声辅助离子液体—分散液—液相微萃取法测定了啤酒、牛奶、复合果汁、蜂蜜等10种食品中Se(IV)的含量,由于不涉及水与萃取剂相的界面,传质过程迅速,是一种快速、成本低、富集因子高、提取率高的萃取方法,而且离子液体还能改善色谱峰形和分辨率。悬浮液滴固化微萃取法是一种简单、快速、低成本、有机溶剂用量少和浓缩因子高的萃取方法,已被广泛用于微量元素分析。Chen等(2015)采用悬浮液滴固化微萃取法研究富硒茶叶中硒的种类[包括总硒、悬浮态、可溶态、有机态、Se(IV)及Se(VI)]和分布规律,该方法的富集因子为500,对硒具有很强的富集能力。浊点提取(CPE)是利用非离子表面活性剂在加热条件下形成胶束,与金属离子形成螯合物,进而从各种物质中提取痕量的金属离子。由于该提取方法简单,价格低廉,富集因子高,能保持萃取物质的原有结构,且溶剂对环境毒性较小,已成为常规溶剂萃取的替代品(Pytlakowska et al.,2013)。Wang等(2017)开发了双浊点萃取法程序对12种海产品中痕量水平的硒进行提取,与传统CPE相比,可消除表面活性剂在氢化物生成过程中的影响,并将Se(IV)-APDC转化为游离Se(IV),以增强荧光信号。
2. 1. 3 固相微萃取(SPME) 固相微萃取是一种无溶剂的萃取技术,基于待测样品在不同的萃取涂层中达到固—气或固—液相吸附或吸收平衡,从而将待测物质从基质中分离。按固定相吸附和富集样品中的待测物质,一般分为浸入式固相微萃取和顶空固相微萃取两种类型。浸入式固相微萃取适用于分析气体和液体样品中的非挥发性有机化合物,而顶空固相微萃取主要用于分析复杂基质中的挥发性和半挥发性有机化合物(张绿茵等,2012),如二甲基硒(DMSe)和二甲基二硒醚(DMDSe)。然而,大多数水溶性硒物种不能直接使用固相微萃取,需利用衍生剂将其转化成挥发性硒化物进行萃取。Gionfriddo等(2012)用氯甲酸烷基酯作衍生剂,测定了富硒马铃薯提取液中的SeMet和Se-MeSeCys含量;该衍生反应是在室温水溶液中进行,效率高、操作简便,这两种硒化物的回收率为82.3%~116.3%。搅拌棒吸附萃取是一种新型的固相微萃取技术,具有固定相体积大,萃取容量高,无需外加搅拌子,可避免竞争性吸附,能自身搅拌的同时实现萃取富集等优点(许志刚等,2011),该技术已广泛用于食品样品分析的预处理。
2. 2 硒化学形态分析的检测方法
通过不同的预处理方法,可从食品中获取不同形态的硒化物,通常多种形态的硒会同时存在,在检测前需对其进行分离。常用的分离方法有高效液相色谱(HPLC)、阴离子交换色谱、离子色谱(IC)、毛细管电泳色谱(CE)和气相色谱(GC)等,常与ICP-MS、AFS和AAS等检测方法联用。质谱联用技术可直接提供硒的形态信息,且灵敏度高、分析速度快,是未来形态分析的发展方向。表2总结了不同食品样品中硒的形态分析方法。
2. 2. 1 高效液相色谱—电感耦合离子体质谱联用法(HPLC-ICP-MS) HPLC是硒形态分析中最常用的分离方法,常与ICP-MS和MS检测器联用,而HPLC-ICP-MS联用技术与HPLC-MS相比,具有更低的检出限,更高的灵敏度(Zembrzuska et al.,2014),但由于硒的第一电离能较高(I1=9.75 eV),使得离子化效率相对较低;且存在多种多原子离子的干扰,如40Ar36Ar+对76Se、40A38Ar+对78Se、40Ar37Ar+对77Se、
37Cl37Cl+对74Se及81Br1H82Se等(邱建华等,2006),降低了ICP-MS的灵敏度与准确性。阴离子交换色谱是HPLC常用的分离模式,根据不同待测离子对固定相亲和力的差异实现分离,用于分离食品中的无机硒(熊珺等,2017)和硒代氨基酸(姚真真等,2018),分離时间短,检出限在0.6~1.0 μg/L。Bryszewska和Mage(2015)使用反向离子色谱(色谱柱XBridge C18)与电感耦合等离子体质谱联用技术(RPIC-ICP-MS)分离出6种形态的硒,6种硒化物在23 min内即完成分离,且分离度高,检出限为0.30~0.72 μg/L。与阴离子交换色谱相比,RPIC-ICP-MS柱效高,检出限低,能同时分离多种形态的硒,广泛用于极性元素的形态分离,对硒代氨基酸分离效果较佳。对于食品中硒形态的检测,GB 1903.28—2018《食品安全国家标准 食品营养强化剂 硒蛋白》中已建立了SeMet的检测方法,提取方法采用酶解提取,并使用HPLC-ICP-MS联用技术进行检测,填补了硒形态分析标准方法的空白。
2. 2. 2 高效液相色谱—氢化物发生—原子荧光联用法(HPLC-HG-AFS) 氢化物发生—原子荧光光谱法(HG-AFS)是硒测定的主要方法,在盐酸介质中,硼氢化钠将Se(IV)还原为硒化氢,以氩气作载体将硒化氢从母液中分离,并导入氢化物发生器中原子化,硒原子在激发光源下发出荧光,在一定范围内,其荧光强度与硒含量呈正比关系。由于HG-AFS具有较大线性范围,与HPLC联用后可用于检测不同形态的硒。王金荣等(2013)利用HPLC-HG-AFS成功检验了饲料和富硒酵母中Se(IV)、Se(VI)、SeCys及SeMet,方法平均回收率为70.0%~86.5%。将离子液体(ILs)添加到HPLC的流动相中,能有效改善有机硒和无机硒的分离效果,但考虑到ILs对硒化物在HG-AFS测定时的影响,Grijalba等(2017)使用C8柱在pH 6.0下以含有0.1%(v/v)氯化1-己基-3-甲基咪唑离子液体为流动相进行梯度洗脱,12 min内完成无机硒和有机硒的分离,随后优化了HG-AFS测定条件,即使体系中存在ILs,也能极大提高硒化物在HG-AFS的灵敏度;该方法成功应用于啤酒、酵母和大蒜等食品的硒形态分析,检出限为0.86~1.41 μg/L,明显高于HPLC-ICP-MS的检测限0.30~0.72 μg/L。进一步说明在硒化学形态分析中,HPLC-ICP-MS联用技术的检测灵敏度比HPLC-HG-AFS高。
2. 2. 3 气相色谱—质谱联用法(GC-MS) 气相色谱除了能分离易挥发的硒化物(二甲基硒和二甲基二硒)外,还能利用衍生剂对非挥发性的硒化物和无机硒进行衍生化,使之具有挥发性,随后对其进行分离。Gionfriddo等(2012)用SPME-GC-MS对富硒马铃薯提取液中的SeMet和Se-MeSeCys进行定量检测,其中衍生剂为氯甲酸异丁酯,能同时将氨基和羧酸基团衍生化,且该衍生反应是在室温水溶液中进行,效率高、操作简便;两种硒化物的回收率为82.3%~116.3%,检出限分别为0.143和0.210 μg/kg。Giráldez等(2015)分别用氯甲酸异丁酯和4-氯-1,2-苯二胺对SeMet、Se-MeSeCys及Se(IV)进行衍生化,用双搅拌棒吸附萃取对衍生物进行预浓缩,使用GC-MS检测其含量,Se(IV)、SeMet和Se-MeSeCys的检测限分别为0.008、0.180和0.070 ng。Vriens等(2015)采用全自动直接浸入式固相微萃取技术同时提取复杂水溶液中10种挥发性烷基化硒和硫化合物,并用毛细管气相色谱—质谱联用进行定量测定,DMSe和DMDSe的检出限分别为24和27 ng/L,回收率为83%~103%。可见,与高效液相色谱—电喷雾离子源质谱联用技术(Zembrzuska et al.,2014)、反向高效液相色谱—氢化物发生—原子吸收联用技术(Grijalba et al.,2017)和HPLC-ICP-MS(熊珺等,2017)等方法相比,用氯甲酸异丁酯作为非挥发性硒化物的衍生剂,结合采用GC-MS对硒化物进行分析时,具有更低的检测限。
2. 3 其他方法
毛细管电泳法也是常用于硒化物形态的分离方法,但在复杂的食品基质中灵敏度不高,应用范围受到限制。其原理是通过待分析组分在载流中电泳淌度的差别而实现,毛细管中待分离组分的表观淌度是其固有电泳淌度和电渗流淌度的矢量和。Deng等(2009)采用毛细管电泳与电化学发光检测器在线联用技术,在最佳条件下,测定硒富集酵母中的SeMet线性浓度范围为0.001~0.8 μg/L,相关系数为0.9996,检测限为0.39 μg/L,回收率为98.6%。
近年来,液相色谱—电喷雾—质谱联用技术广泛应用于研究食品中硒蛋白和硒肽的分布(Jaya-singhe and Caruso,2011)及其各肽段的鉴定(Bryan et al.,2017),该方法能同时测定多种不同形态硒。Zembrzuska等(2014)采用液相色谱—电喷雾—质谱联用技术对6种补硒产品中的6种形态硒[SeCys、SeMet、Se-MeSeCys、甲基硒酸(MSA)、Se(IV)和Se(VI)]进行测定,除Se(IV)外,其他5种形态的硒均有较低的检测限(0.1~1.0 μg/L)。
单独使用ICP-MS也可对硒形态进行分析检测,Duan和Hu(2009)开发了填料为Cu(II)-Al2O3纳米复合物的微量柱,其在pH 9.0和pH 4.0下可分别吸附富硒酵母水提液中的SeMet和SeCys2,用1.0 mol/L HNO3洗脱后直接进入ICP-MS进行定量检测,但该方法的检测限相对较高,SeMet和SeCys2检测限分别为24和21 μg/L,仅适用于含硒较高的食品。
3 展望
硒的形态与其毒性及生物活性密切相关,因此有必要深入研究分析硒形态的新方法,对于进一步促进我国硒营养补充剂及监督管理其相关产品质量均具有重要意义。目前,对于硒形态分析的研究还存在许多问题和难点:(1)有机硒的测定通常是通过差减法计算得到,从食品基质中除去有机硒的过程相当复杂,一般需要超声、醇溶和离心等过程,且不能完全将有机硒与无机硒分离,准确性较差;(2)总硒含量测定常用微波消解作为预处理方法,该方法能有效降低硒的损失率,加快反应速率,减少酸试剂用量,但其密闭、高压的反应环境存在一定危险性;(3)从食品基质中提取不同形态的硒常用酸提法、酶解提取法和離子液体微萃取法等,提取方法越温和,越能保持硒原有的形态,但提取效率较低,耗时长;(4)目前对硒形态分析主要关注5种形态的硒[Se(IV)、Se(VI)、SeMet、SeCys和Se-MeSeCys],由于其他形态的硒含量低或结构复杂,难以从基质中分离鉴定;(5)不论是总硒测定还是硒形态分析的过程耗时均较长,主要体现在硒的提取与分离。
因此,今后硒形态分析的研究重点首先应注重硒的提取方面,不论是总硒测定还是硒形态分析,将硒从食品基质中分离是检测的前提,绿色、快速的提取是今后发展方向;其次是关注更多未知形态的硒,包括其功能与测定方法,以便更好地发展和利用;第三是发展快速检测技术,开发提取、分离及检测一体化的自动化检测技术,加强对市场中富硒产品及硒营养补充剂的监控。一种红色纳米硒是近年来的热门研究对象,其属于零价硒,是至今发现毒性最低、生物活性最好的硒,其有效形式含量的测定,或许也将成为今后的研究热点。氨基酸分析仪常用于分析生物体中常见的氨基酸,而人体中不可缺少的第21种氨基酸——SeCys的测定,有望通过该方法同时与其他20种必需氨基酸进行分析,且能满足再现性好、精确度高、检出限较高、方法操作简便。随着液相色谱—电喷雾质谱联用技术的快速发展,探索食品中更多形态的硒已成为可能,加强对不同形态硒生物活性的研究,有望开发出更安全、更有效的功能性硒产品。我国大多地区都处于缺硒状态,食品中硒形态分析的最终目的是为了更好地分析食品中的硒形态组成,利用功能性硒含量丰富的食物,开发健康安全的补硒产品,解决普遍缺硒的问题,从而减少因缺硒导致的多种疾病发生。
参考文献:
程义勇. 2014. 《中国居民膳食营养素参考摄入量》2013修订版简介[J]. 营养学报,36(4):313-317. [Cheng Y Y. 2014. Introduction to the revised edition of the Reference Referen-ce for Dietary Nutrients of Chinese Residents[J]. Acta Nutrimenta Sinica,36(4):313-317.]
贾姗姗,朱连勤,朱风华,巩青军,陈甫. 2012. 3,3'-二氨基联苯胺分光光度法检测硒[J]. 畜牧与兽医,44(6):74-76. [Jia S S,Zhu L Q,Zhu F H,Gong Q J,Chen F. 2012. Determination of selenium by 3,3'-diaminobenzidine spectrophotometry[J]. Animal Husbandry & Veterinary Medicine,44(6):74-76.]
李猛. 2014. 全反射X射线荧光光谱法测定松子仁中16种矿物元素的含量[J]. 理化检验(化学分册),50(2):217-219. [Li M. 2014. Determination of 16 mineral elements in pine nuts by total reflection X-ray fluorescence spectrometry[J]. Physical Testing and Chemical Analysis(Part B:Chemical Analysis),50(2):217-219.]
马作江,陈永波,王尔惠,朱云芬,程群,石月明. 2011. 原子吸收光谱法测定茶叶中硒和铜[J]. 微量元素与健康研究,28(1):41-42. [Ma Z J,Chen Y B,Wang E H,Zhu Y F,Cheng Q,Shi Y M. 2011. Determination of selenium and copper content in tea by atomic absorption spectrophotometer method[J]. Studies of Trace Elements and Health,28(1):41-42.]
邱建華,王秋泉,黄本立. 2006. 硒形态分析研究进展[J]. 光谱学与光谱分析,26(9):1692-1701. [Qiu J H,Wang Q Q,Huang B L. 2006. New approaches to selenium speciation[J]. Spectroscopy and Spectral Analysis,26(9):1692-1701.]
王金荣,付佐龙,邢志,赵银丽,苏兰利. 2013. 液相色谱—原子荧光光谱联用(HPLC-HG-AFS)技术对饲料及富硒酵母中硒形态的分析[J]. 饲料工业,34(1):47-50. [Wang J R,Fu Z L,Xing Z,Zhao Y L,Su L L. 2013. Analysis of selenium speciation in feed and selenium-enriched yeast by liquid chromatography-atomic fluorescence spectrometry coupled with HPLC-HG-AFS[J]. Feed Industry,34(1):47-50.]
王世成,王颜红,刘艳辉,崔杰华,张红,齐伟,李林平. 2013. 氢化物发生—原子荧光法测定鸭蛋中无机硒和有机硒[J]. 食品科学,34(4):183-185. [Wang S C,Wang Y H,Liu Y H,Cui J H,Zhang H,Qi W,Li L P. 2013. Determination of inorganic and organic selenium in duck eggs by hydride generation-atomic fluorescence spectrometry[J]. Food Science,34(4):183-185.]
王莹,铁梅,康平利,吕永通,贲松彬,陈长兰. 2009. ICP-MS等三种测定蛹虫草硒含量方法的比较[J]. 光谱学与光谱分析,29(3):815-818. [Wang Y,Tie M,Kang P L,Lü Y T,Ben S B,Chen C L. 2009. Comparison of ICP-MS and two other analytical methods for determination of selenium content in cordyceps militaris[J]. Spectroscopy and Spectral Analysis,29(3):815-818.]
夏弈明. 2011. 中国人体硒营养研究回顾[J]. 营养学报,33(4):329-334. [Xia Y M. 2011. Review of Chinese human selenium nutrition research[J]. Acta Nutrimenta Sinica,33(4):329-334.]
熊珺,覃毅磊,龚亮,赖毅东. 2017. HPLC-ICP-MS在线联用分析食品中无机硒和硒氨基酸的形态[J]. 食品工业科技,38(4):67-72. [Xiong J,Qin Y L,Gong L,Lai Y D. 2017. Simultaneous quantification of the speciation of inorganic selenium and Se amino acids in food by high performance liquid chromatography combined with inductively coupled plasma mass spectrometry[J]. Science and Technology of Food Industry,38(4):67-72.]
许志刚,胡玉玲,李攻科. 2011. 搅拌棒吸附萃取技术的研究进展[J]. 分析化学,39(11):1766-1773. [Xu Z G,Hu Y L,Li G K. 2011. Recent research progress in stir bar sorptive extraction[J]. Chinese Journal of Analytical Chemistry,39(11):1766-1773.]
姚真真,哈雪姣,马智宏,王北洪,刘静,李冰茹. 2018. 高效液相色谱—电感耦合等离子体质谱法检测富硒苹果中5种硒形态[J]. 食品安全质量检测学报,9(3):475-480. [Yao Z Z,Ha X J,Ma Z H,Wang B H,Liu J,Li B R. 2018. Determination of 5 kinds of selenium species in selenium-enriched apples by high performance liquid chromatography-inductively coupled plasma mass spectrometry[J]. Journal of Food Safety and Quality,9(3):475-480.]
袁丽君,袁林喜,尹雪斌,秦立强. 2016. 硒的生理功能、摄入现状与对策研究进展[J]. 生物技术进展,6(6):396-405. [Yuan L J,Yuan L X,Yin X B,Qin L Q. 2016. Physiological function,deficiency and its solutions on selenium:A review[J]. Current Biotechnology,6(6):396-405.]
張绿茵,余晓平,郭亚飞,邓天龙. 2012. 生物样品中硒形态分析前处理技术(英文)[J]. 岩矿测试,31(3):407-412. [Zhang L Y,Yu X P,Guo Y F,Deng T L. 2012. Pretreatment techniques for selenium speciation analysis in biosamples[J]. Rock and Mineral Analysis,31(3):407-412.]
邹涛,王小红,黄维钱,胡广林. 2011. 两种补硒产品中硒的测定及其生物可利用性评估[J]. 化学研究与应用,23(8):1106-1110. [Zou T,Wang X H,Huang W Q,Hu G L. 2011. Determination of selenium in two Se supplements and estimation of their bioavailability[J]. Chemical Research and Application,23(8):1106-1110.]
Altunay N,Gürkan R. 2016. Separation/preconcentration of ultra-trace levels of inorganic Sb and Se from different sample matrices by charge transfer sensitized ion-pairing using ultrasonic-assisted cloud point extraction prior to their sp-eciation and determination by hydride generation AAS[J]. Talanta,159:344-355.
Altunay N,Gürkan R. 2017. Determination of sub-ng g-1 le-vels of total inorganic arsenic and selenium in foods by hydride-generation atomic absorption spectrometry after pre-concentration[J]. Food Additives and Contaminants:Part A,34(3):390-403.
Bierla K,Suzuki N,Ogra Y,Szpunar J,Lobinski R. 2017. Identification and determination of selenohomolanthionine—The major selenium compound in Torula yeast[J]. Food Chemistry,237:1196-1201.
Boyd R. 2011. Selenium stories[J]. Nature Chemistry,3(7):570.
Bryan C E,Bossart G D,Christopher S J,Davis W C,Kilpatrick L E,McFee W E,O′Brien T X. 2017. Selenium protein identification and profiling by mass spectrometry:A tool to assess progression of cardiomyopathy in a whale model[J]. Journal of Trace Elements in Medicine and Bio-logy,44:40-49.
Bryszewska M A,Mage A. 2015. Determination of selenium and its compounds in marine organisms[J]. Journal of Trace Elements in Medicine and Biology,29:91-98.
Cardoso B,Roberts B R,Bush A I,Hare D J. 2015. Selenium,selenoproteins and neurodegenerative diseases[J]. Metallomics,7(8):1213-1228.
Chen S Z,Zhu S P,Lu D B. 2015. Solidified floating organic drop microextraction for speciation of selenium and its distribution in selenium-rich tea leaves and tea infusion by electrothermal vapourisation inductively coupled plasma mass spectrometry[J]. Food Chemistry,169:156-161.
da Silva E G,Mataveli L R V,Arruda M A Z. 2013. Speciation analysis of selenium in plankton, Brazil nut and human urine samples by HPLC-ICP-MS[J]. Talanta,110:53-57.
Dadfarnia S,Shabani A H,Nozohor M. 2014. Dispersive li-quid-liquid microextraction-solidified floating organic drop combined with spectrophotometry for the speciation and determination of ultratrace amounts of selenium[J]. Journal of the Brazilian Chemical Society,25(2):229-237.
Deng B Y,Shi A H,Li L Q,Xie F,Lu H,Xu Q X. 2009. Determination of selenomethionine in selenium-enriched yeast using capillary electrophoresis on-line coupled with electrochemiluminescence detection[J]. Microchim Acta,165(3):279-283.
Donovan J,Copeland P R. 2010. Threading the needle:Getting selenocysteine into proteins[J]. Antioxidants & Redox Signaling,12(7):881-892.
Duan J K,Hu B. 2009. Speciation of selenomethionine and selenocystine using online micro-column containing Cu(II) loaded nanometer-sized Al2O3 coupled with ICP-MS detection[J]. Talanta,79(3):734-738.
Garcia B,Krachler M,Chen B,Shotyk W. 2005. Improved determination of selenium in plant and peat samples using hydride generation-atomic fluorescence spectrometry(HG-AFS)[J]. Analytica Chimica Acta,534(2):255-261.
Giráldez I,Ruiz-Azcona P,Vidal A,Morales E. 2015. Speciation of selenite and selenoamino acids in biota samples by dual stir bar sorptive extraction-single desorption-ca-pillary gas chromatography/mass spectrometry[J]. Microchemical Journal,122:197-204.
Grijalba A C,Fiorentini E F,Wuilloud R G. 2017. Ionic li-quid-assisted separation and determination of selenium species in food and beverage samples by liquid chromatography coupled to hydride generation atomic fluorescence spectrometry[J]. Journal of Chromatography A,1491:117-125.
Gionfriddo E,Naccarato A,Sindona G,Tagarelli A. 2012. A reliable solid phase microextraction-gas chromatography-triple quadrupole mass spectrometry method for the assay of selenomethionine and selenomethylselenocysteine in aqueous extracts:Difference between selenized and not-enriched selenium potatoes[J]. Analytica Chimica Acta,747:58-66.
Hoffmann F,Hashimoto A,Shafer L A,Dow S,Berry M J,Hoffmann P R. 2010. Dietary selenium modulates activation and differentiation of CD4(+) T cells in mice through a mechanism involving cellular free thiols[J]. Journal of Nutrition,140(6):1155-1161.
Jayasinghe S B,Caruso J A. 2011. Investigation of Se-contai-ning proteins in Bertholletia excelsa H.B.K.(Brazil nuts) by ICPMS,MALDI-MS and LC-ESI-MS methods[J]. International Journal of Mass Spectrometry,307(1-3):16-27.
Li X L,Yu Z S. 2016. Determination of selenium in biological samples with an energy-dispersive X-ray fluorescence spectrometer[J]. Applied Radiation and Isotopes,111(12):45-49.
Martinis E M,Escudero L B,Berton P,Monasterio R P,Filippini M F,Wuilloud R G. 2011. Determination of inorga-nic selenium species in water and garlic samples with on-line ionic liquid dispersive microextraction and electrothermal atomic absorption spectrometry[J]. Talanta,85(4):2182-2188.
Mariotti M,Ridge P G,Zhang Y,Lobanov A V,Pringle T H,Guigo R,Hatfield D L,Gladyshev V N. 2012. Composition and evolution of the vertebrate and mammalian selenoproteomes[J]. PLoS One,7(3):e330663.
Min M,Shen C,Fang L,Zhu B R,Li J H,Yao L Y,Jiang Y J,Xiong C H. 2017. Design of a selective regenerable cellulose microcolumn for selenium efficient recovery and economic determination[J]. Chemical Engineering Research and Design,117:773-783.
Naziroglu M. 2009. Role of selenium on calcium signaling and oxidative stress-induced molecular pathways in epilepsy[J]. Neurochemical Research,34(12):2181-2191.
Ohki A,Nakajima T,Hirakawa S,Hayashi K,Takanashi H. 2016. A simple method of the recovery of selenium from food samples for the determination by ICP-MS[J]. Microchemical Journal,124:693-698.
Pytlakowska K,Kozik V,Dabioch M. 2013. Complex-for-ming organic ligands in cloud-point extraction of metal ions:A review[J]. Talanta,110:202-228.
Rao Y,McCooeye M,Windust A,Bramanti E,D'Ulivo A,Mester Z. 2010. Mapping of selenium metabolic pathway in yeast by liquid chromatography-Orbitrap mass spectrometry[J]. Analytical Chemistry,82(19):8121-8130.
Rayman M P. 2012. Selenium and human health[J]. The Lancet,379:1256-1268.
Rybínová M,Musil S,Cerveny V,Vobecky M,Rychlovsky P. 2016. UV-photochemical vapor generation of selenium for atomic absorption spectrometry:Optimization and 75Se radiotracer efficiency study[J]. Spectrochimica Acta Part B,123:134-142.
Saygi K O,Melek E,Tuzen M,Soylak M. 2007. Speciation of selenium(IV) and selenium(VI) in environmental samples by the combination of graphite furnace atomic absorption spectrometric determination and solid phase extraction on Diaion HP-2MG[J]. Talanta,71(3):1375-1381.
Shrivas K,Patel D K. 2011. Ultrasound assisted-hollow fibre liquid-phase microextraction for the determination of selenium in vegetable and fruit samples by using GF-AAS[J]. Food Chemistry,124(4):1673-1677.
Solovyev N D. 2015. Importance of selenium and selenoprotein for brain function:From antioxidant protection to neuronal signalling[J]. Journal of Inorganic Biochemistry,153:1-12.
Steinbrenner H,Sies H. 2009. Protection against reactive oxygen species by selenoproteins[J]. Biochimica et Biophysica Acta,1790(11):1478-1485.
Thiry C,Ruttens A,De Temmerman L,Schneider Y,Pussemier L. 2012. Current knowledge in species-related bioavai-lability of selenium in food[J]. Food Chemistry,130(4):767-784.
Tuzen M,Pekiner O Z. 2015. Ultrasound-assisted ionic liquid dispersive liquid-liquid microextraction combined with graphite furnace atomic absorption spectrometric for selenium speciation in foods and beverages[J]. Food Che-mistry,188:619-624.
Tuzen M,Saygi K O,Soylak M. 2007. Separation and speciation of selenium in food and water samples by the combination of magnesium hydroxide coprecipitation-graphite furnace atomic absorption spectrometric determination[J]. Talanta,71(1):424-429.
Vale G,Pereira S,Mota A,Fonseca L,Capelo J L. 2007. Enzymatic probe sonication as a tool for solid-liquid extraction for total selenium determination by electrotherma-latomic absorption spectrometry[J]. Talanta,74(2):198-205.
Vriens B,Mathis M,Winkel L H E,Berg M. 2015. Quantification of volatile-alkylated selenium and sulfur in complex aqueous media using solid-phase microextraction[J]. Journal of Chromatography A,1407:11-20.
Wang M,Zhong Y Z,Qin J P,Zhang Z H,Li S,Yang B Y. 2017. Determination of total selenium in food samples by d-CPE and HG-AFS[J]. Food Chemistry,227:329-334.
Xie J H,Shen M Y,Nie S P,Liu X,Yin J Y,Huang D F,Zhang H,Xie M Y. 2013. Simultaneous analysis of 18 mineral elements in Cyclocarya paliurus polysaccharide by ICP-AES[J]. Carbohydrate Polymers,94(1):216-220.
Zembrzuska J,Matusiewicz H,Polkowska-Motrenko H,Chajduk E. 2014. Simultaneous quantitation and identification of organic and inorganic selenium in diet supplements by liquid chromatography with tandem mass spectrometry[J]. Food Chemistry,142:178-187.
(責任编辑 罗 丽)

