TALEN介导水稻OsTZF9基因定点突变研究
周淑芬 施惠芳



摘 要:RRTZF锌指基因在植物生长发育和胁迫反应中起着重要作用。利用TALEN基因组编辑技术定点突变水稻RRTZF基因OsTZF9,结果表明:根据日本晴基因组中的OsTZF9基因序列,设计3对TALEN靶序列,并构建相应的3个TALEN植物敲除表达载体;通过农杆菌介导法分别将3个TALEN敲除载体导入水稻明恢86和秀水134的胚性愈伤组织中,获得了100个转化再生植株,PCR检测获得87个阳性植株;PCR扩增转基因植株靶突变区并测序列,发现所有转基因植株均未出现靶突变。
关键词:水稻;OsTZF9基因;TALEN;定点突变
DOI: 10.13651/j.cnki.fjnykj.2019.02.004
Abstract: RRTZF zinc finger gene plays an important role in plant growth, development and stress response. Target mutation of RRTZF gene OsTZF9 in rice was carried out by TALEN genome editing technique. The results showed that three pairs of TALEN target sequences were designed according to the sequence of OsTZF9 gene in Nipponbare, and three plant knockout expression vectors were constructed and introduced into embryogenic callus of Minghui 86 and Xiushui 134 by Agrobacteriummediated transformation, obtaining 100 transformants. Among them, 87 positive plants were obtained through PCR detection. The target mutation regions of the transgenic plants were detected and sequenced, to find no target mutation.
Key words: Rice; OsTZF9 gene; TALEN; Sitedirected mutation
RRTZF锌指基因是一类植物特有的CCCH型锌指基因,因其编码蛋白含有1个TZF模体及其上游50个氨基酸为富含精氨酸区(RR)而得名,该TZF模体由中间间隔16个氨基酸的2个不同CCCH结构域组成[1-2]。通过全基因组学分析,目前已在多种单双子叶植物中鉴定了许多RRTZF成员。除了拟南芥中所有RRTZF基因的功能得到一定程度的解析,其他植物中仅有少部分TZF基因功能被研究。
OsTZF9是一个水稻胚乳中特异性表达的RRTZF基因,酵母单杂分析发现,OsTZF9蛋白与谷蛋白基因启动子区结合,RNAi技术分析发现RNAi转基因植株与对照表型没有区别,但部分转基因植株种子中的谷蛋白含量比对照低,表明OsTZF9基因具有下调谷蛋白基因表达的功能[3-5]。在拟南芥的RRTZF基因功能研究中,发现不同RRTZF基因过表达植株具有一因多效的作用,且存在许多相似表型[6],暗示植物RRTZF基因具有一定程度的功能冗余。由于这类基因存在着功能冗余,许多RRTZF基因单突变体出现的表型很微小,难以观察到或者根本就没有任何表型,因此通过RNAi或反义RNA等拟敲除技术获得的拟突变体常因抑制不彻底更难观察到表型。
基因组编辑是一种在基因组水平上对DNA序列进行定向改造的遗传操作技术,克服了RNAi技术抑制不彻底的缺陷。TALEN技术是2011 年发展起来的非常有效的基因组编辑技术,由黄单胞杆菌转录激活类效应子TALE和核酸内切酶FokⅠ的DNA切割域组成,前者能特异性识别DNA序列,后者为DNA切割域[7]。本研究构建了OsTZF9基因的TALEN敲除载体并获得其转基因植株,为进一步研究OsTZF9基因的功能奠定基础。
1 材料与方法
1.1 植物材料
转基因受体材料为籼稻明恢86和粳稻秀水134。
1.2 载体与菌株
TALEN左右臂骨架载体pTALENL20和pTALENR16、改造過的pCAMBIA1301载体、大肠杆菌D18由上海斯丹赛公司提供,大肠杆菌DH5a和根癌农杆菌LBA4404由福建省农业遗传工程重点实验室保存。
1.3 主要试剂
TALEN试剂盒(上海斯丹赛公司),PrimeSTAR HS DNA Polymerase(TaKaRa公司),Taq DNA 聚合酶、质粒提取试剂盒、DNA纯化试剂盒(天根生化科技有限公司),限制性内切酶、DNA Ligation Kit(Fermentas公司),引物合成、DNA测序(上海博尚生物技术有限公司),潮霉素(Roche 公司),组织培养试剂(Sigma公司)。
1.4 载体构建
根据TALEN靶序列设计原则,在OsTZF9基因的编码序列区设计TALEN左右臂识别序列。根据设计的TALEN左右臂识别序列,按照上海斯丹赛生物技术有限公司提供的模块合成方法(FastTALETMTALEN试剂盒),合成TALEN左右臂模块并分别构建于骨架载体pTALENL20和pTALENR16中,经酶切和测序验证后,获得构建正确的TALEN左臂和右臂基因表达盒。用HindⅢ和AscⅠ酶从质粒中切取TALEN左臂基因表达盒,胶回收5 kb条带;用SacⅠ和AscⅠ酶从质粒中切取TALEN右臂基因表达盒,胶回收4 kb条带;用HindⅢ和SacⅠ酶切改造过的pCAMBIA1301植物表达载体,胶回收8.5 kb条带。将上述3个片段一步法连接获得含有TALEN左右臂基因表达盒的植物双元表达载体,并电击转化农杆菌LBA 4404,于-80℃下保存备用。
1.5 农杆菌介导的水稻遗传转化
以日本晴的幼胚诱导愈伤组织,并用于随后的转化。水稻愈伤组织的诱导、继代及与农杆菌的共培养,抗性愈伤组织的筛选及再生等相关的培养基和具体的试验步骤参照文献[8]进行。
1.6 转基因植株检测
CTAB法[9]提取水稻植株叶片基因组DNA,在25 μL体系中分别扩增TALEN表达框内的基因片段和OsTZF9靶突变区。前者引物为FOKF(5′TGACCGAGTTCAAGTTCC 3′)和NOSR(5′TTGCGGGACTCTAATCA3′);后者引物為77GF(5′CAAAGCACATTGCAAACACAG 3′)和77GR(5′GTAACACACCCATCTACACGAAG3′)。PCR反应条件为:94℃预变性5 min;94℃变性45 s,56℃退火45 s (温度依据GC含量高低而定),72℃延伸45 s(时间根据扩增长度而定,1 kb·min-1),共35个循环;72℃延伸10 min。取PCR扩增产物(5 μL)于琼脂糖凝胶上进行电泳并用凝胶成像仪拍照分析。
2 结果与分析
2.1 设计TALEN靶序列
水稻OsTZF9基因包含1个外显子,全长843 bp,编码280个氨基酸,含有1个CHCH和1个TZF模体(图1)。根据TALEN左右臂靶序列的设计原则,在CHCH和TZF模体区域共设计了3对TALEN靶序列,如表1所示。TALEN左右臂靶序列的设计原则:(1)左右臂的识别长度为12~19 bp,间隔序列长度为12~21 bp。(2)靶位点邻5′端碱基是T,3′端以T结尾(3)靶位点尽量多含A和C,适量T,少量G。(4)尽量避开磷酸化位点,如编码苏氨酸、丝氨酸、赖氨酸和精氨酸的位点。
2.2 构建TALEN左右臂载体
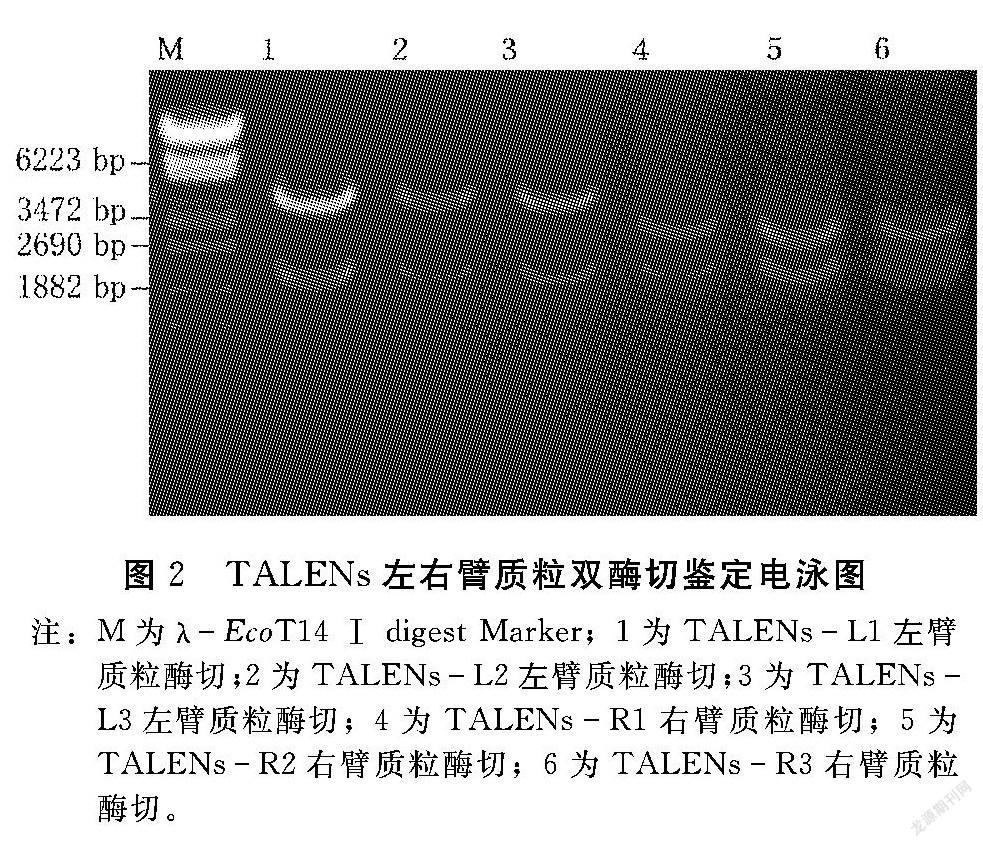
将左右臂识别序列3′端的最后一个T去除,其余碱基按1个或2个碱基组合依次进行标记(从1标到9),根据标记好的碱基在试剂盒的模块中选择对应编号的模块与TALEN左臂(pTALENL20)或右臂(pTALENR16)线性骨架载体进行9个片段同时连接,热激转化D18感受态细胞,挑取单克隆菌落,经摇菌提质粒后使用Bam H Ⅰ和SpeⅠ酶切获得重组载体,如图2所示。进一步将上述的重组载体送公司测序,与设计的标准序列在NCBI中进行tBlastX比对。结果显示6个重组载体均100%正确。因此,本研究成功构建了6个正确的TALEN左右臂重组载体。
图2 TALENs左右臂质粒双酶切鉴定电泳图注:M为λEcoT14 Ⅰ digest Marker;1为TALENsL1左臂质粒酶切;2为TALENsL2左臂质粒酶切;3为TALENsL3左臂质粒酶切;4为TALENsR1右臂质粒酶切;5为TALENsR2右臂质粒酶切;6为TALENsR3右臂质粒酶切。
用HindⅢ和AscⅠ酶切构建正确的TALEN左臂载体,用SacⅠ和AscⅠ酶切构建正确的TALEN右臂载体,前者胶回收约5 kb的条带,后者胶回收约4 K的条带,用于后续的载体构建实验,图3为胶回收后电泳检测结果。
2.3 构建TALEN植物敲除表达载体
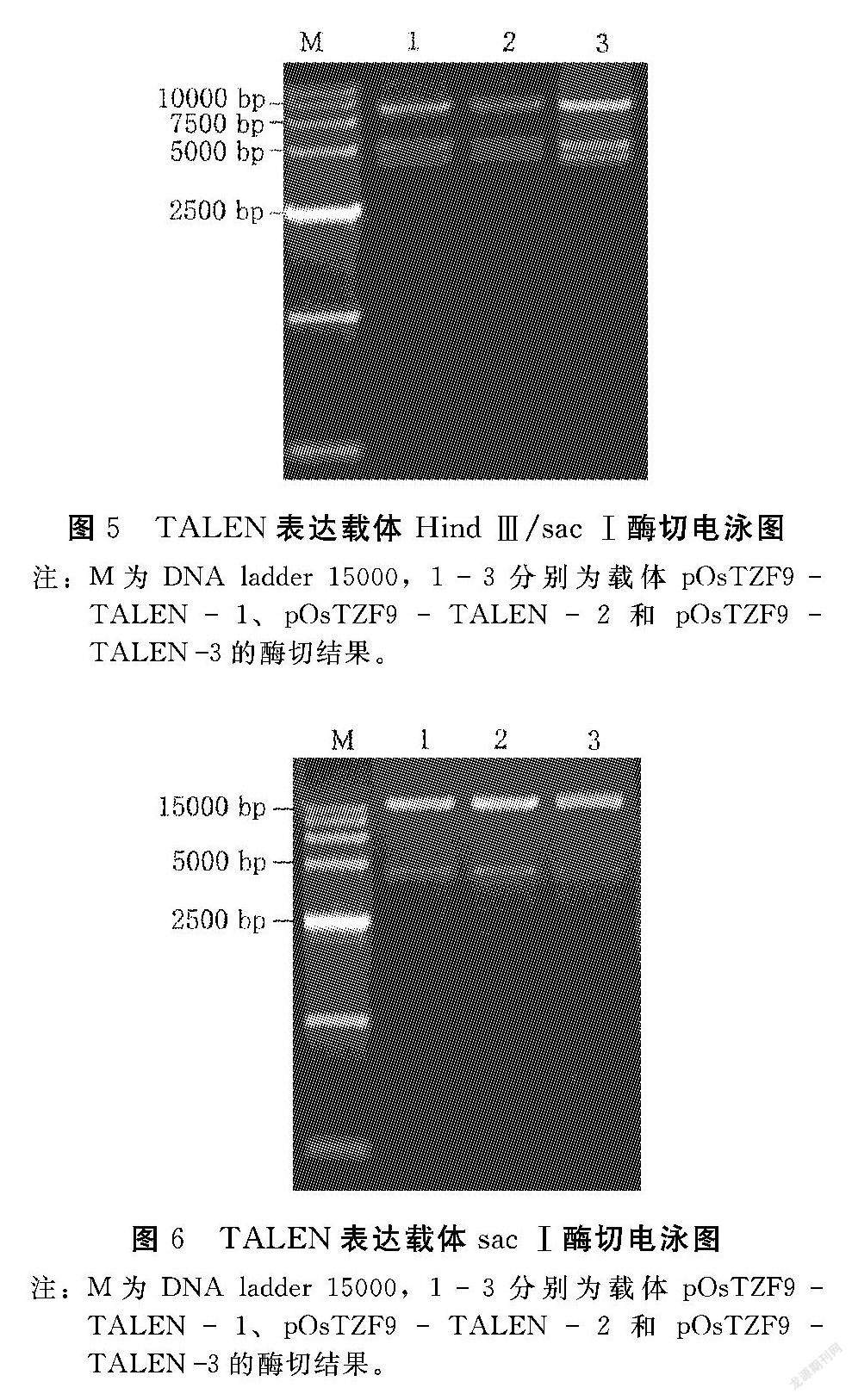
将上述胶回收的左臂(5 kb)、右臂(4 kb)和改造过的p1301线性载体(8.5 kb)于22℃连接3 h,转化感受态D18。次日挑取单克隆,于37℃、250 r·min-1的摇床中培养16 h左右,提质粒跑电泳,比对照质粒大的质粒初步确定为连接成功的目的载体(图4);进一步用HindⅢ和SacⅠ双酶切,出现3个条带约为8、5和4 kb(图5),说明酶切结果正确;最后用SacⅠ酶切鉴定正确的质粒,出现约4 kb和12 kb两个条带(图6),其中前者为右臂,后者为左臂,分别胶回收这两个片段送往公司测序,测序结果均正确,即完成OsTZF9基因3个靶位点的TALEN敲除载体构建,并命名为pOsTZF9TALEN1、pOsTZF9TALEN2和pOsTZF9TALEN3。同时通过电击法将上述3个载体分别导入农杆菌中,25%甘油保存于-80℃中。
2.4 水稻遗传转化及检测
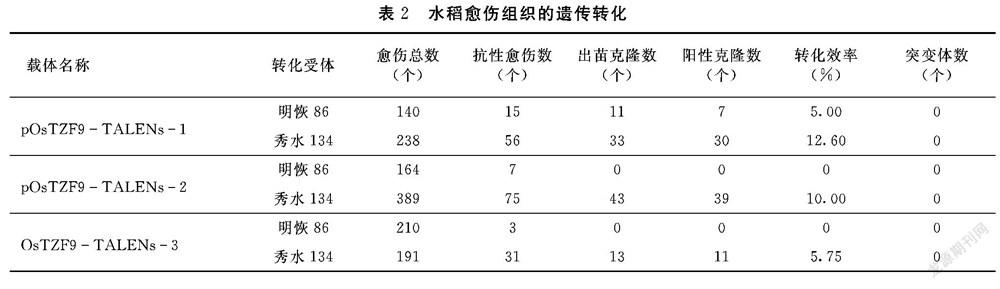
将构建好的质粒pOsTZF9TALEN1、pOsTZF9TALEN2和pOsTZF9TALEN3分别转化到水稻明恢86和秀水134中,对获得的转化再生植株的叶片用浸泡潮霉素法和PCR方法检测,结果如表2所示,在明恢86受体材料中仅有pOsTZF9TALEN1质粒获得转基因植株,其转化率为5.00%;在秀水134受体材料中,虽然3个载体均能获得转基因再生植株,但其转化率也不高。
PCR扩增靶突变区片段,并测序分析其靶位点突变情况,结果发现所有转基因植株均未产生靶突变。为了排除可能由于TALEN模块发生重组导致TALEN活性丧失问题,利用引物305(5′CTCCCCTTCAGCTGGACAC 3′)和306(5′AGCTGGGCCACGATTGAC 3′)对转基因植物基因组DNA进行PCR扩增TALEN左右臂序列。由于左右臂大小比较接近,因此对扩增产物TA克隆并转化到大肠杆菌DH5α中,然后对单菌落进行菌液PCR,选择扩增片段2 kb左右菌液进行测序,测序结果比对均正确,说明导入水稻中的TALEN模块未发生重组。
3 结论与讨论
本研究成功构建了OsTZF9基因3个靶位点的TALEN敲除载体,通过农杆菌介导法导入水稻明恢86和秀水134中,成功获得87个转基因植株。但在转化过程中发现,TALEN敲除载体明显比其他载体的转化率低(本实验室构建的其他基因的TALEN敲除载体也有类似现象),原因之一可能是TALEN植物表达载体相对于其他转化载体大,不易转化。
本研究检测了所有转基因植株,但均未检测到靶突变体。其实,本试验在检测其他基因的TALEN转基因植株靶突变情况时,也发现其突变率很低。其原因可能有3个:一是TALEN载体存在着高度重复,易发生同源重组, 进而影响其活性;二是TALEN表达框插入的随机性,当插入到某些重要的基因内部, 使TALEN表达框出现基因沉默或者表达受到抑制;三是TALEN表达框插入到植物体中有表达,但是植物体把它当成是外源物,触发植物体的自我免疫功能,从而降低了TALEN蛋白的活性,因此就无法识别切割目的基因,导致无法产生突变体。本研究检测3个TALEN模块的同源重组情况,均未发生同源重组,其具体原因有待进一步研究。
因此,为了能获得靶基因突变体,建议多设计几个靶位点;同时为了减少后期的工作量,可以先在原生质体中检测TALEN蛋白的活性,再转化愈伤组织。由于TALEN蛋白在受体细胞中可持续起作用,通过对抗性愈伤继续进行继代培养可产生新突变,增加突变的类型。
参考文献:
[1]POMERANZ MC,HAH C,LIN PC,et al.The Arabidopsis tandem zinc finger protein AtTZF1 traffics between the nucleus and cytoplasmic foci and binds both DNA and RNA[J].Plant Physiol,2010,152:151-165.
[2]Wang D,Guo Y,Wu C,et al.Genomewide analysis of CCCH zinc finger family in Arabidopsis and rice[J].BMC Genomics,2008,9:44-54.
[3]劉梅芳,周淑芬,徐桂磊,等.一个水稻CCCH型锌指蛋白基因的表达模式分析[J].福建农业学报,2008,23(3):225-230.
[4]周淑芬,刘华清,徐桂磊,等.水稻种子发育期间特异性锌指蛋白基因的筛选与分析[J].中国生物化学与分子生物学报,2012,9(2):237-289.
[5]CHEN Y,SUN A,WANG M,et al.Functions of the CCCH type zinc finger protein OsGZF1 in regulation of the seed storage protein GluB?1from rice[J].Plant Mol Biol,2014,84:621-634.
[6]POMERANZ M,FINER J,JANG JC.Putative molecular mechanisms underlying tandem CCCH zinc finger protein mediated plant growth,stress and gene expression responses[J].Plant Signaling & Behavior,2011,6(5):647-651.
[7]MILLER JC,TAN S,QIAO G,et al.A TALE nuclease architecture for efficient genome editing[J].Nat Biotechnol,2011,29:143-148.
[8]苏军,胡昌泉,翟红利,等.农杆菌介导籼稻明恢86高效稳定转化体系的建立[J].福建农业学报,2003,18(4):209-213.
[9]MURRY MG,THOMPSON WF.Rapid isolation of high molecular weight plant DNA[J].Nucl Acid Res,1980,8(19):4321-4326.
(责任编辑:柯文辉)

