球孢白僵菌Bbpks1基因的序列分析及其最佳表达培养基的筛选
原晓龙, 李 娟,2, 李云琴, 王 毅
(1.云南省林业科学院云南省森林植物培育与开发利用重点实验室/国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650204;2.云南大学中草药生物资源研究所云百草实验室,云南 昆明 650091)
天然次生代谢产物中的聚酮(polyketides)、非核糖体多肽(nonribosomal peptides)及其杂合物等均具有独特的生理活性[1-2].这些物质包括聚酮类抗生素红霉素、四环素,非核糖体多肽类抗生素青霉素、头孢霉素以及糖肽类抗生素万古霉素等.在真菌中,聚酮和非核糖体肽的合成分别由聚酮合酶(polyketide synthase, PKS)、非核糖体肽合成酶(nonribosomal peptide synthetase, NRPS)催化[1,3].真菌聚酮合酶主要属于Ⅰ型PKS[1,4],其结构域通常包括酮体合成酶(ketosynthase, KS)、酰基转移酶(acyltransferase, AT)、脱水酶(dehydratase, DH)、甲基转移酶(methyltransferase, MT)、烯酯酰还原酶(enoylreductase, ER)、酮体还原酶(ketoreductase, KR)、酰基载体蛋白(acyl carierpretein, ACP)和环化酶(cyclase, CYC)等[1].NRPS是一种由多模块组成的多酶复合体[5],由腺苷酰化结构域(adenylation domain, A)、肽酰载体蛋白结构域(phosphopantetheine attachment site, PP)和缩合结构域(condensation domain, C)按照特定的时空顺序排列组成[6].PKS和NRPS按照严格的装配模式催化、缩合单体有机酸或氨基酸;同时,这2个模块可以组成PKS/NRPS杂合分子[7-8].
应用基因组挖掘技术全面发掘真菌中聚酮、非核糖体多肽等天然产物的合成基因,通过系统变换培养条件改变这些基因的表达量,有可能激发它们全部的次生代谢潜力[9-10].目前,在球孢白僵菌(Beauveriabassiana)中仅鉴定了参与白僵菌素(tenellin)合成的PKS[11-12],其余的PKS基因功能尚不明确.因此,本研究采用基因组挖掘的方式从球孢白僵菌基因组中获得一条杂合PKS/NRPS基因(Bbpks1),通过生物信息学分析预测其潜在功能,并尝试寻找该基因的最佳表达培养基,为最终确定其天然产物及鉴定其异源表达奠定基础.
1 材料与方法
1.1 供试菌株
球孢白僵菌菌株(菌株号:YH02)来源于云南云百草生物技术有限公司,用MY培养基(麦芽糖6 g·L-1,酵母提取物4 g·L-1)在25 ℃恒温条件下培养,MY培养基上的真菌菌株每2周转接一次.将球孢白僵菌在MY培养基上培养5~7 d,收获0.5 g菌丝体,干燥后在液氮环境下研磨成粉末用于提取基因组DNA.
1.2 试剂与仪器
真菌RNA提取试剂盒(康为世纪公司),高保真聚合酶(HiFi-DNA polymerase, TaKaRa公司),NanoDropTM2000紫外分光光度计(赛默飞世尔科技公司),真菌总RNA提取试剂盒(TaKaRa公司),反转录试剂盒(赛默飞世尔科技公司),HiFi高保真酶(北京全式金公司),DNA纯化试剂盒(Qiagen公司),无缝克隆试剂盒(Biomiga公司).
1.3 Bbpks1基因的挖掘及克隆
以曲霉中已报道的PKS基因为模板,利用本地BLAST对球孢白僵菌基因组进行扫描,获得可能含有PKS基因的contigs.然后利用antiSMASH软件(https://antismash.secondarymetabolites.org/)[13]进行验证,并利用GENEFISH扫描contigs开放阅读框,通过生物信息学分析从白僵菌基因组中获得的Bbpks1基因的DNA序列及蛋白序列.
根据DNA序列设计2对特异引物(Bbpks15F为5′-TCCTATCACCTCGCCTCAAAATGTCTTCGCACCAAAACGA-3′,Bbpks1MR为5′-TTCTTCTCGGAAAAGGCGAC-3′;Bbpks1MF为5′-GTCGCCTTTTCCGAGAAGAA-3′,Bbpks13R为5′-AGTACGAATATGAGAGCTCACTCAAACTGCTTGCTCTCCCA-3′)用于Bbpks1基因全长cDNA的克隆.以球孢白僵菌的cDNA为模板,用HiFi高保真酶分别扩增出Bbpks1基因的5′片段和3′片段,将这2个片段经DNA纯化试剂盒纯化后,按照无缝克隆试剂盒说明书中的具体步骤将Bbpks1基因的5′片段和3′片段连接起来,获取全长cDNA.将该基因片段连接到克隆载体pUC19上,再转化至Trans-T1感受态细胞中,经蓝白斑和菌落PCR筛选后获得含有插入片段的阳性克隆,送上海生工生物工程技术服务有限公司进行测序.
1.4 聚类分析
从NCBI上选择功能已知且鉴定过的杂合PKS/NRPS蛋白[14-16](表1)序列用于聚类分析.采用MEGA 7.0中的Clustal W程序对所选择的蛋白序列和球孢白僵菌中的BbPKS1蛋白序列进行比对后,采用邻位相接法(neighbor-joining)自检举1 000次,其余用默认参数构建分子系统进化树.依据聚类结果,从基因起源与功能分化的角度预测该基因的功能,并进一步推测该基因产生的聚酮化合物.
1.5 Bbpks1基因在不同培养基上的表达测定
将球孢白僵菌培养在添加不同碳源、氮源的培养基上,培养14 d后,从每种培养基上收获0.5 g菌丝体.培养基设置:以麦芽浸粉 6 g·L-1、酵母提取物3 g·L-1为基础培养基,再分别添加4 g·L-1乳糖、甘露醇、麦芽糖、葡萄糖、山梨醇、果糖、肌醇作为不同碳源的培养基;以麦芽糖1.8 g·L-1、葡萄糖6 g·L-1为基础培养基,再分别添加4 g·L-1牛肉浸粉、酪蛋白胨、胰蛋白胨、马铃薯浸粉作为不同氮源的培养基[17].根据Bbpks1基因的DNA序列,设计特异检测引物(TBbpks1F为TCTCCTTGGCAAGGTTACTG,TBbpks1R为ACCACGCTCCATCATGTACT).采用真菌总RNA提取试剂盒提取不同处理菌丝体的总RNA,并选择浓度合适的RNA,采用反转录试剂盒将其反转录成cDNA,再用特异引物TBbpks1F和TBbpks1R对不同样品的cDNA进行PCR扩增.扩增后,各PCR产物和2 kb marker在琼脂糖凝胶点样孔中的上样量均为2.5 μL.利用Azure C300凝胶成像系统中的图像分析工具分析电泳图片,获得各条带的积分光密度值,并以该值与2 kb marker中的750 bp条带进行比较,用Excel软件绘制不同培养基处理下其相对值的柱状图.
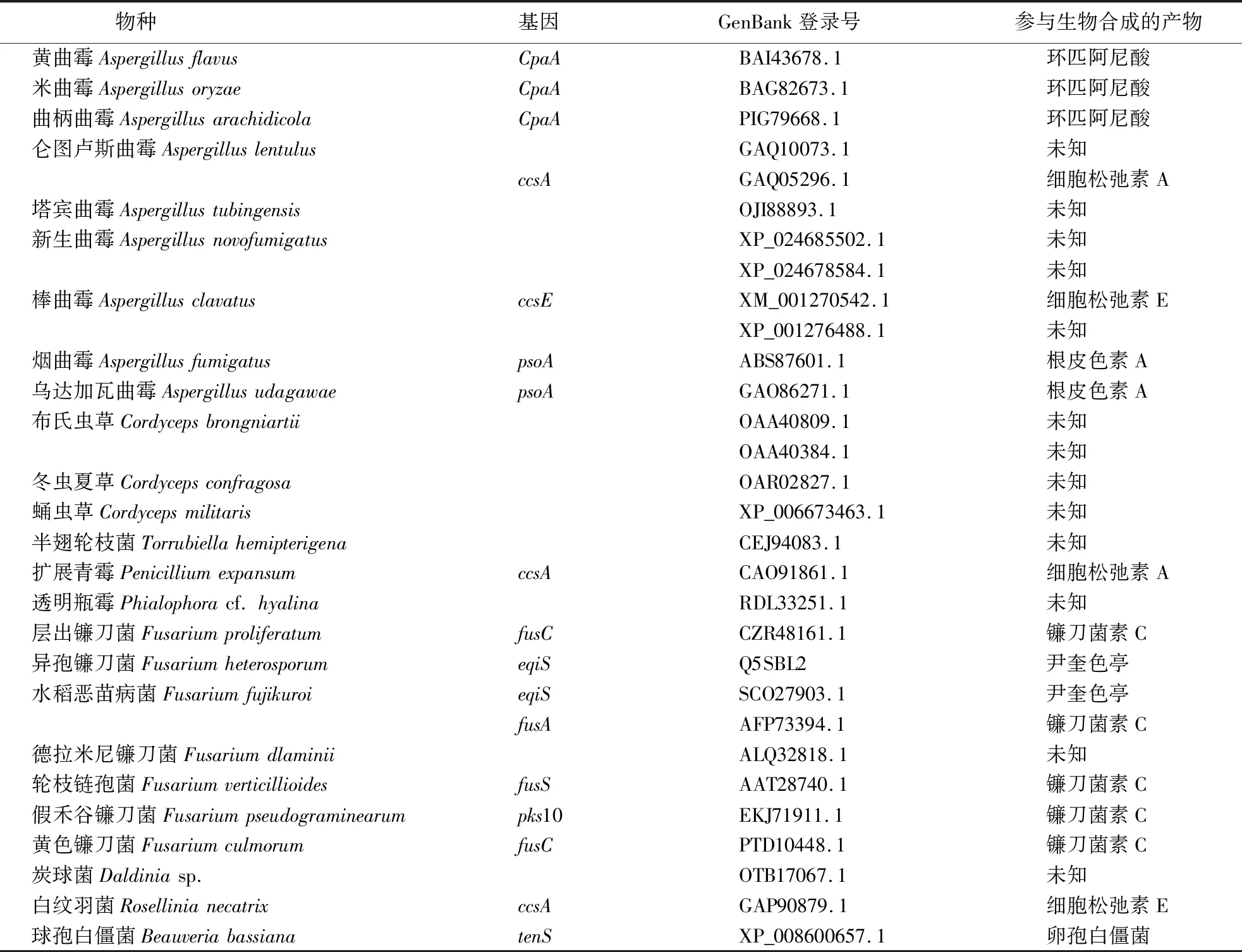
表1 构建分子进化树的参考蛋白Table 1 Reference protein for constructing molecular evolutionary tree
2 结果与分析
2.1 Bbpks1基因全长cDNA的获得及序列分析
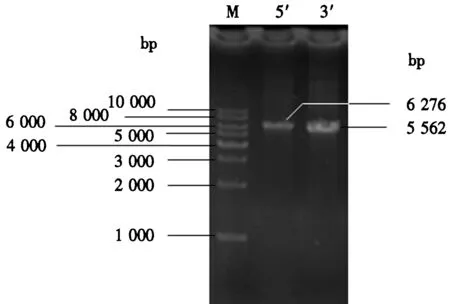
图1 Bbpks1基因的5′端和3′端的克隆片段Fig.1 Cloning fragment of 5′ and 3′ end of Bbpks1 gene
用HiFi高保真酶分别扩增Bbpks1基因的5′端和3′端(图1),其长度分别为6 276和5 562 bp,用无缝连接试剂盒连接后,其长度为11 838 bp,可编码3 945 个氨基酸.序列相似性和结构域分析显示其结构域顺序为KS-AT-DH-MT-KR-ACP-C-A-PP-SDR,其末端释放结构域为短链醇脱氢酶(short-chain dehydrogenase, SDR).将Bbpks1基因的cDNA全长进行BLAST比对,发现该基因与球孢白僵菌Bb0062菌株的杂合PKS/NRPS基因(GenBank登录号为XM_008600273)和蛹虫草(Cordycepsmilitaris)CM01菌株的杂合PKS/NRPS基因(GenBank登录号为XM_006669868.1)对应的mRNA序列分别具有98%和87%一致性,说明该基因广泛存在于昆虫致病性真菌中.
2.2 BbPKS1蛋白的系统进化分析
分子系统进化树(图2)分为8个分支.其中,BbPKS1与布氏虫草(Cordycepsbrongniartii, GenBank登录号为OAA40809.1)、半翅轮枝菌(Torrubiellahemipterigena, GenBank登录号为CEJ94083.1)、塔宾曲霉(Aspergillustubingensis, GenBank登录号为OJI88893.1)中的杂合PKS/NRPS蛋白序列聚于分支Ⅱ中,与其相关的聚酮化合物未知.分支Ⅰ中的蛋白参与聚酮细胞松弛素E的合成,分支Ⅲ中的蛋白参与伊快霉素的合成,分支Ⅳ中的蛋白参与环匹阿尼酸的合成,分支Ⅴ中的蛋白参与细胞松弛素A的合成,分支Ⅵ中的蛋白参与卵孢白僵菌素的合成,分支Ⅶ中的蛋白参与根皮色素A的合成,分支Ⅷ中的蛋白参与镰刀菌素C的合成[14-16].其中,分支Ⅰ、Ⅱ和Ⅲ的亲缘关系较近,推测BbPKS1蛋白可能参与与细胞松弛素和伊快霉素类似的聚酮化合物的合成.
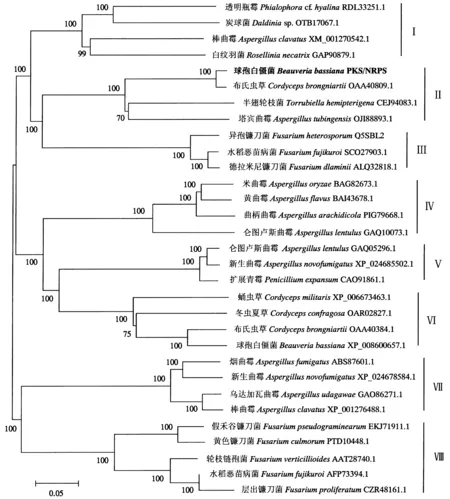
图2 球孢白僵菌中BbPKS1蛋白与其他真菌杂合PKS/NRPS蛋白的聚类分析Fig.2 Phylogenetic analysis of protein BbPKS1 from B.bassiana and other relative fungal PKS/NRPS proteins
2.3 Bbpks1基因在不同培养基上的表达
Bbpks1基因在添加了不同碳、氮源的培养基上的表达有所差别.在添加不同碳源的培养基上,Bbpks1基因表达量表现为乳糖>肌醇>山梨醇>葡萄糖>果糖>甘露醇,而在添加麦芽糖的培养基上不表达(图3A);在添加不同氮源的培养基上,Bbpks1基因的表达量表现为牛肉浸粉>胰蛋白胨>马铃薯浸粉>酪蛋白胨(图3B).
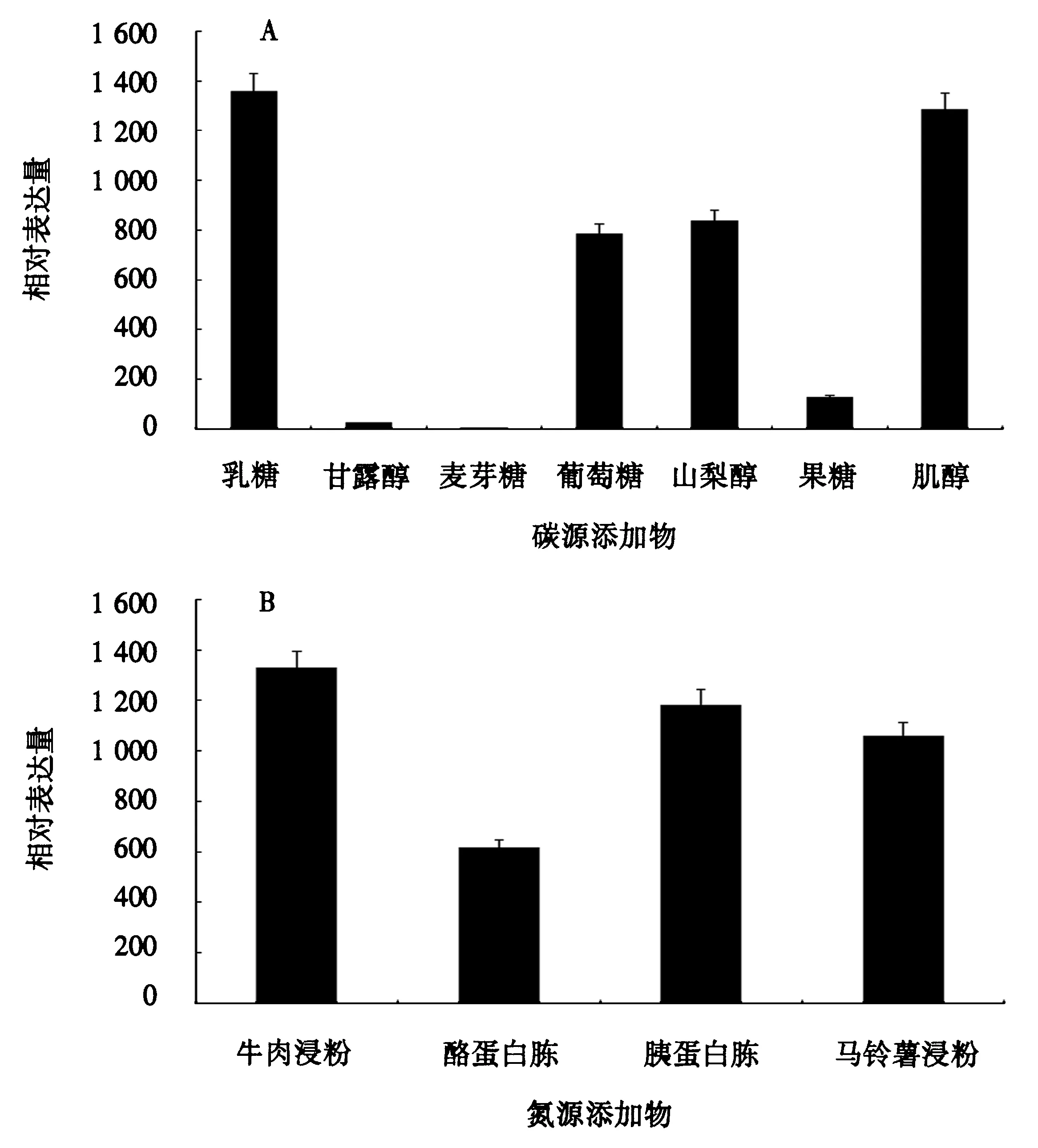
图3 Bbpks1基因在添加不同碳源(A)或氮源(B)的培养基中的表达情况 Fig.3 Expression level of Bbpks1 gene in media with different carbon (A) or nitrogen (B) source
3 讨论
球孢白僵菌是一种可寄生在多种昆虫上且具较强致病性的真菌,已被广泛用于防治森林和农作物虫害[18].球孢白僵菌的发酵液能够产生大量的非核糖体多肽、聚酮等次生代谢产物[11].目前,已报道了参与白僵菌素合成的杂合PKS/NRPS基因(tenS)[11-12],其结构域组成顺序为KS-AT-DH-MT-KR-ACP-C-A-PP-R,与本研究中分支Ⅱ中其他真菌的杂合PKS/NRPS蛋白结构域一致.聚类分析可在一定程度上追踪基因的进化历程,有助于预测基因功能以及其所参与生物合成的终产物[19].本研究通过聚类分析发现,分支Ⅱ中Bbpks1基因所编码的杂合PKS/NRPS蛋白与分支Ⅰ和Ⅲ中催化细胞松弛素、伊快霉素合成的杂合PKS/NRPS蛋白亲缘关系较近,不同分支上蛋白的结构域组成仅在末端释放结构域上存在差别,推测Bbpks1基因所参与合成的聚酮化合物中可能含有2,4-吡咯酮型结构.
基因组介导的次生代谢产物发掘技术为发掘隐藏在基因组中的沉默基因和新生物合成机制提供了一种有效途径.研究发现,通过改变培养基配方、渗透压及培养方式等有可能诱导真菌基因组中隐藏的沉默PKS、NRPS基因的表达[10,20].本研究通过分析Bbpks1基因在不同营养培养基上的表达情况,发现该基因受碳源的影响较大,如在基础培养基中添加乳糖、肌醇后,该基因的表达量较高,而在添加麦芽糖的培养基上不表达;在添加不同氮源的培养基上,该基因均明显表达.这为异源表达该基因培养基的筛选提供了参考.本研究明确了球孢白僵菌中Bbpks1基因所编码的蛋白为杂合PKS/NRPS蛋白,且通过序列和聚类分析预测其所参与合成的化合物结构与伊快霉素、细胞松弛素相似,下一步拟通过异源表达或基因敲除对此进行验证.

