以代谢因子为抑郁症治疗靶点在中药抗抑郁单体开发中的应用*
高充,沈剑刚
(香港大学李嘉诚医学院中医药学院,香港)
现代社会的生活与工作节奏日益加快,以抑郁症为代表的神经精神类疾病发病率呈逐年上升趋势。统计显示,我国重度抑郁症发病率约为3.5%[1]。抑郁症也是目前致死致残的主要疾病之一。所以,针对抑郁症治疗及预防的药物开发是目前我国乃至整个世界神经科学界急需解决的关键问题。
由于抑郁症的相关发病机制尚不清楚,故目前所采取的治疗策略均以缓解患者临床症状为主。抗抑郁药物主要通过影响脑内神经递质含量从而缓解抑郁焦虑症状[2]。而常规抗抑郁药物常会引起各类不良反应,如药物依赖、停药后症状复发及睡眠障碍等[3]。所以,寻找抗抑郁靶点及其神经生物学机制能够为开发新型抗抑郁药物提供新的思路。
海马神经新生(hippocampal neurogenesis)的失调是抑郁症相关的主要特征之一。海马神经新生是一种存在于成年海马内的神经组织可塑性。在海马颗粒细胞区 (dentate gyrus,DG)中,神经干细胞(neural stem cell,NSCs)通过增殖与分化产生新的神经元及神经胶质细胞。在神经新生过程中,NSCs分化成为中间态神经前体细胞 (intermediate progenitor cells,IPCs),随后分化成为成神经细胞 (neuroblasts,NBs)并最终成熟形成成熟神经元。这种神经细胞数目的增加是一种重要的神经组织结构可塑性 (structural plasticity),神经新生在很大程度上影响了哺乳动物对环境与心理压力的适应能力[4]。由于长期过度的压力应激,抑郁症的发病过程往往伴随海马神经新生的降低[5]。研究显示,多数抗抑郁药物均能够逆转抑郁症导致的神经新生异常[6]。因此,研究调控海马神经新生的分子靶点并开发针对该靶点的活性药物有助于开发新的抗抑郁药物。
神经新生在抑郁症发病过程中的作用是多方面的。其中,代谢性疾病如糖尿病和肥胖等能够导致脑内神经新生异常,并能够增加患者神经精神类疾病发病的危险[7-8]。诸多代谢因子也早已被证明是调节海马神经新生的关键因子,同时也是抑郁症治疗的潜在靶点[9]。多种经典的代谢因子包括胰岛素生长因子、肠促胰岛素、多种脂代谢因子等在海马神经新生及相关行为的调控均扮演着至关重要的角色[10-12]。随着实验室证据的积累,各类信号分子也已被陆续证明能够在代谢调控中起着关键作用。而这些代谢因子是否能够调控神经新生也值得进一步研究。APPL2是一种广泛存在于细胞内的衔接蛋白,并且在葡萄糖转运等过程中扮演了关键角色[13]。笔者[14]等研究发现,APPL2能够调节海马神经新生并影响动物情绪行为。进一步研究提示,APPL2可以作为中药单体黄芩苷的靶点从而在其促进海马神经新生及抗抑郁过程中起关键作用[15]。通过调控APPL2水平,黄芩苷缓解了抑郁症小鼠模型的行为学异常并促进了海马及其他脑区的神经新生。因此,笔者将重点探讨代谢因子作为抗抑郁治疗靶点的应用,并以APPL2作为实例展望中药单体对代谢因子的调控及在抗抑郁或神经修复中的应用。笔者将逐一简介经典的代谢因子及其在神经新生和行为学调控中的作用。同时,介绍笔者对APPL2神经新生调控及作为抗抑郁靶点方面的研究工作,为中医药在通过代谢调节从而促进神经新生并治疗抑郁症方面提供新的理论依据与参考。
1 海马神经新生与抑郁症治疗
海马体作为大脑边缘系统中的关键脑区,其高度的神经可塑性使其在调控动物的认知功能及情绪等行为中扮演关键的角色[16-17]。神经新生是一种在组织层面调节神经元数目的结构可塑性。成年海马内NSCs中有一定数量始终保持增殖分化状态,随着细胞增殖,NSC的子代细胞会出现形态改变,形成IPCs,而IPCs则将进一步形成神经前体细胞 (neuroblast,NB),并逐步分化为成熟神经元直至成熟态,并整合进入海马神经网络 (图1)。海马神经新生的异常参与了多种神经精神类疾病的发生发展。例如,在神经退行性疾病及卒中导致的神经损伤中,大脑的自我修复机制能够一定程度上促进海马神经新生,神经新生的功能异常则加重神经退行性疾病或卒中导致的脑功能损伤[18-19]。在抑郁症的发病过程中,患者心理压力过大将导致外周糖皮质激素失衡,严重影响NSCs的增殖分化,从而使海马神经新生减弱[20]。减弱后的海马神经新生被认为是导致大脑无法正确处理心理压力的主要原因。因此,大脑对外界刺激的过度反应导致了丘脑-垂体-肾上腺轴兴奋性增加,进一步加重了压力激素如糖皮质激素的释放,这一过程加速了海马神经新生的抑制,并形成恶性循环从而导致了抑郁症的发生(图2)。因此,促进神经新生是治疗抑郁症的关键。报道显示,通过转基因手段增加海马神经新生足以缓解抑郁症导致的抑郁焦虑情绪[21]。多种抗抑郁药物如氟西汀等均能够促进海马神经新生[22-23]。
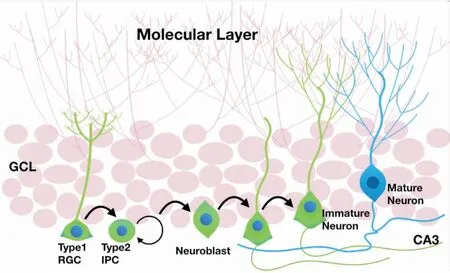
图1 成年海马神经新生过程示意图Fig.1 Schematic diagram of adult hippocampal neurogenesis
除海马外,神经新生同样存在于其他特定脑区如侧脑室和嗅球。NSCs在侧脑室下区(sub-ventricular zone,SVZ)增殖并逐渐成熟形成NBs。这部分NBs通过嘴侧迁移流(rostral migration stream,RMS)逐渐迁移至嗅球区并整合进入嗅觉神经网络[24]。在抑郁症过程中,由于糖皮质激素的过度增加,SVZ区的神经新生也被同时影响并因此影响了动物的嗅觉行为[25]。而嗅觉行为异常则能够增加患者精神压力从而加重抑郁症症状。因此,促进神经新生是抑郁症治疗中缓解抑郁焦虑行为并改善嗅觉功能的关键因素。
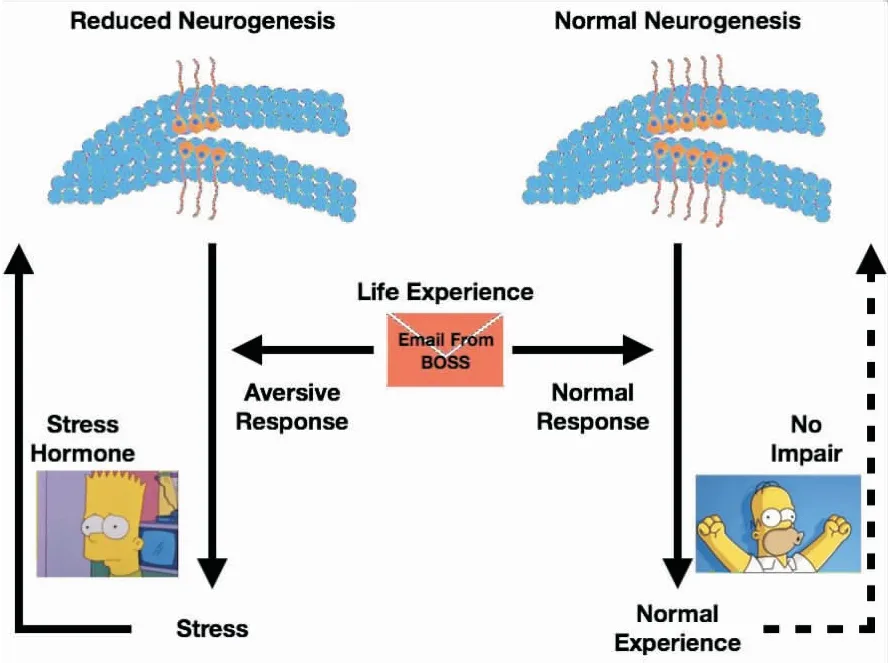
图2 海马神经新生在抑郁症发病中的关键作用Fig.2 Key role of hippocampal neurogenesis in the pathogenesis of depression
2 代谢因子与神经新生
神经新生在多种内源性与外源性因素相互作用下收到严格调控。研究影响神经新生的关键调控因子是寻找抑郁症治疗靶点的有效手段。经典的调控神经新生的内源性分子包括Wnt、Notch、HIF1、NRF2等[26-27]。外源性的信号包括钙离子、神经递质、内皮细胞分泌的血管内皮生长因子等同样能够调控海马神经新生进程[28-29]。大量研究证明,代谢性疾病尤其是糖尿病是导致各类神经精神类疾病的危险因素[30-31]。糖尿病动物模型会出现明显的神经新生水平的降低[32]。与糖尿病发生发展相关的代谢因子如GSK3,胰岛素生长因子1 (insulin-growth factor-1,IGF-1)及胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)等,均参与了神经可塑性调控并在神经退行性疾病及神经精神类疾病发病过程中起关键作用[33-35]。很多经典的代谢信号分子均已经证实能够调控神经新生并可能是神经精神类疾病治疗的关键靶点。
2.1IGF-1 IGF-1是参与胰岛素信号通路的关键分子。重组性IGF-1能降低糖尿病模型中的血糖水平[36]。IGF-1在神经系统中具有广泛的分布[37]。IGF-1参与了多种细胞功能的调节包括细胞生长,能量代谢以及干细胞的分化[36,38]。研究显示,外周注射IGF-1能够显著促进大鼠海马神经元的产生[39]。而侧脑室注射IGF-1能够明显缓解衰老导致海马神经新生的降低[40]。IGF-1同时参与了其他类型神经可塑性的调控,IGF-1高表达转基因小鼠表现出了海马突触新生的显著增加[41]。IGF-1同样是一种抑郁症治疗的关键靶点。有报道显示,抑郁症小鼠模型会表现出外周及海马组织IGF-1水平的降低[42]。而外源性给予IGF-1能够逆转抑郁症模型动物的行为学异常并促进海马区NSC的增殖[43]。
2.2肠促胰岛素(incretins)肠促胰岛素是一种肠道分泌的代谢调节因子,通过激活胰岛素分泌、抑制胰高血糖素产生等起到抑制空腹、降低食欲及进食的作用[44]。大量研究已经证明肠促胰岛素能够作为一种治疗神经精神类疾病的关键靶点。例如,GLP-1和肠抑胃肽 (gastric inhibitory polypeptide,GIP)能够对阿尔兹海默病小鼠模型起到显著的神经保护效应[45-46]。有研究显示GIP是维持海马内一定密度的神经前体细胞、突触前及突触后可塑性的关键分子[47]。而增加血液中GLP-1水平能够显著促进海马神经新生水平[48]。而GLP-1敲除或抑制能够导致小鼠突触可塑性,海马神经新生的显著下降[49-50]。大量研究证明GLP-1类似物及激动剂能够在神经退行性疾病中发挥保护效应[51-54]。而GLP-1激动剂已被证明能够缓解糖尿病并发的抑郁症症状[34]。
2.3脂代谢因子 脂代谢因子的失调参与肥胖、糖尿病等诸多代谢疾病的发病进程[55]。多数脂代谢因子已被证实在神经新生过程的调控中扮演关键角色[56]。研究显示,经典的脂代谢因子如瘦素(leptin)、脂联素(adiponection)等参与了海马神经新生的调控,并能够作为抗抑郁治疗的靶点。
瘦素是脂肪细胞分泌的参与能量代谢与进食抑制的关键脂代谢因子[57]。瘦素在糖尿病发展中起着关键作用,瘦素及其受体敲除的ob/ob和db/db转基因小鼠能够作为理想的糖尿病动物模型[58]。瘦素也参与海马神经新生的调控,报道显示,瘦素能够通过GSK3信号通路逆转糖皮质激素引起的海马神经新生降低并缓解抑郁焦虑行为[59]。给予瘦素3个月能够显著逆转阿尔兹海默病小鼠模型海马神经新生的减少[60]。
脂联素同样参与了海马神经新生的调节。1型和2型脂联素受体均在神经系统中广泛表达[61]。而抑郁症模型中,脂联素水平的降低往往伴随着抑郁、社交障碍等症状的加剧[62]。在海马NSCs中特异性敲除脂联素会显著抑制导致运动调节的抗抑郁行为[63]。不仅如此,脂联素通路中的调控信号同样在细胞生长,代谢及分化等过程中起到了关键的调控作用。
APPL(adaptor protein,phosphotyrosine interacting with PH domain)蛋白是一种重要的代谢调控因子。从细胞信号通路作用角度出发,APPL蛋白是一种衔接蛋白,其包含pleckstrin同源结构域(PH domain)、磷酸酪氨酸结合域(PTB)以及BAR(Bin-Amphiphysin-Rvs)结构域。APPL蛋白已知有APPL1和APPL2两种形式。APPL1被证明参与了包括细胞增殖、代谢调控、癌细胞转移等一系列过程[64-66]。APPL2被证明参与了葡萄糖转运等过程,并且是脂联素通路上的关键调控分子[13]。同时,APPL2还参与了PI3K/Akt的活性调节[67]。这些研究表明APPL2参与了多种生理功能的调节。作为关键的代谢因子,APPL2可能在神经干细胞的调控及其在抑郁症发病中扮演关键角色。笔者的研究首次确认了APPL2对海马其他脑区神经新生的调控,并证明了APPL2能够作为一种促进神经新生和抗抑郁的治疗靶点。
APPL2可能是参与海马神经新生及动物抗抑郁行为的关键因子,为验证该假说,笔者构建了APPL2高表达转基因小鼠。在行为学测试中,APPL2转基因小鼠表现出了显著的抑郁与焦虑行为。同时,在APPL2转基因小鼠的海马组织中,新生神经元的数目、NSCs的增殖和分化,以及新生成神经细胞的成熟均出现了明显抑制[14]。从APPL2转基因小鼠表现的抑郁焦虑行为及显著抑制的神经新生方面,笔者推测APPL2的功能可能与抑郁症导致的海马神经新生降低有密切关联。糖皮质激素受体 (glucocorticoid receptor,GR)是一种广泛表达在神经系统中的、参与调控动物应激行为的关键蛋白。同时,GR的过度活化是连接抑郁症中抑郁焦虑行为与神经新生损伤的关键因素[68]。因此,笔者检测了APPL2转基因小鼠海马中GR的磷酸化水平以探究是否APPL2参与了GR活性的调控[14],结果表明,在基础状态下APPL2转基因小鼠海马中GR磷酸化水平显著高于野生型;并且,不论在基础与应激状态下,APPL2转基因小鼠海马GR活性并未如野生型小鼠一样随着短暂应激出现GR活性的升高。这一结果提示,APPL2过度表达在基础状态下上调了GR的活性并且影响了其对外界应激因素的应答,这种持续性的中枢神经系统GR的过度活化极有可能导致神经新生的抑制。笔者进一步研究发现,GR的特异性抑制剂米非司酮(RU486)能够逆转APPL2过度表达导致的神经新生抑制以及抑郁行为。因此,APPL2是调控GR活性的关键因素[14]。
在成年脑内除海马外,神经新生同样是嗅觉系统即SVZ区及嗅球区的重要特征之一。并且,嗅觉系统的神经新生是调控动物嗅觉功能的重要因素[69]。在抑郁症状态下,过度升高的糖皮质激素能够导致嗅觉系统神经新生的抑制并引起抑郁症相关的嗅觉障碍[25]。而嗅觉障碍也是导致并加重抑郁症症状的关键危险因素[70-71]。笔者的研究进一步证明,APPL2过度表达同样抑制了嗅觉系统的神经新生,并且降低了动物的嗅觉敏感度[15]。同时,笔者在APPL2转基因小鼠的嗅球区检测到了GR的过度活化,证明APPL2在中枢神经系统对GR的调控不仅仅存在于海马组织。传统中药能够为促进海马神经新生及抗抑郁治疗提供丰富的药物资源。同时,多种传统中药单体能够表现出调节代谢功能的作用。而通过明确这些单体的药物机制,能够为进一步拓展其抗抑郁或促进神经再生效果提供理论支持[72]。黄芩是一种能够调节情志并用于抑郁症治疗的药物[73]。作为黄芩中的关键组分,黄芩苷的抗抑郁效应及促神经新生效应已被广泛证实[74-75]。前期研究证明,黄芩苷能够作为一种抗高血糖药物作用于链脲佐菌素诱导的糖尿病模型[76]。黄芩苷同时还具备调节GR活性并缓解抑郁症症状及促进神经新生的效应[75]。然而,APPL2是否为黄芩苷抗抑郁及促进神经新生的关键环节尚未可知。笔者发现,将黄芩苷处理后的APPL2转基因小鼠海马及嗅球区的GR活性显著降低。并且,黄芩苷处理能够逆转APPL2过度表达导致的海马及嗅觉系统的神经新生损伤以及相关的抗抑郁行为及嗅觉敏感性的降低。同时,使用黄芩苷饲处理野生型糖皮质激素诱导的小鼠抑郁症模型则能够降低嗅球与海马组织中APPL2的表达水平[15]。这些结果证明,APPL2是黄芩苷调节抗抑郁行为及嗅觉行为的关键因素。这些结果提示,黄芩苷能够通过调控神经新生同时缓解抑郁症导致的神经精神症状及嗅觉障碍。为证明这一假说,笔者构建了糖皮质激素诱导的野生型抑郁症模型,并利用长期黄芩苷处理以观察抑郁症相关的行为学异常及神经新生变化,结果发现,黄芩苷显著上调了抑郁症模型中海马、嗅球,以及SVZ区中NSC的增殖及分化。并且,行为学测试证明黄芩苷能够缓解抑郁症模型下的抑郁焦虑行为以及抑郁症并发的嗅觉障碍[15]。
综上所述,APPL2作为调控神经新生及动物相关抗抑郁及嗅觉行为的关键因子,其对中枢神经系统GR水平的调控是黄芩苷治疗抑郁症及相关嗅觉障碍并促进海马和嗅觉系统神经新生的重要机制(图3)。
除了直接作用于APPL2外,其他中药单体也已被证明能够作用于APPL2通路相关信号分子。如姜黄素已被证实能够调节体内脂联素信号通路,而脂联素信号同时是APPL2的上游调控信号之一[77-79]。人参皂苷Rg1也以被证实能够调控糖皮质激素受体[80]。其他证据则表明人参皂苷Rg1能够调控PI3K参与的信号通路[81],而PI3K信号也已被证明与APPL2信号密切相关[66-67,82]。这些证据均证实了中药单体在调控APPL2及其相关信号通路中的关键作用,并且这种效应提示了多种中药单体能够通过调控代谢因子从而促进神经新生并缓解抑郁症相关的神经功能紊乱。
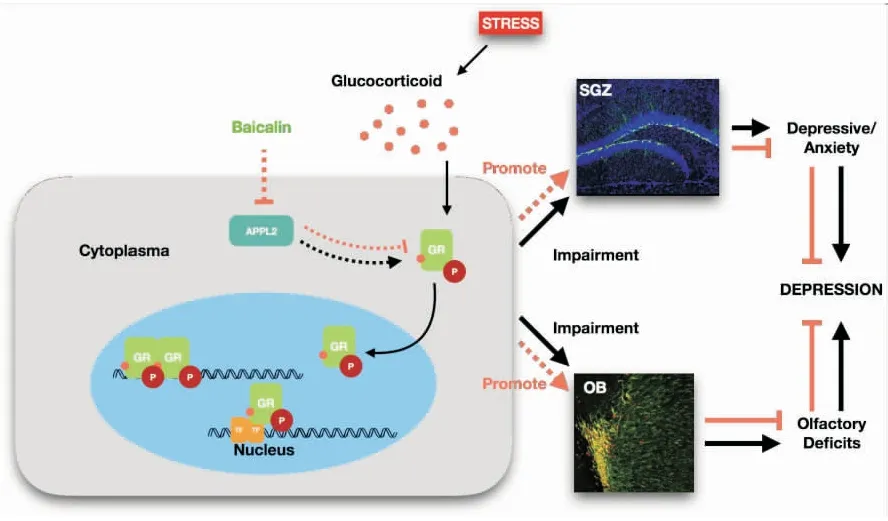
图3 APPL2在抑郁症发病中的关键作用Fig.3 Key role of APPL2 in the pathogenesis of depression
3 结束语
抑郁症是一种复杂的神经精神类疾病,其发生与发展涉及不同类型的神经功能失调,例如神经递质代谢水平的改变、突触可塑性损伤、海马神经新生降低、神经环路调控改变等[23,83-85]。其中,海马神经新生的压抑是抑郁症的主要特征之一,并且多数药物的抗抑郁疗效均不同程度地依赖于其对海马神经新生的改善[86]。代谢性疾病如糖尿病和肥胖等是多种神经精神类疾病如卒中、阿尔兹海默病、抑郁症甚至躁郁症的危险因素[87-90]。这些联系提示代谢因子参与了与动物行为密切相关的神经功能尤其是海马神经新生。通过调控代谢因子的活性与功能同样能够达到治疗这些疾病的效应。所以,研究新的、能够参与调控海马神经的代谢因子有助于新的抗抑郁药物或抑郁症预防方法的开发。
多种代谢因子在神经精神疾病发病中的作用已被广泛研究。笔者的研究首次确定了代谢因子APPL2在神经新生及动物抗抑郁行为中的关键调控作用。不仅如此,笔者同时确认了APPL2可以作为一种抗抑郁及缓解抑郁症导致的嗅觉障碍的药物治疗靶点,并且进一步提出中药单体黄芩苷可以通过作用于APPL2以缓解抑郁焦虑情绪及嗅觉障碍,并促进海马及嗅觉系统的神经新生[14-15]。因此,APPL2是黄芩苷抗抑郁并促进神经新生的关键靶点。值得注意的是,APPL2并非是调节神经再生及缓解抑郁症相关症状的唯一靶点。结合笔者的前期研究及其他实验室证据,APPL2参与了多种信号途径的调控,并且与除抑郁症或代谢性疾病外的多种生理病理过程密切相关[82,91-92]。通过代谢调控的方式,利用中药多途径多靶点的特点则有望通过调控APPL2及相关的信号分子从而起到对神经新生及精神行为持续系统的控制。类似的实验室研究能够为中药复方、提取物及单体在未来疾病治疗应用中提供可靠的证据与指导。
神经干细胞研究是再生医学中的重要领域。药物治疗是临床上治疗神经精神疾病的主要手段,通过结合中药资源寻找调控神经新生的靶点从而完成对成年脑内源性神经干细胞的调控正是一种药物促进神经再生的有效方法。神经新生的调控机制及药物干预的研究不仅能够为抗抑郁药物的开发提供新的思路,同时还能够为治疗神经退行性疾病及卒中后神经修复提供新的靶点和治疗策略。因此,通过研究神经新生的调控靶点,并结合中药单体寻找作用于该靶点的药物,将为再生医学的临床实践提供新的治疗策略和思路。

