高效液相色谱-电感耦合等离子体质谱法测定配方食品中的VB12
刘 杰,龚 蕾,朱晓玲*,彭青枝,张 莉,周陶鸿,江 丰,黄 茜,张小玲
(湖北省食品质量安全监督检验研究院,湖北省食品质量安全检测工程技术研究中心,湖北 武汉 430070)
VB12又称钴胺素,是一种由含钴的卟啉类化合物组成的B族维生素,对维持人体基本机能具有重要的作用[1-2]。VB12无法在人体内合成,且几乎不存在于植物性食品中[3],因此,人体只能从动物性食物中获得。由于人们的饮食结构变化,素食主义者增多[4],导致部分居民出现膳食营养不平衡问题,市面上由此大量涌现各类营养强化食品、保健食品等配方食品,在其中人为添加营养物质VB12,以满足部分人群补充VB12的需求。但目前许多保健食品B族维生素片所添加的VB12含量并不规范,VB12过量摄入会对人体产生一定的毒副作用[5],必须规范控制这类产品中VB12的使用量,并对其中的VB12含量进行准确测定。
对于VB12的检测,至今仍然是国际上食品分析的难题之一。原因主要有两点:一是动物性食品中的VB12存在氰钴胺、羟钴胺、腺苷钴胺和甲基钴胺等多种结构形式[6],传统的分析方法很难反映样品中VB12的实际含量,通常需要采用氰化钾或氰化钠等剧毒试剂将钴胺素异构体(羟钴胺素、甲钴胺素和5-脫氧腺苷钴胺素等)转化为较稳定的氰钴胺素后再进行分析检测,而目前尚未寻找到合适的剧毒试剂替代物,因此方法的适用性受限,难以推广;二是VB12在食品中的含量极低,一般为10-9级,在强化食品中按照国家标准要求也仅约0.6~70 μg/kg[7],对分析方法的检测灵敏度具有较高的要求。另外,VB12通常以VB12-内因子复合物的形式存在,充分提取和分离难度很大,样品中其他化合物以及与VB12相近的水溶性维生素也会对其分离检测造成干扰。
目前,食品中VB12检测的国家标准主要有GB 5413.14—2010《婴幼儿食品和乳品中维生素B12的测定》[8]和GB/T 5009.217—2008《保健食品中维生素B12的测定》[9],所采用的方法为微生物法和液相色谱法,微生物法检测VB12的优势在于具有较高的灵敏度,但缺点主要为其操作过程较繁琐,对人员的技术要求较高,且检测耗时,测定周期需要3 d;液相色谱法主要可用于VB12添加量较高的保健食品的检测,对于低含量食品的检测则受到仪器灵敏度的限制。另外,文献报道的VB12的检测方法还有原子吸收法[10]、毛细管电泳法[11-12]、酶联免疫法[13-14]、电化学发光法[15]、电化学传感器法[16]、液相色谱法[4,17-19]、液相色谱-串联质谱法[20-23]、电感耦合等离子体质谱法[5,24]等,各个方法均存在一定的优缺点,且大多数方法主要针对部分基质进行方法的开发和应用。本研究主要考虑VB12作为一种在食品中应用较普遍的强化营养素,各种VB12强化配方食品及相关的保健食品均需检测该指标,不必将婴幼儿食品、乳品、保健食品及其他配方食品等基质分开建立检测方法。而建立适合各类配方食品中VB12测定的通用分析方法,难点在于各类食品中VB12的含量范围差异较大。因此本研究借助高效液相色谱-电感耦合等离子体-质谱(high performance liquid chromatography-inductively coupled plasma-mass spectrometry,HPLC-ICP-MS)联用技术的高灵敏度与宽线性范围优势,建立适用于各种配方食品中VB12测定方法。由于VB12的不同结构形式的稳定性各不同,其中氰钴胺素相较于其他几种形态(羟钴胺、腺苷钴胺和甲基钴胺等)更为稳定,配方食品中用于营养强化的VB12几乎均为氰钴胺素,因此,直接测定氰钴胺素的含量,就能反映营养强化配方食品中VB12的添加水平,无需使用氰化钾或氰化钠等剧毒试剂进行结构转化。本方法基于VB12结构中含有钴元素,通过测定钴的含量间接反映样品中VB12(氰钴胺素)的含量,与国家标准方法相比,本方法简单、快速、灵敏度高、线性范围广,适用于各种配方食品中VB12的检测,实验结果较为满意,在日常检测方面存在一定的优势。
1 材料与方法
1.1 材料与试剂
强化VB12的果汁饮料、谷物制品、含乳饮料、保健品 市售。
VB12(氰钴胺素) 美国Sigma-Aldrich公司;乙酸铵(色谱纯) 上海麦克林生化科技有限公司;乙腈、甲醇(均为色谱纯) 德国Merck公司;甲酸(色谱纯) 赛默飞世尔科技(中国)有限公司;盐酸、三氯乙酸(均为分析纯) 国药集团化学试剂有限公司;所有用水均为超纯水。
1.2 仪器与设备
DIONEX UltiMate 3000液相色谱仪、iCAP Q ICP-MS仪及工作站 美国赛默飞世尔仪器公司;Milli-Q去离子水发生器 美国Millipore公司;SB25-12DTS双频超声波清洗器 广州市鹏鑫科学仪器有限公司;ME204电子平梅特勒-托利多仪器(上海)有限公司;MS3 Digital涡旋仪德国IKA公司;Centrifuge 5810离心机 艾本德中国有限公司;0.22 μm水相滤膜 天津津腾公司;Oasis HLB柱(6 mL,500 mg) 美国Waters公司。
1.3 方法
1.3.1 HPLC条件
Thermo Fisher Hypersil GOLD C18色谱柱(100 mm×2.1 mm,3 μm);流动相:A为8 mmol/L乙酸铵溶液,B为甲醇(81∶19,V/V)溶液,等度洗脱,流速为0.4 mL/min;柱温24 ℃;进样量20 μL。
1.3.2 ICP-MS条件
选择Co-59作为定量元素,采用KED模式,经调谐仪器主要参数如表1所示。

表1 ICP-MS条件Table 1 ICP-MS experimental conditions
1.3.3 样品前处理
谷物制品:称取试样5 g(精确至0.01 g)于50 mL离心管中,加入25 mL 0.01 mol/L盐酸溶液,涡旋混匀1 min,超声15 min,3 900 r/min离心15 min。取上清液置于50 mL棕色容量瓶中,用水定容至刻度,待净化。
含乳饮料:称取试样10 g(精确至0.01 g)于50 mL离心管中,加入10 mL 40 g/L三氯乙酸溶液,涡旋混匀1 min,超声15 min,3 900 r/min离心15 min。取上清液置于50 mL棕色容量瓶中,用水定容至刻度,待净化。
保健品:称取试样0.5 g(精确至0.01 g)于50 mL离心管中,加入25 mL 0.01 mol/L盐酸溶液,涡旋混匀1 min,超声15 min,3 900 r/min离心15 min。取上清液置于50 mL棕色容量瓶中,用水定容至刻度,待净化。
1.3.4 样品净化
将待净化液通过已活化的固相萃取柱(分别用5 mL甲醇和5 mL水预淋洗活化),用5 mL 7%乙腈溶液将干扰物质从固相萃取柱上淋洗下来,最后用3.0 mL 25%乙腈溶液将目标化合物洗脱,收集全部洗脱液,根据含量稀释洗脱液,过0.22 μm微孔滤膜后,待检测分析。
1.4 数据统计
采用Qtegra、MultiQuant 3.0.2软件处理数据,采用Origin 8.0、Microsoft Excel 2010软件绘图。
2 结果与分析
2.1 方法的可行性
HPLC-ICP-MS法测定样品中VB12的含量,主要是基于VB12结构中含有钴元素,通过测定样品中钴的含量间接推算出VB12的含量。但样品中的钴除来源于VB12,也有可能来源于样品中的含钴杂质以及游离钴,原子吸收法以及ICP-MS法只能对样品中的总钴进行测定,由于没有进行有效分离,检测结果较容易受到样品中无机钴元素的影响而造成测定结果比实际值高。
本实验采用HPLC-ICP-MS法,首先对样品进行HPLC分离,色谱柱选用C18柱,样品中的游离钴离子在C18色谱柱中不保留,从柱中很快洗脱下来,然后通过选择合适的流动相,将样品中的其他非VB12的含钴杂质与VB12目标物有效分离,再进行ICP-MS测定。如图1所示,在45、98 s和270 s均有钴离子响应,根据VB12标准溶液的保留时间进行定性,270 s处的色谱峰即为目标钴离子色谱峰,样品经HPLC分离后可较好地去除样品中的含钴杂质及游离钴对测定结果的干扰,并保证检测数据的准确性,这与文献[25]分析结果一致。
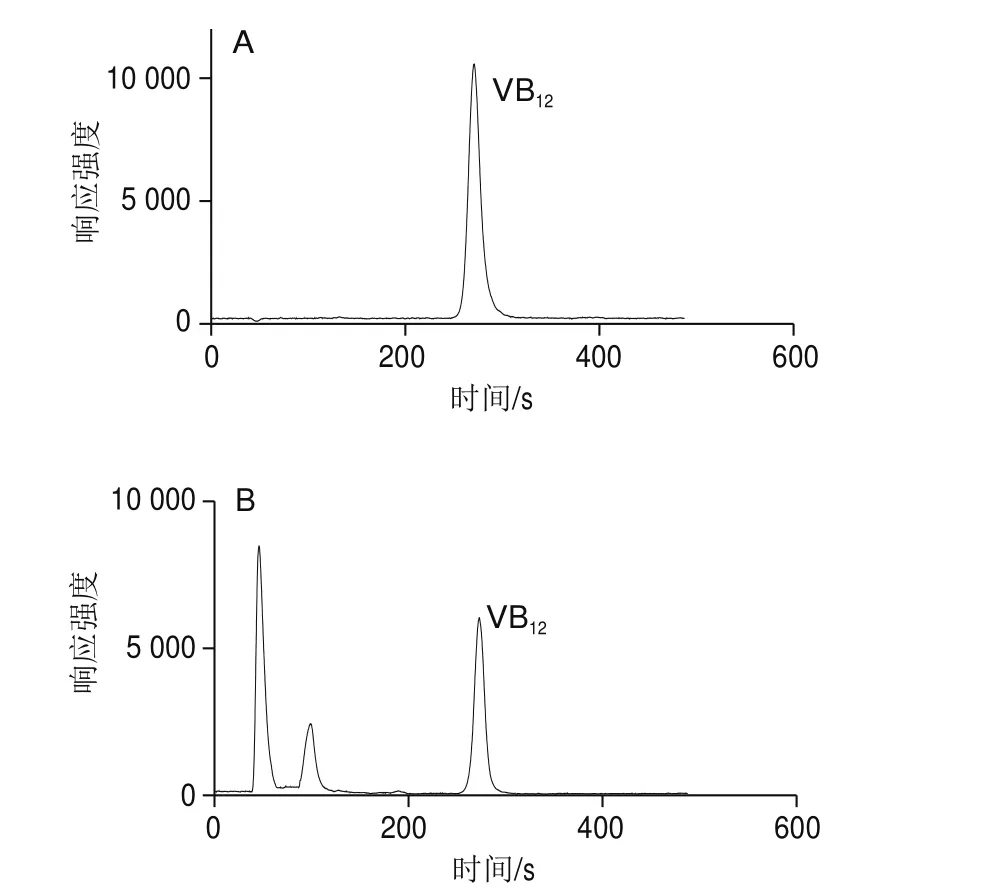
图1 VB12标准溶液谱图(10 μg/L)(A)与样品溶液(B)谱图Fig. 1 Chromatograms of VB12 standard solution (10 μg/L) (A) and sample solution (B)
2.2 HPLC条件的优化
本实验选用C18色谱柱进行样品分离,其流动相中通常会加入一定比例的有机溶剂以保护色谱柱,防止柱填料变性。但在ICP-MS中,有机溶剂的使用可能会导致采样锥锥口处产生碳积,影响仪器的信号稳定性,高浓度的有机溶剂还会导致离子源熄火,影响实验效率并增加仪器的维护成本。虽然有相关实验表明[26],外加氧气可以带走碳,但同时也会导致仪器灵敏度下降。因此,本实验严格控制流动相中有机相的比例,比较流动相中甲醇溶液体积分数分别为15%、19%、23%时,对VB12的分离效果的影响,得到对比色谱图见图2A。当流动相中甲醇溶液体积分数为19%时,VB12在270 s出峰,峰形对称且尖锐;当流动相甲醇溶液体积分数调整为15%时,VB12在色谱柱中的保留性明显增强,保留时间延长至750 s;增加流动相中甲醇溶液体积分数至23%时,VB12在150 s出峰,峰形保持对称尖锐,且仪器的灵敏性没有降低,碳滞留问题没有出现。因此,在保证仪器灵敏度以及信号稳定性的前提下,应尽量选择低有机相比例的流动相进行实验,但综合考虑分析效率,本实验最终选择19%甲醇溶液作为流动相中的有机相。
另外,比较水、8 mmol/L乙酸铵溶液、8 mmol/L乙酸铵溶液(pH 5.0)作为水相流动相时,对VB12分离效果的影响,见图2B。水相流动相中引入8 mmol/L乙酸铵后VB12的峰形稍有改善,经测定,8 mmol/L乙酸铵溶液的pH值约为6.2。有研究报导[27],VB12在pH 4.5~5.0弱酸条件下最稳定,流动相pH值会改变VB12的色谱行为。但本实验发现,将流动相pH值调至5.0时,VB12的响应和峰形几乎没有发生变化,通过48 h稳定性实验,发现调节流动相pH值前后VB12在仪器上的响应没有明显变化,表明流动相pH值为6.2或5.0时,VB12的稳定性没有明显改变,因此,最终选择以8 mmol/L的乙酸铵作为流动相的水相进行实验。
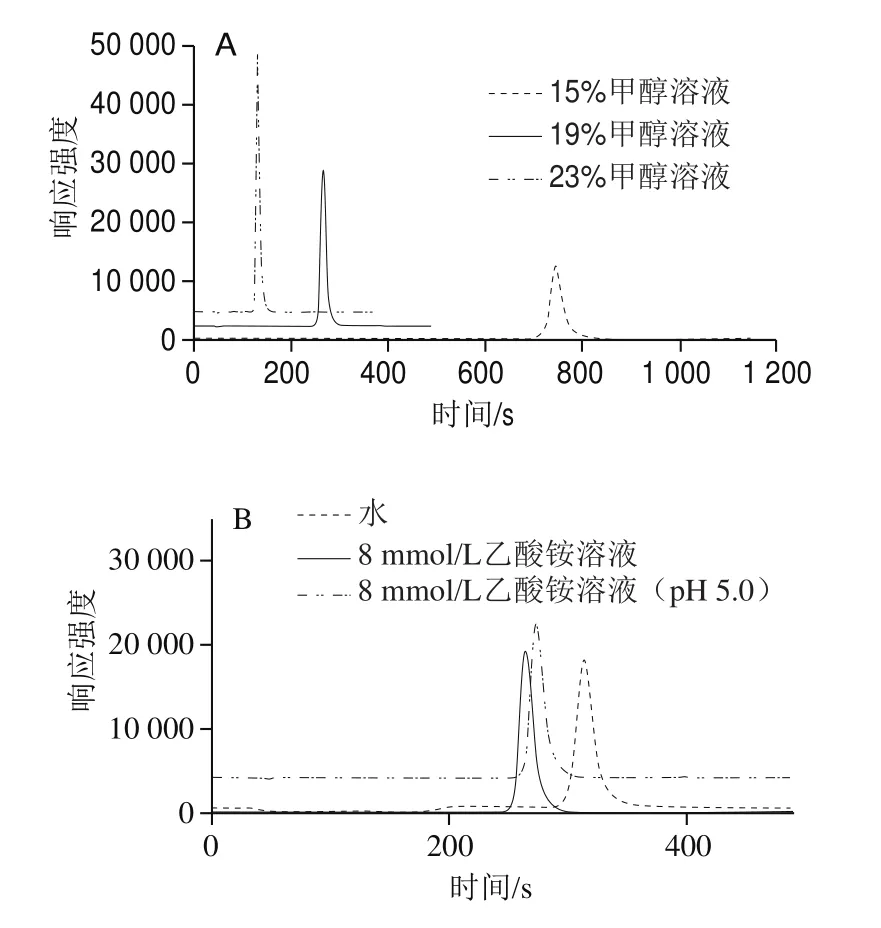
图2 不同甲醇比例流动相(A)和水相流动相(B)对VB12分离效果的对比图谱Fig. 2 Comparative separation of VB12 using different mobile phasesconsisting of methanol (A) and water phase (B)
2.3 样品净化的影响
由于食品基质复杂,研究者通常采用树脂吸附法、透析法、免疫亲和柱、固相萃取柱法等手段进行样品净化,其中固相萃取法以操作简单、高效、可靠、消耗试剂少等优点备受青睐,在许多领域得到广泛应用。本研究比较了实际样品提取液经HLB固相萃取柱处理和不经HLB固相萃取柱处理的实验结果,见表2,相应的对比图谱见图3。

表2 净化对HPLC-ICP-MS检测结果的影响Table 2 Effect of puri fi cation on the results of HPLC-ICP-MS

图3 样品净化前(A)、后(B)对比图谱Fig. 3 Comparative chromatogram of sample before (A) and after (B) purification
由表2可知,样品提取液是否过柱对HPLC-ICP-MS测定VB12的结果几乎无影响。图3显示,样品提取液不过固相萃取柱也能在HPLC-ICP-MS上有较好响应,且与杂质能完全分离。但考虑到提取液过固相萃取柱后,能够有效降低样品中其他杂质的干扰,为减少杂质对色谱柱的损害作用,本实验选择采用HLB固相萃取小柱对提取液进行净化。
2.4 方法验证
2.4.1 线性关系和检出限结果
配制一系列质量浓度的标准溶液在1.3节的仪器分析条件下进行测定,得出VB12在0.1~500 μg/L范围内呈现良好的线性关系,回归方程为y=13 549x+2 782,相关系数为0.999。采用空白样品加标实验确定检出限,逐级稀释至样品溶液中目标峰响应为3 倍信噪比时确定VB12的检出限为0.02 μg/kg。
2.4.2 回收率和精密度结果
选取不同基质、混合均匀的VB12阳性样品,分别对样品进行3 个水平的加标回收率实验,每组实验重复6 次,按照1.3.3节样品前处理方法制备供试品溶液,按仪器条件进行分析,测定VB12的含量,并计算相应的回收率,结果见表3。果汁饮料回收率为96.0%~103.6%,相对标准偏差(relative standard deviation,RSD)为0.4%~2.8%;谷物制品回收率为81.3%~93.2%,RSD为1.4%~3.0%;含乳饮料回收率为84.0%~94.0%,RSD为0.9%~2.7%;保健品回收率为90.7%~103.3%,RSD为3.2%~4.6%,表明方法的准确度和重复性良好,能应用于不同基质的配方食品中VB12的检测分析。
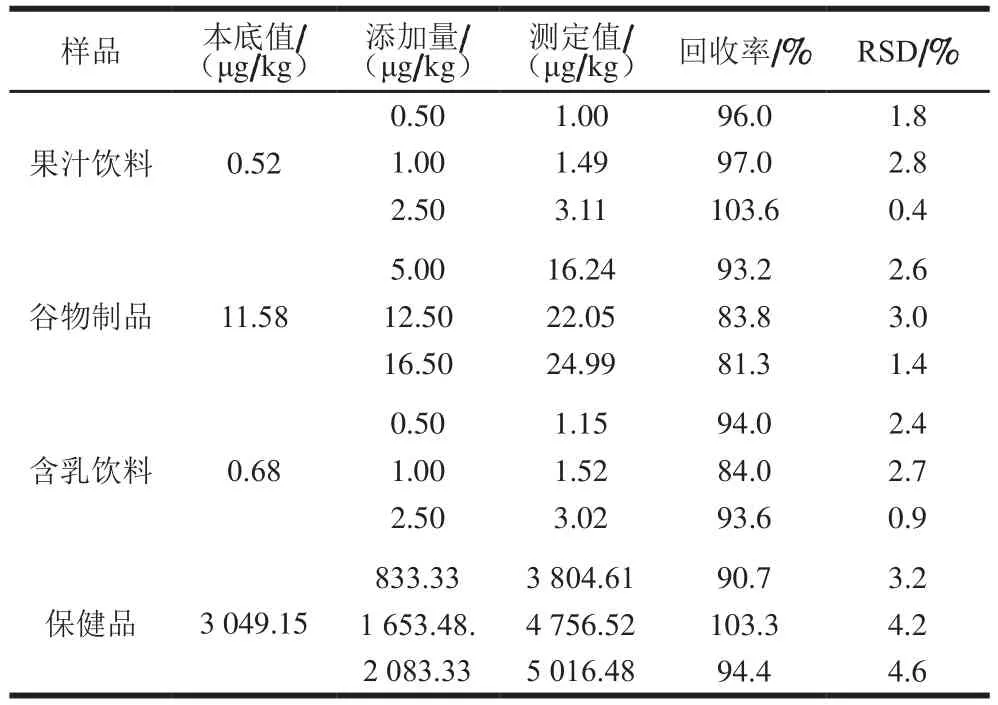
表3 食品中VB12的回收率和RSD(n= 6)Table 3 Recovery and repeatability (RSD) for VB12 from different spiked samples (n= 6)
2.4.3 仪器及标准溶液的稳定性
准确吸取标准品溶液,按仪器条件连续进样6 次,测定峰面积,并计算RSD。得到标准溶液的峰面积RSD小于0.10%,保留时间RSD小于1.0%,表明仪器精密度良好。
准确吸取标准品溶液,在仪器条件下,分别在0、1、2、4、8、12、24、36、48 h进样,以标准溶液的峰面积和保留时间为对象,计算RSD小于2.0%,表明标准溶液在48 h内稳定。
2.5 本方法与其他分析方法的比较
目前,已有检测方法存在问题如下:微生物法灵敏度高,但操作步骤繁琐、分析时间长,较为耗时;分光光度法、毛细管电泳法、HPLC法均不能用于食品中的微量或痕量VB12的测定分析;原子吸收光谱法,ICP-MS法测定VB12的原理也是通过测定钴元素含量间接反映VB12含量,但这些方法容易受到样品中无机钴及其他含钴杂质的影响而造成测定结果比实际值高;酶联免疫法选择性好、灵敏度高、实用性强,其检测结果的准确性通常需要仪器分析法进一步验证。研究表明,HPLC-MS/MS法测定VB12,操作简单、灵敏度准确度高,方法可靠,是目前较为主流的分析手段。因此,将本实验建立的HPLC-ICP-MS方法与HPLC-MS/MS法进行比较,通过重复测试同一实验样品的检测结果进行对比分析。
将2.3节中处理的未经固相萃取小柱净化和经固相萃取小柱净化的样品溶液于HPLC-MS/MS上进行检测。从表4可以看出,样品提取液是否净化对HPLC-MS/MS的测定结果有较大影响,样品1和样品2不经HLB小柱净化所测结果明显低于经HLB小柱净化后所测结果,表明样品基质对于HPLC-MS/MS的检测结果具有一定的影响。将表2与表4进行比较发现,样品经HLB小柱净化处理后,2 种检测方法的测定结果基本一致,表明HPLC-ICP-MS方法的抗基质干扰能力要优于HPLC-MS/MS法。由于大多数产品中VB12的含量均较低,且食品基质相对复杂,对于此类样品的分析,选择抗基质干扰能力强的HPLC-ICP-MS方法进行测定具有一定的优势,且目前HPLC与ICP-MS联用技术已较为成熟,相关的应用报道[28-31]也较多,此联用仪器也逐渐普遍化,可以采用此方法进行相关产品中VB12含量的分析检测以及质量控制。
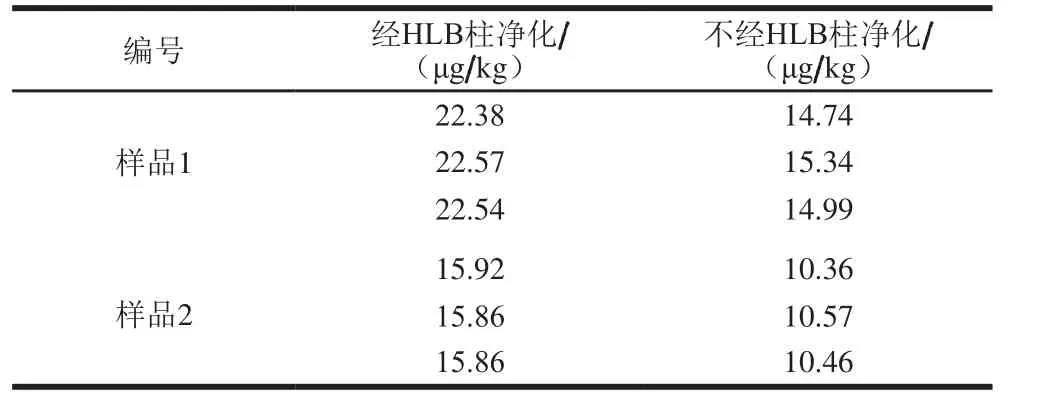
表4 净化对HPLC-MS/MS检测结果的影响Table 4 Effect of puri fi cation on the results of HPLC-MS/MS
2.6 实际样品测定结果
应用建立的方法对购自超市的强化VB12的配方食品(果汁饮料、谷物制品、含乳饮料和保健品)进行检测,结果表明不同果汁饮料中VB12的含量在0.52~1.14 μg/kg之间,部分标示为功能性饮料中的VB12含量高达15.83 μg/kg;谷物制品中VB12的含量在10.85~12.24 μg/kg之间;含乳饮料中VB12的含量在0.68~0.94 μg/kg之间;保健品中VB12的含量较高,测定值为3 049.15 μg/kg,折算后保健品中VB12的含量为4.57 μg/片。
3 结 论
本实验针对不同基质的配方食品中VB12含量的测定方法进行研究,借助于HPLC-ICP-MS联用技术的高灵敏度与宽线性范围优势,建立了适用于各种配方食品基质中VB12含量测定的HPLC-ICP-MS法。通过方法优化,得出VB12的方法检出限为0.02 μg/kg,灵敏度高、峰形较好、分析时间短,可用于实际样品的分析检测。

