钙盐和蛋白质配比对1,3-二油酸-2-棕榈酸甘油酯乳液体外消化的影响
伍文彬,徐雨茜,熊 华,胡蒋宁,朱雪梅,,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.大连工业大学 国家海洋食品工程技术研究中心,辽宁 大连 116034)
母乳是婴儿最理想的优质食物,因为它使必需营养素和特定生物活性成分如生长因子、免疫因子和特异性酶等达到符合婴儿健康生长的黄金标准[1]。在婴儿生长发育过程中,母乳组分及其消化产物在改善消化成熟度、调节微生物群发育和免疫系统中有重要作用[2-4],研究表明,母乳脂肪主要成分1,3-二油酸-2-棕榈酸甘油酯(1,3-dioleyl-2-palmitoylglycerol,OPO)在婴儿早期食物消化吸收中起到关键作用,这与婴儿自身的消化吸收特点密切相关。脂肪的有效消化及利用对婴儿生长和发育至关重要,母乳形成的特定乳液形式可以对特定的营养物质进行高效地包裹、保护和定向运输,使其在胃肠道消化过程达到指定的位置,发挥最大的效果。人乳中的主要成分是乳清蛋白和酪蛋白,而且乳清蛋白和酪蛋白的比例随着泌乳期的不同而有较大的变化,人初乳中的乳清蛋白与酪蛋白的比例是90∶10,常乳中乳清蛋白与酪蛋白的比例是60∶40,到泌乳后期,人乳清蛋白与酪蛋白的比例是20∶80[5],婴儿奶粉蛋白组成基于此特点而设计,并根据不同的需求加以改进。乳清蛋白与酪蛋白具有较好乳化性,利用乳清蛋白和酪蛋白作为乳化剂与OPO型结构脂形成稳定的乳液可以更好地在成分与结构上模拟母乳。已知营养物质的正常消化是保障新生婴儿健康生长和发育的基本功能。因此,从消化原理上对OPO型乳液的消化过程进行相应的解剖和探索,根据消化特性指导功能性食品的开发以及对疾病的科学预防,对婴儿健康成长有着重要的意义。
在人体内,脂肪消化是一个错综复杂的过程。目前,关于脂肪消化的研究主要有体内和体外两大类。诸多学者对影响脂肪消化的因素如胆盐、脂肪酶、乳化剂、矿物离子(Ca、K、Mg)等进行了相应的研究。Armand等[6]通过考察钙离子、脂滴大小、甘油三酯组成对消化后的生物利用率进行了初步研究,但未对机理进行相关探索和阐述。Nguyen等[7]在不含酶的情况下,以凝胶电泳、激光共聚焦、pH-stat等手段,探究酪蛋白、乳清蛋白及大豆蛋白不同乳化剂对模拟婴儿胃肠道体外消化的影响,阐明了不同乳化剂在婴儿胃肠道的基本消化情况。Hu Min等[8]以玉米油为原料、钙离子和钙结合剂为影响因素,考察了脂类在消化过程中,随着钙的增加,脂肪的消化速率以及用于稳定初始脂滴的溶血卵磷脂、酪蛋白酸盐和β-乳球蛋白等不同乳化剂消化速率的能力变化。Sarkar等[9]用体外法定量研究胆盐在乳化脂质消化动力学过程中的作用,解释了由酪蛋白钠和胆盐稳定乳液的消化行为,为食品配方的脂肪消化提供了新的见解。但是以OPO型结构脂作为研究对象,探究蛋白质、钙盐浓度和钙盐种类对OPO型结构脂乳液消化影响的报道较少。
本实验以OPO结构脂为油料制备乳化液,考察不同乳清蛋白和酪蛋白配比、钙盐浓度及钙盐种类等因素,对消化后粒径大小、粒径分布、游离脂肪酸(free fatty acid,FFA)的释放速率和程度及甘油酯组成方面进行体外消化行为研究。
1 材料与方法
1.1 材料与试剂
OPO型母乳替代酯油脂由实验室自制;乳清蛋白(纯度91%~92%) 爱尔兰Glanbia公司;牛奶酪蛋白(纯度99%) 陕西泰克生物科技有限公司;磷酸氢二钾、磷酸二氢钾、氢氧化钠、氯化钠、氯化钙、碳酸钙、叠氮化钠等均为分析纯。
1.2 仪器与设备
ZDJ-4A雷磁自动电位滴定仪 上海书培实验设备有限公司;7890B气相色谱仪 美国安捷伦公司;Ms3000-LV-AeroS激光衍射粒度分析仪 英国马尔文公司;SRH高压均质机 上海申鹿均质机有限公司;Ultra Turrax T18高速分散机 德国IKA公司;PHS-3C精密pH计 上海雷磁新径仪器有限公司;LXJ-IIB型台式离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 OPO结构脂的制备
分别称取底物三棕榈酸甘油酯和茶油FFA以1∶5的物质的量比于具塞三角瓶中,加3 mL/g(总底物)丙酮,50 ℃、200 r/min ZH-S全温振荡器充分振荡混合20 min。待底物溶解充分后,加入10%总底物质量的固定化脂肪酶Lipozyme RM IM于aw为0.53反应6 h,离心除酶,最后得到反应产物OPO甘油酯。
1.3.2 水包油型乳液的制备[10]
分别称取一定质量配比乳清蛋白和酪蛋白混合物置于烧杯中,室温条件加入10 mmol/L、pH 7.0磷酸缓冲液配制成质量浓度为1 g/100mL的蛋白质溶液,磁力搅拌5 h,直至溶解完全,水化过夜。待水化完成后,取出恢复至常温,加入溶解充分的10% OPO油脂混合均匀,在12 000 r/min条件下进行高速分散2 min,随后在30 MPa条件下高压均质2 min,循环3 次,得到新鲜乳液。为抑制微生物的破坏,可加入0.02 g/100 mL的叠氮化钠于新鲜乳液中,最后置于4 ℃冰箱中备用即可。
1.3.3 OPO型乳液体外模拟消化
相较于成人,婴幼儿的胃肠道消化环境与之有较大区别。因此,在根据Nguyen[7]和De Oliveira[11]等对胃肠道消化特点的描述,稍作修改进行体外消化模拟。
1.3.3.1 胃模拟液的消化
用0.1 mol/L HCl溶液将含有0.2 g NaCl溶液pH值调至5.5,配制成胃液。待胃液配制完全,加入1.3 mg/mL胃脂肪酶和1.5 mg/mL胃蛋白酶,在37 ℃磁力搅拌15 min,备用。取一定乳液于烧杯中,分别加入不同浓度(0、5、10、20 mmol/L)的CaCl2和20 mmol/L的不同钙盐(乳酸钙、柠檬酸钙、氯化钙、碳酸钙),在37 ℃预热搅拌15 min,使其充分溶解。最后将预处理的乳液与胃液以2∶1的体积比分别取出,用0.1 mol/L HCl溶液调pH 5.5,未消化的样品为G0,混合进行胃消化30 min,记为G30。在模拟胃消化过程中,用0.1 mol/L NaOH溶液滴定,保持体系pH值始终维持5.5,记录不同时间NaOH消耗的量。为减少误差,每个样品测量3 次,取3 次重复测量平均值。
1.3.3.2 肠模拟液的消化
用0.1 mol/L HCl溶液将含有150 mmol/L NaCl、39 mmol/L K2HPO4的溶液pH值调至6.5,配制成肠液。待肠液配制完全,加入1.875 mg/mL胆盐,0.6 mg/mL胰酶,在37 ℃磁力搅拌15 min,备用。将上述消化30 min的模拟胃液作为起始原料,用0.5 mol/L NaOH溶液调pH 6.5,与预处理肠液按体积比1∶1进行混合消化120 min。在此期间,用0.1 mol/L NaOH溶液滴定,始终保持体系pH值维持6.5,记录不同时间NaOH消耗的量。在开始肠消化0(G30)、30(I30)、60(I60)、90(I90)、120 min(I120)收集消化样品,于80 ℃进行灭酶5 min,停止反应。为减少误差,每个样品测量3 次,取3 次重复测量平均值。
1.3.4 乳液粒径的测定[12]
采用激光衍射粒度分析仪检测原乳液和胃肠消化乳液的粒径大小和分布。对于分散相,乳液的折射率为1.59;连续相,水的折射率为1.33。将乳液逐滴分散至装有去离子水的测量池中进行超声搅拌,至遮蔽率达到15%。测量粒度值用d(0.1)、d(0.5)、d(0.9)和D[4,3]表示。前3 个值表示存在于颗粒总数的10%、50%和90%以下的颗粒群的大小。D[4,3]为大颗粒体积平均值的表征。为减少误差,每个样品测量3 次,取3 次重复测量平均值。
1.3.5 OPO母乳替代脂消化率的测定
脂肪的消化率由脂肪酸的释放率表示。乳液在消化过程中释放FFA的百分比由中和FFA所需的NaOH物质的量除以可由三酰甘油产生FFA物质的量计算(假定每1 个甘油三酯分子产生2 FFA)。释放率计算公式如下:
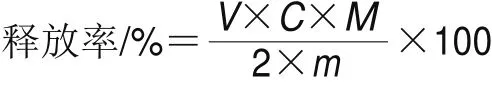
式中:C为滴定消化液NaOH的浓度/(mol/L);V为中和乳液消化释放FFA所需NaOH的体积/mL;M为OPO油脂的平均摩尔质量/(g/mol);m为消化乳液中加入的油脂量/g。
1.3.6 消化产物脂肪酸分析
根据Bligh等[13]提取脂肪的方法,用氯仿-甲醇溶液对模拟胃肠道消化液进行脂肪的萃取。将萃取的混合液振荡均匀,静置分层(有机层和水层),取有机层旋蒸除去溶剂,得到提取物FFA、甘油一酯(monoacylglycerol,MAG)、甘油二酯(diacylglycerol,DAG)和甘油三酯(triacylglycerol,TAG)。利用薄层色谱对脂肪进行水解产物的分离,刮取所需FFA和MAG条带,甲酯化,然后对消化产物FFA和MAG进行气相色谱分析。
1.4 数据分析
2 结果与分析
2.1 CaCl2对乳液脂质消化的影响
2.1.1 体外模拟脂质消化动力学分析
本实验主要从胃肠道消化系统,较为全面地研究肠内组分(钙)和外在因素(乳化剂)对OPO型乳液脂质体外模拟消化的影响。从图1a~c可知,在相同乳化剂配比、不同CaCl2浓度的情况下,随着CaCl2浓度的增加,OPO型乳液脂质的生物利用率提高。在胃消化初始阶段,0∶10乳化剂配比的脂质消化速率大于10∶0和6∶4,随着消化的进行,在低于20 mmol/L CaCl2的浓度下,3 组不同乳化剂配比乳液均在5 min左右,FFA释放率达到饱和,除10∶0乳液(10 mmol/L CaCl2)在10 min时,FFA释放率骤然增加。产生这种现象的原因可能是由酪蛋白在胃中的消化机理造成的。酪蛋白在胃酸的作用下,易形成凝块,影响脂质的消化[14]。图1d显示,在20 mmol/L CaCl2浓度下,随着乳清蛋白-酪蛋白配比的减少,0∶10乳液FFA释放率最低,6∶4乳液次之,10∶0乳液FFA释放率最高,但与6∶4乳液FFA释放率大体一致,相差甚少。此研究结果与Thompkinson等[15]报道相符合。
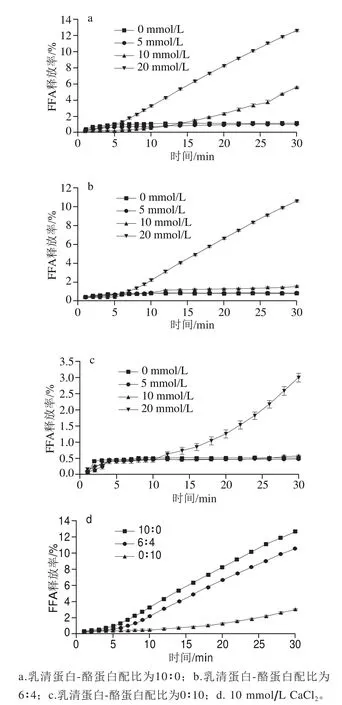
图1 乳化剂配比对OPO型乳液体外模拟胃消化过程FFA释放率的影响Fig. 1 Effect of emulsifier ratio on FFA release rate from OPO emulsions in the presence of 20 mmol/L CaCl2 during in vitro simulated gastric digestion
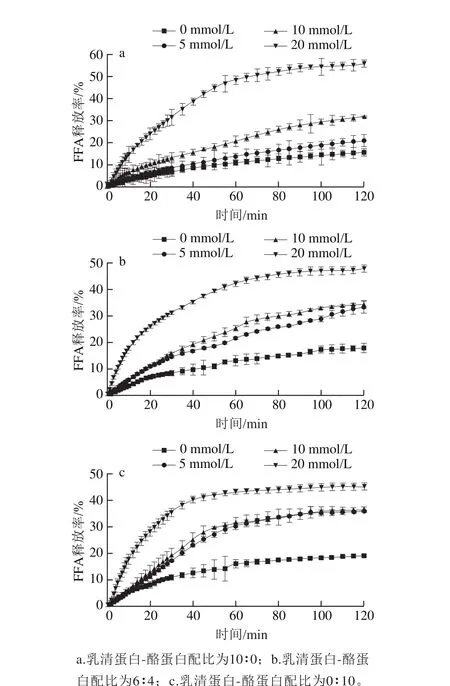
图2 不同CaCl2浓度下不同乳化剂配比乳化乳液体外模拟肠消化过程的FFA释放率Fig. 2 Release rate of total free fatty acids from emulsions stabilized with different whey protein-casein mixtures at different CaCl2 concentrations during in vitro simulated intestinal digestion
由图2可知,3 组不同乳化剂配比乳液,消化前期消化速率依次为10∶0<6∶4<0∶10。在较长的消化时间下,无论是否含有钙,3 组乳液中FFA释放的速率都大体相似,趋于平缓。在浓度为20 mmol/L CaCl2的作用下,3 组乳液最终消化程度依次为10∶0(55.69%)>6∶4(47.82%)>0∶10(45.12%),消化程度变化不大,可能与钙对乳液特性的影响有关,因为钙是通过絮凝影响乳液稳定性[16-17]。总之,在整个肠消化过程中,3 组不同乳化剂配比乳液在不同CaCl2浓度下,FFA液体外模拟肠消化过程的FFA释放速率及程度均随CaCl2浓度的增加而增加,说明钙对脂质的消化有促进作用[18]。产生这种现象的主要机理是:在肠消化过程中,脂质在脂肪酶的进攻下,水解成MAG、DAG和FFA。随着消化程度增加,水解产物FFA于油-水界面不断积聚阻碍脂肪酶进攻脂滴,减少吸附位点,抑制脂肪酶活性,从而降低脂质消化率。而钙离子可以与水解 产物FFA形成脂肪酸钙皂,通过增加低熔点脂肪酸的极性促进其溶解,或与高熔点脂肪酸生成不溶性的脂肪酸 钙皂沉淀,将FFA从脂滴表面移除,为脂质的进一步消化提供包被点[19-20]。因此添加钙离子等营养素可以在一定程度上促进脂肪的消化。
2.1.2 体外模拟脂质消化产物脂肪酸组成分析
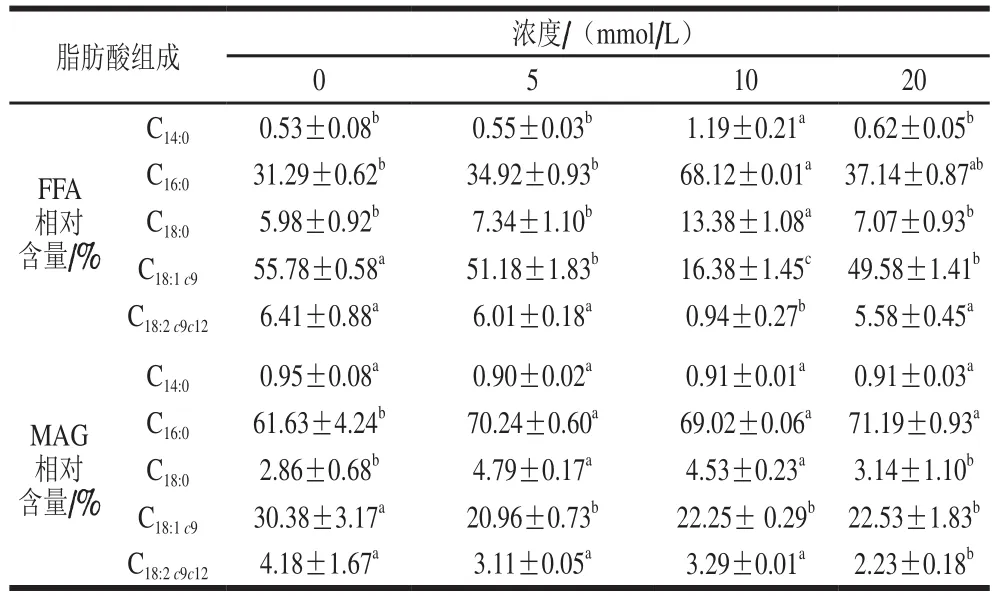
表1 乳清蛋白-酪蛋白配比6∶4乳液体外模拟胃肠消化后FFA和MAG脂肪酸组成Table 1 Free fatty acid and monoglyceride composition of emulsion made with a 6:4 mixture of whey protein and casein as emulsifier during in vitro simulated gastrointestinal digestion
体外模拟脂质消化过程中,由于乳液特殊的运输体系和包装功能,引起学者对脂质消化速率及营养利用率产生极大兴趣。作为营养成分OPO型油脂的直接载体,FA组成分析是最为关键的评价指标。已有研究证明脂质的FA组成及结构差异对其乳液消化有一定影响[21]。从表1可知,6∶4乳液在胃肠消化后,随着CaCl2浓度的递增,无论是FFA还是MAG脂肪酸组成,C16:0和C18:1c9含量最高,与OPO型油脂FA成分一致[22]。在0~20 mmol/L CaCl2浓度范围内(除10 mmol/L CaCl2),对于消化水解产物FFA和MAG,C16:0和C18:1c9相对含量分别为C16:0(31.29%~37.14%)<C18:1c9(49.58%~55.78%),C16∶0(61.63%~71.19%)>C18:1c9(20.96%~30.38%)。产生这种结果主要归因于OPO型油脂的FA结构。在母乳脂肪中,饱和FA(C16:0、C18:0)主要酯化在Sn-2位,而不饱和FA(C18:1c9、C18:2c9c12)主要酯化在Sn-1,3位,这种结构有利于婴幼儿更好地消化吸收,减少能量的损耗和矿物质的流失[23]。如图3所示,对于消化水解产物FFA而言,在不含CaCl2、肠消化(I30~I120)过程中,不饱和FA(C18:1c9、C18:2c9c12)随消化时间的延长,FA含量缓慢增加,饱和FA(C14:0、C16:0、C18:0)则与之相反。对于含有20 mmol/L CaCl2、肠消化(I30~I120)过程中,饱和与不饱和FA的变化趋势均不明显,可能是因为在肠消化过程中,Ca2+与水解产物饱和FA反应,生成难溶性沉淀物,不利于脂质生物利用[10]。其次,含有CaCl2和不含CaCl2的水解产物FFA和MAG,其FA组成是没有区别的,且C16:0和C18:1c9的百分比大小与表1相类似。
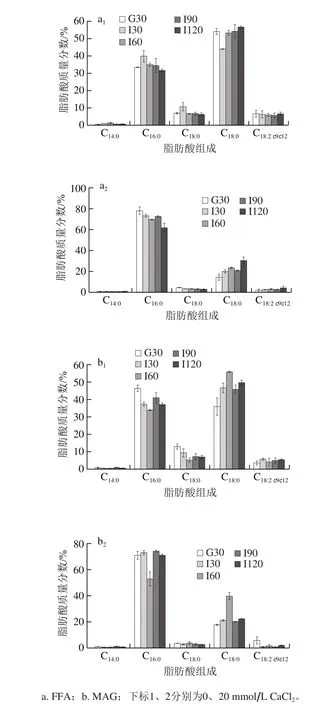
图3 乳清蛋白-酪蛋白(6∶4)乳液体外模拟胃肠消化过程脂肪酸组成Fig. 3 Free fatty acid and monoglyceride composition of emulsion made with a 6:4 mixture of whey protein and casein as emulsifier during in vitro simulated gastrointestinal digestion
2.1.3 体外模拟脂质消化平均粒径分析

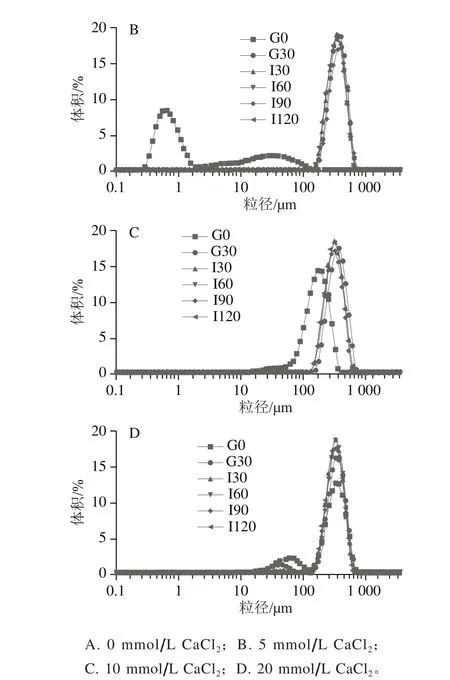
图4 乳清蛋白-酪蛋白(6∶4)乳液在不同钙盐体外模拟胃肠消化前后过程的粒径分布Fig. 4 Particle size distribution of emulsion made with a 6:4 mixture of whey protein and casein as emulsifier during in vitro simulated gastrointestinal digestion
脂质在消化过程中,脂滴的粒径大小及分布是评价乳液稳定性的重要标尺。脂滴大小决定脂肪酶吸附位点数目即与脂滴表面积的接触程度,影响婴儿配方食品体外消化过程中的流变行为[24]。因此,研究脂滴的粒径大小及分布对婴幼儿配方奶粉的设计有一定的指导作用。由图4可以看出,在不同CaCl2浓度下,新鲜乳液的平均粒径均小于胃肠消化后的乳液,尤其是未加CaCl2的乳液平均粒径范围仅在0.1~1 μm,胃肠消化后平均粒径范围均在10~1 000 μm,表明Ca2+与脂质水解产物FFA反应,形成大颗粒物质[18]。在胃肠消化过程中,各乳液呈现出双峰现象,随着Ca2+浓度的增加,双峰现象趋于明显。
表2数据表明,随Ca2+浓度的增加,新鲜乳液的d(0.1)、d(0.5)、d(0.9)值均增加,在加入胃肠消化液后,平均粒径显著增大。研究显示,未加CaCl2乳液样品d(0.9)从0.62 μm(G0)急剧上升到507 μm(G30),而后缓慢下降至453 μm(I120),这主要是因为开始加入胃肠消化液后,消化酶水解脂质产生FFA,与界面层蛋白发生竞争,可能通过“造山运动”破坏蛋白结构,脂滴聚集造成粒径增大,随后聚集脂滴在消化酶的作用下分解,出现小、中等颗粒,促使粒径变小[25-26]。对于加入CaCl2乳液的样品,d(0.9)均从G0上升而后缓慢下降,但上升速度均远小于未加CaCl2乳液样品,证明Ca2+在未消化时,通过静电屏蔽作用与阴离子蛋白发生络合,使得脂滴聚集[27]。
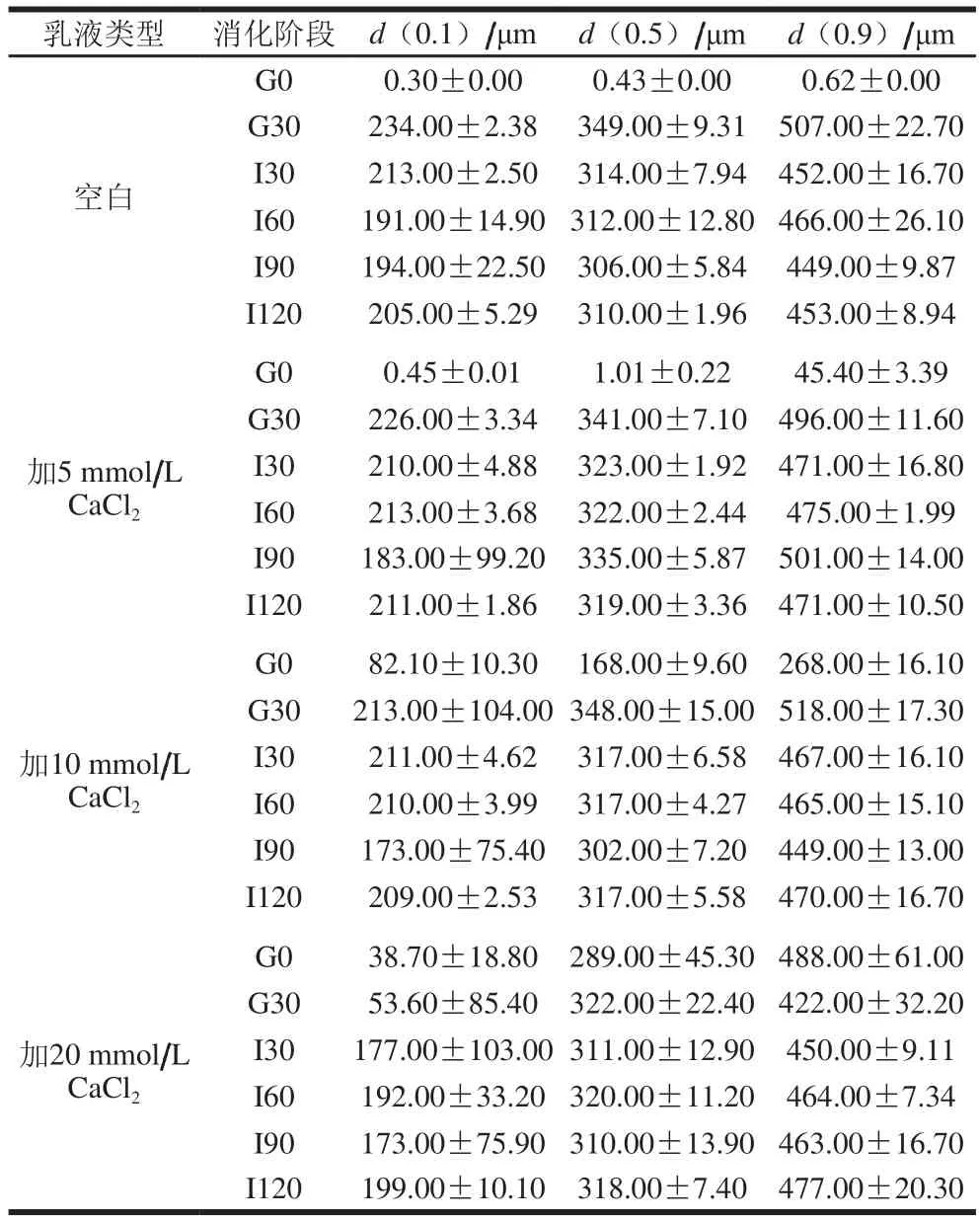
表2 不同CaCl2浓度下乳清蛋白-酪蛋白(6∶4)乳液体外模拟胃肠消化前后的粒度分布Table 2 Particle size distribution of emulsion made with a 6:4 mixture of whey protein and casein as emulsi fi er during in vitro simulated gastrointestinal digestion
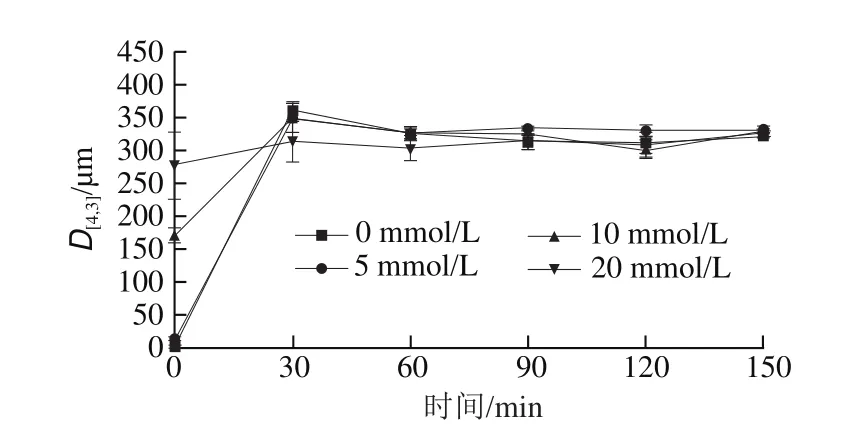
图5 不同CaCl2浓度下乳清蛋白-酪蛋白(6∶4)乳液体外模拟胃肠消化前后的体积平均D[4,3]分布Fig. 5 Volume mean diameter D[4,3] of emulsion made with a 6:4 mixture of whey protein and casein as emulsi fi er during in vitro simulated gastrointestinal digestion
如图5所示,在6∶4乳液样品中,初始粒径随Ca2+浓度的增加而增加,D[4,3]分别为0.45、13.7、171、277 μm。在胃消化阶段(0~30 min),不同浓度的CaCl2乳液平均粒径急剧上升,其0、5 mmol/L CaCl2乳液的上升速率最快,20 mmol/L CaCl2乳液最慢。随着消化时间的进一步增加,乳液平均粒径缓慢下降,几乎保持恒定。这与Ye Aiqian等[28]观察的结果类似。
2.2 不同钙盐对乳液脂质消化的影响
据GB 14880—2012《食品营养强化剂使用标准》,钙营养强化剂有可溶性钙和难溶性钙之分[29]。目前国内使用的钙营养强化剂主要是碳酸钙,国外则是磷酸钙。由于种种原因,外源性钙易缺乏、吸收率低,影响机体有效的消化吸收。因此,添加乳酸钙、柠檬酸钙、氯化钙、碳酸钙对脂质体外消化进行模拟,有助于提高对添加钙脂质消化功能和控制递送脂肪酸食物乳剂配制的理解。

图6 乳清蛋白-酪蛋白6∶4、CaCl2 20 mmol/L乳液体外模拟胃消化(A)和肠消化(B)过程的FFA释放率Fig. 6 Percentage of FFA released from emulsion made with a 6:4 mixture of whey protein and casein as emulsifier and 20 mmol/L CaCl2 during in vitro simulated gastrointestinal digestion
如图6A所示,在胃消化10 min内,氯化钙和乳酸钙FFA释放速率缓慢增加,而后骤然加快,在30 min时达到最大值,即氯化钙和乳酸钙FFA释放率分别为3.01%和2.98%。相反,碳酸钙和柠檬酸钙在整个胃消化阶段都相对平缓,几乎未进行脂质消化。
在肠消化阶段,由图6B可知,随着消化的进行,无论是可溶性钙还是难溶性钙FFA释放程度均随消化时间的延长而增加,可能是因为脂质分解产生FFA使pH值降低,促使Ca2+从不同钙盐中释放[10]。在30 min消化内,不同钙盐的FFA释放速率和程度次序为:柠檬酸钙>氯化钙>乳酸钙>碳酸钙。消化40 min时,氯化钙和乳酸钙的FFA释放速率和程度大体一致,趋近饱和。柠檬酸钙FFA释放率达到82.42%,为4 组钙盐中消化速率和程度最高。碳酸钙的FFA释放速率和程度在4 组不同钙盐中最低,主要因为碳酸钙是难溶性钙盐,在肠消化过程中Ca2+释放少,但在整个肠消化过程中FFA释放率仍有39.14%,说明与不添加钙的乳液相比,所有钙盐均在一定程度上提高脂质消化的速率和程度。同时结果也表明,通过添加钙来促进脂质消化与钙盐在水中的溶解度密切相关[30]。
3 结 论
本实验主要目的是研究不同钙浓度及不同钙盐对OPO型油脂乳液体外模拟消化的影响,为设计和研发婴幼儿配方奶粉提供理论依据和技术支持。研究结果表明,在同种乳化剂配比、不同CaCl2浓度条件下,OPO型油脂乳液的FFA释放速率及程度均随CaCl2浓度的增加而增加。体外模拟OPO型油脂乳液脂质消化动力学数据显示,乳清蛋白-酪蛋白配比6∶4乳液,消化产物FFA和MAG主要由PA和OA组成。消化产物FFA中的PA含量小于OA含量,MAG脂肪酸成分含量与之相反。这主要与OPO型油脂构型有关,利于婴幼儿消化吸收。而研究中考察的乳酸钙、柠檬酸钙、氯化钙、碳酸钙对乳液脂质消化的影响与其他研究者报道结果一致,即柠檬酸钙>氯化钙>乳酸钙>碳酸钙。产生这种结果主要与不同钙盐在水相中的溶解度有关,溶解度高则解离的Ca2+多。在脂质消化过程中,解离的Ca2+作用甘油三酯水解物FFA,可增加消化酶作用脂滴的位点数目,提高OPO型油脂乳液消化率。因此,探讨不同钙浓度及不同钙盐对OPO型油脂乳液体外模拟消化的影响具有一定的现实意义。

