激素治疗婴幼儿隐睾症对血清性激素影响
王浩,付伟
(广州市花都区妇幼保健院,广东 广州 510800)
0 引言
隐睾症(cryptorcidism) 又称睾丸下降不全, 是小儿外科常见的先天性畸形。足月儿发病率2 %-4 %[1]。其发病率呈上升趋势。婴儿生后6 月内仍有可能自行下降,超过6 月几乎无再下降可能。1 岁后的发病率降至1 %。2018 年7 月小儿外科学分会泌尿外科学组结合国内外科最新临床进展形成专家共识,制定了适合中国国情的隐睾诊疗指南。该指南指出出隐睾的激素治疗开始年龄建议在6 月龄(校正年龄),最好在12 月龄前,不要超过18月龄[2]。激素治疗目前国内主要应用人绒毛膜促性腺激素(HCG)肌肉注射治疗。HCG 治疗隐睾是使患儿体内睾酮(T)水平升高,从而作用于睾丸引带、睾丸、输精管、阴茎、阴囊等雄激素受体,促进它们继续生长发育,达到治疗隐睾的目的。阴囊局部外用睾酮乳膏可促进隐睾患者发育不良阴囊的继续发育,同时对隐睾的睾丸下降起到辅助治疗的作用。本研究对两种激素治疗方法对患者血清性激素包括雌二醇(E2)、睾酮(T)、促黄体生成素(LH)的影响进行比较分析。
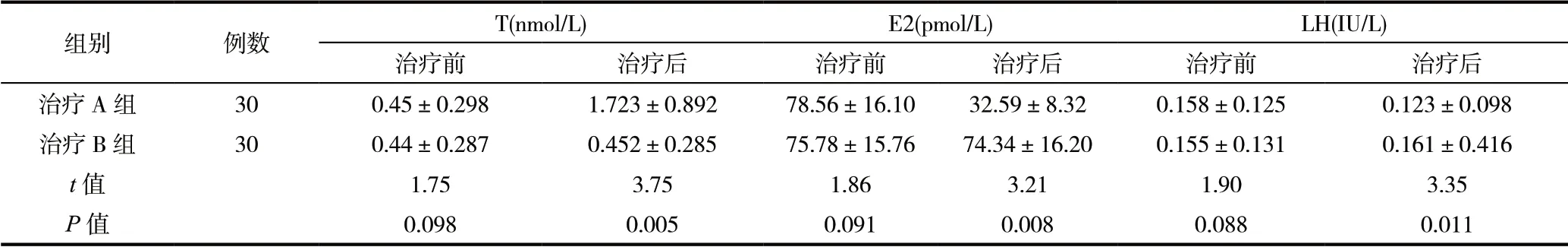
表1 治疗A 组及治疗B 组治疗前后血清性激素变化
1 资料与方法
1.1 纳入试验病例的数据
1.1.1 纳入标准
①年龄6 个月,且出生广东地区的单侧隐睾症患儿;②体格检查为单侧隐睾症,睾丸与腹股沟可扪及,但不能推入阴囊;③既往未接受过治疗。
1.1.2 排除标准
①无其他畸形或内分泌疾病;②睾丸萎缩、缺如;③不可触及的隐睾、异位睾丸。
1.2 试验风险管理及失访处理
对纳入的试验患者家属,在治疗前告知药物治疗可能带来的副作用,如骨骺早闭,阴茎发育,局部毛发生长,皮肤色素沉着等,目前的主要治疗手段为手术治疗。如激素治疗失败仍需手术,试验中出现严重药物不良反应停止治疗的;家属自行中止治疗,均作失访病人处理。
1.3 具体方法:
将从2016 年5 月至2019 年3 月将符合条件的60 名患者随机纳入2 个组别,治疗A 组和治疗B 组。两组患者为随机分配,纳入治疗患者在治疗前一般资料比较统计学无明显差异(P>0.05)。治疗A 组患者接受HCG 标准治疗,剂量为每次1000 IU,肌肉注射,每周2 次,共10 次,总剂量为10000 IU;治疗B 组婴幼儿接受阴囊局部外涂1 %睾酮乳膏,每日2 次,每次3 mg,治疗时间5 周。在激素治疗前及激素治疗结束后各采集血样,分离血清,检测雌二醇(E2)、睾酮(T)、促黄体生成素(LH)水平。采用SPSS 21.0 软件对治疗结果进行统计学分析,应用t 检验进行比较。
2 结果
纳入试验的患者共6 0 例,左侧隐睾2 8名(4 6.6 %),右侧隐睾32 例(53.3 %)。完成最后随访的婴幼儿为60 例,各组治疗前后,血清激素水平如下表。治疗前各组T、E2、LH 数值符合正态分布特点。采用配对样本t 检验方法进行比较,治疗A 组与治疗B 组治疗前,T 值、E2 值及LH 值差异无统计学意义(P>0.05),治疗后,T 值、E2值及LH 值差异有统计学意义(P<0.05),治疗A 组T 值明显增高,E2值有明显降低,LH 值较治疗前降低;治疗B 组治疗前后血清性激素对比差异无统计学意义(P>0.05)如表1。
3 讨论
人类的睾丸腹股沟阴囊下降发生于生前[3],研究表明,在此阶段下丘脑、垂体、性腺任何一环节异常均可导致隐睾的发生,隐睾病因复杂,一般认为与内分泌因素和分子因素有关[4]。完整的下丘脑-垂体-性腺轴是睾丸下降的前提[5]。雄激素不足是隐睾发生的重要因素之一。隐睾的HCG 治疗始于1973 年,其理论基础便基于此。HCG 的化学结构与LH 类似,可以起到与LH 相似的作用,刺激睾丸的间质细胞合成分泌睾酮[6]。本研究中HCG 治疗组治疗前后血清睾酮明显增高支持此理论基础,而此组LH 有所降低是血清睾酮升高,下丘脑-垂体-性腺轴负反馈调节的结果。HCG 促进睾丸下降不完全依耐雄激素水平升高,其对E2抑制睾丸下降及睾丸损害起到阻碍作用。HCG 治疗组E2降低可能是睾酮对E2合成有抑制作用。而外用睾酮乳膏是通过局部给药,提高局部雄性激素水平,而起到促进睾丸下降、阴囊发育的作用。本研究显示睾酮治疗组血清学变化无统计学意义。另研究表明睾酮外用治疗隐睾与HCG 肌肉注射治疗效果类似,对婴幼儿隐睾症(可触及睾丸)睾丸下降作用不显著[7]。目前隐睾的治疗仍建议以手术治疗为主,激素治疗可作为手术治疗的辅助手段,对低位隐睾及部分手术病例术后睾丸回缩有一定疗效。因HCG 治疗是通过下丘脑-垂体-性腺轴提高血清睾酮浓度达到治疗隐睾的作用,对血清性激素有直接且明显的影响,是否对下丘脑-垂体-性腺轴的机能造成长远影响目前尚无定论,这需要长期及大量病例的随访研究。因HCG 治疗有可能导致骨骺早闭及对下丘脑-垂体-性腺轴的影响的潜在风险,在激素治疗作为隐睾症的辅助治疗时,外用睾酮乳膏可能是更合适的选择。

