不同稀释介质对化学发光免疫法测定雌二醇浓度的影响
司晨晨, 徐步芳, 樊为民, 张爱军
(上海交通大学医学院附属瑞金医院生殖医学中心,上海 200025)
雌二醇(estradiol,E2)浓度的测定被广泛应用于疾病的辅助诊断及临床治疗监测[1-2],尤其在生殖医学中,E2测定可用于辅助评估卵巢功能储备、月经周期、体外受精胚胎移植预后等,以及监测控制性超排卵、卵巢过度刺激综合征和促性腺激素的治疗[3]。
目前,多种技术可用于检测E2浓度,主要有化学发光免疫法、高效液相色谱法、放射免疫分析法和酶联免疫吸附法等[4]。其中,化学发光免疫法因其自动化程度高、及时性高、高灵敏度和高特异性等优点,被临床广泛使用。常用的全自动化学发光免疫法(UniCel DXI 800)检测E2的线性范围为20~4 800 pg/mL,而在临床检测中,尤其是辅助生殖领域,多数患者经过控制性超排卵和促性腺激素治疗后,其E2水平远高于上述线性检测范围。以我院生殖医学中心为例,在长达10年的临床检测工作中,有15%~20%的临床标本超出线性检测范围,必须经手工稀释后再次检测。
目前已有的E2稀释介质中,常见的有仪器配套的S0定标液、标准样本稀释液、混合低值血清、生理盐水等。由于与检测仪器配套的S0定标液价格昂贵,对于标本检测量较大的实验室有一定经济压力,且仅用S0稀释又造成定标品S1~S6的浪费。目前已有对E2稀释介质的比较研究,但由于各研究对于E2最佳替代稀释介质的选择存在争议[5-7],目前尚无统一建议。本实验室在长期的临床检测工作中发现,以往研究报道的低值混合血清及生理盐水均与仪器标准稀释液S0的稀释结果间差异较大;同时,虽然目前有其他品牌的商用样品稀释液,但其稀释结果的稳定性及准确性等方面均未得到临床实验证实。新生牛血清成分与人血清成分相似,且血清的生产工艺严格,价格低廉且性能稳定,是潜在的优质稀释介质,但目前尚未有使用新生牛血清进行E2稀释的报道。因此,本研究拟对贝克曼定标品S0、商品E2/孕酮稀释液、人低值混合血清(E2<50 pg/mL)及新生牛血清的稀释结果进行比对分析,旨在评价不同稀释液对化学发光免疫法测定E2浓度的影响,综合多种统计分析方法,以寻求最佳的临床替代稀释液。
材料与方法
一、材料
1.仪器:采用贝克曼库尔特公司UniCel Dxi800全自动化学发光免疫分析仪,序列号604925。
2.试剂:所用试剂包括仪器配套的定标品S0标准稀释液(贝克曼,批号624266,有效期至2017年3月);商品 E2/孕酮稀释液(罗氏,批号 190270-01,有效期至2016年09月,以下简称商品稀释液);新生牛血清 (浙江天杭生物科技有限公司,批号2016063108, 有效期至 2021 年 6 月,E2<50 pg/mL);低值混合血清(实验室自制,现配现用);BIO-RAD质控品(批号40320,有效期至2018年5月);贝克曼Dxi800配套试剂(批号536963,有效期至2017年2月)。
3.标本来源及低值混合血清的制备:收集2016年6月至2016年8月上海交通大学医学院附属瑞金医院生殖医学中心收治的50例患者的新鲜全血样本,离心留取血清待测。50例标本的原始测量值中,包括线性范围内样本(<4 800 pg/mL)12例,超出线性范围(>4 800 pg/mL)38例。制备低值混合血清时,收集多管生化指标正常、无污染、无纤维凝块及化学发光免疫法检测E2<50 pg/mL的低值血清,充分混匀后再次检测E2浓度,确保E2<50 pg/mL,分装、待用。
二、方法
1.精密度评估及线性范围验证:采用BIO-RAD质控品和Unity Real Time质控软件对本实验检测仪器的精密度进行评估和室间比对,评估结果均符合实验要求。同时按照美国临床实验室标准化委员会CLSI EP6-A文件《定量测定项目的线性评价》中要求验证E2测定的线性范围[8-9],验证结果符合试剂说明书要求,即20~4 800 pg/mL。
2.稀释方案:待测样品平均分成4等份,分别使用配套的S0标准稀释液(S0标准组)、低值混合血清(低值血清组)、商品E2/孕酮稀释液(商品稀释液组)和新生牛血清(牛血清组)作为稀释介质,由于待测样本总体积有限,对于E2浓度超出检测范围(4 800 pg/mL)的标本,先进行 1∶1 稀释,若稀释结果仍超出检测范围,则进行1∶4稀释,同时每管均设平行管。
3.统计学处理:配对t检验计算3种替代稀释介质的检测值与S0标准稀释液之间的差异;使用2个复管的平均值作为对应样本的实际检测值,采用Shapiro-Wilk检验对不同分组的数据进行正态性分布检验,数据分布采用平均数±标准差表示;使用Pearson相关性分析计算不同稀释介质组与S0标准组的相关系数,并拟合线性回归方程,然后用配对t检验计算线性拟合后的数值与S0标准稀释值之间的差异;不同稀释方案间的一致性比较采用Bland-Altman检验,并计算替代稀释液组与S0稀释液组之间的相对偏倚;数据分析采用 R 3.3.1和SPSS 19.0 统计分析软件, P<0.05 时认为差异有统计学意义。
结 果
一、3种替代稀释介质与标准稀释液S0的结果比较
经配对t检验发现,牛血清组、商品稀释液组及低值血清组与S0标准组比较,稀释后的检测结果差异均有统计学意义 (P 值依次为 5.03×10-11、1.44×10-10及 2.79×10-13)。
二、校正后的3种替代稀释介质与标准稀释液S0检测结果间的相关性
使用线性回归方程对3种替代稀释介质的检测结果进行校正,并用Pearson相关性检验分析其与标准组检测结果间的相关性,具体组间差值、线性回归方程和相关系数见表1。结果显示,牛血清组与S0标准组间的相对差值在所有替代稀释介质组中最低,而其相关系数及决定系数在所有替代稀释介质组中最高。图1为不同稀释介质与S0之间的相关性分析,其中牛血清组表现出最高的相关性。在上述分析中,牛血清组均表现出最佳的统计学效能。
三、不同稀释介质组内及校正后数值与S0标准组间的差值分析
为校验各替代稀释介质在实际临床检测中的准确率,对不同稀释介质组内重复管之间进行配对t检验,结果显示,S0标准组、牛血清组、商品稀释液组及低值血清组的组内重复管之间差异均无统计学意义(P 值分别为 0.47、0.44、0.31、0.07)。
用线性回归模型分别对牛血清组、商品稀释液组及低值血清组的初始测定数值进行校正,将校正后的数值与S0标准组分别进行配对t检验,结果如图2所示,校正后3种稀释介质的检测结果数值与S0标准组比较,差异均无统计学意义(P值分别为0.998 3、0.997 9、0.987 7)。
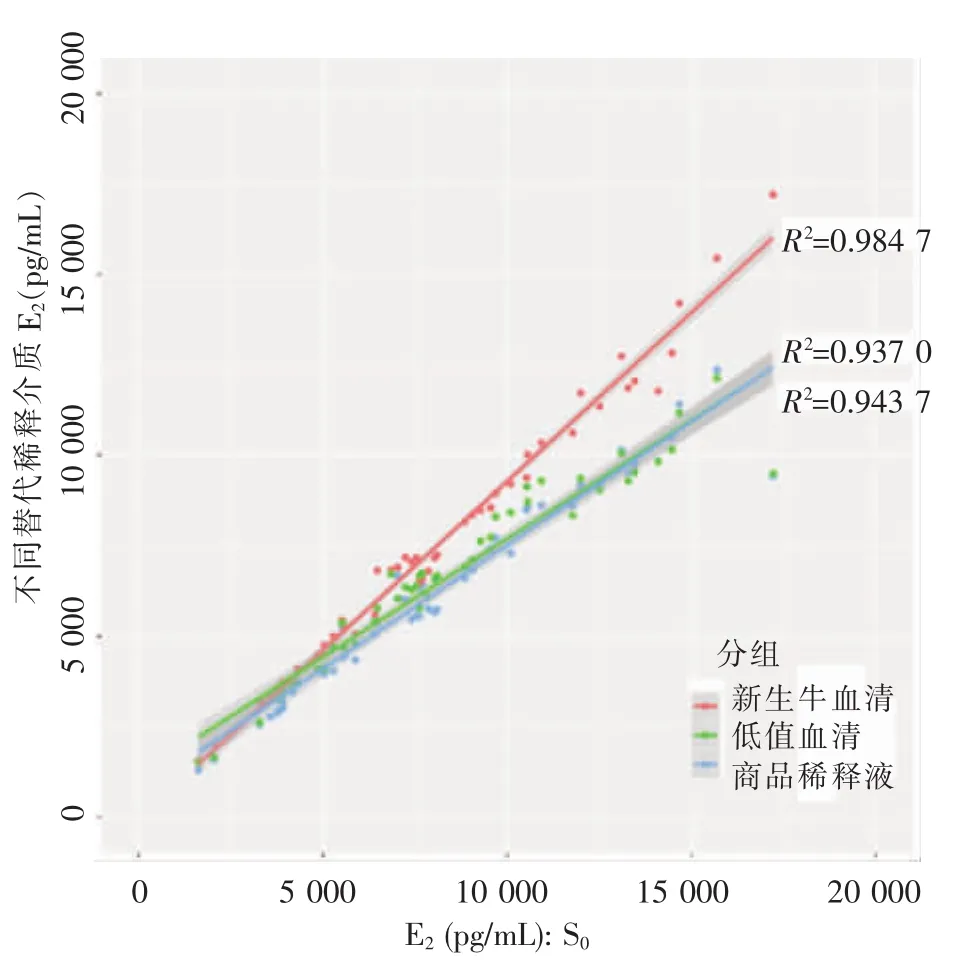
图1 替代稀释介质与S0标准稀释液检测结果的回归直线
四、3种替代稀释介质与S0标准稀释液间的一致性评价
为进一步从3种替代稀释介质中评估出最优方案,使用Bland-Altman一致性检验将3种替代稀释介质组与S0标准组进行比较,结果见图2(图2A~C依次为小牛血清、商品稀释液和混合低值血清)。牛血清组与S0标准组间的一致性比较中,有2%(1/50)的点在95%一致性界限以外,而在一致性界限范围内,比值的最大值为105.22%,最小值为83.51%。商品稀释液组与S0标准组间的一致性比较中,有6%(3/50)的点在95%一致性界限以外;在一致性界限范围内,比值的最大值为98.01%,最小值为55.16%。低值血清组与S0标准组间的一致性比较中,有8%(4/50)的值在95%一致性界限以外,在一致性界限范围内,比值的最大值为98.71%,最小值为 54.81%。

表1 替代稀释介质组与S0标准组间的E2浓度差值及回归方程
在一致性检验结果中(见表2),牛血清组超出一致性区间的样本比例最低,最大偏差最小;相关性检验中,牛血清组与S0标准组间的相关系数最高;稳定性评价中,牛血清组的内重复值间无差异。结果提示新生牛血清的综合效能在3种替代稀释介质中最优。
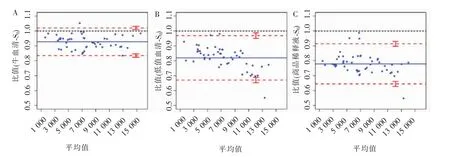
图2 Bland-Altman一致性检验

表2 替代稀释介质组综合效能评价
讨 论
一、E2检测的广泛应用及其稀释困境
作为基础性激素,E2水平可以评估卵巢功能和月经周期;在促排卵早期,E2水平的变化能提前预测卵巢反应。当E2值上升缓慢或者不上升,可提示卵巢反应较差,结合卵泡生长情况,辅助指导临床及时调整促性腺激素(gonadotropin,Gn)剂量。促排卵第6天的E2水平是衡量卵巢反应性,界定低反应的重要参数。实际临床诊疗中,检测E2水平的重要性主要体现在以下两方面。一是,Gn剂量未变化而出现自发性E2下降,以及中断卵泡刺激素(coasting方案)时E2下降,此时提示获卵数少、新鲜周期移植妊娠率下降,在排除早发黄素化后,提示临床需及时增加Gn剂量。另一种情况是,在降调节方案中,降低E2水平至预期后才注射人绒毛膜促性腺激素,这是预防卵巢过度刺激综合征的重要手段,故动态监测E2浓度下降幅度非常关键[10-11]。血清E2浓度的精准检测具有非常重要的临床意义。
UniCel DXI 800全自动化学发光免疫分析仪是目前临床常用的性激素分析仪之一[12-13],但该系统测定血清E2水平的线性范围仅为20~4 800 pg/mL,当出现多个卵泡同时发育时,E2的水平往往超出该线性范围,必须要稀释后才能够测定其真实浓度。因此,评估并选取最合适的稀释介质才可以使稀释因素所导致的干扰最小化,得到最准确的结果。仪器配套的样本稀释液S0虽准确度高,对结果影响较小[5],但价格昂贵,且不单独出售,临床标本量大的实验室几乎都使用替代稀释介质来进行标本稀释,因此,急需寻找和验证最佳的替代稀释介质。
二、综合分析显示新生牛血清为3中替代稀释介质中最佳
本研究使用了新生牛血清、低值血清及商品稀释液这3种临床上常用或已有文献报道的替代稀释介质,并将其与仪器配套的S0标准稀释液进行比较。使用配对t检验分析替代稀释介质与S0标准稀释液间检测结果的差异,结果发现3种替代稀释介质的检测结果与S0标准稀释液间的差异均有统计学意义,与已发表的部分研究结果有所不同[6],考虑可是由于环境、仪器校准、基质效应等原因,造成不同研究的检测结果间存在一定程度的偏倚。
为证明此种差异是否能通过回归方程进行校准,本研究后续进行了相关性分析,并建立了线性回归模型,用以验证经回归方程校正后的检测结果与S0标准稀释液间的差异。结果显示,新生牛血清与S0标准稀释液间的相对差值在所有替代稀释介质组中最低,且Pearson相关系数在所有替代稀释组中最高(r>0.99)。将回归模型校准后的替代稀释介质与S0标准稀释液的检测结果再次进行配对t检验,结果发现,3种替代稀释介质校正后的数值与S0标准稀释液比较差异均无统计学意义。结果提示替代稀释介质的检测结果虽与S0标准稀释液之间存在差异,但其与S0标准稀释液呈线性相关,经线性方程校正后的数值与S0标准稀释液的测定结果间差异无统计学意义。因此,替代稀释介质可以用于激素的临床检测,但其结果需经过校正,这与已经发表的部分研究结果一致[5-7,14-15]。为从3种替代稀释介质中进一步评估出最优的稀释方案,本研究通过Bland-Altman法,比较3种替代稀释介质与S0标准稀释液之间的一致性。新生牛血清与S0标准稀释液间的一致性检验结果显示,98%(49/50)的值在95%一致性界限以内;而在一致性界限范围内,比值的最大值为 1.05,最小值为 0.83,即对于绝大多数标本,S0标准稀释液与新生牛血清之间稀释后的检测结果相差5%~17%。而对于大多数的标本,S0标准稀释液与低值血清之间稀释后的检测结果相差1%~45%,其差异较新生牛血清稀释方案更为明显;S0标准稀释液与某商品稀释液之间稀释后的检测结果相差2%~45%,其差异更为明显。从临床上考虑,需稀释的标本浓度均大于4 800 pg/mL,新生牛血清与S0标准稀释液之间的差异是可以接受的,两者的检测结果间具有较好的一致性。目前,用于评估2种测量结果一致性的方法有很多,而Bland-Altman一致性评价是评价方法学一致性的常用分析方法,其准确率和灵敏度要优于传统的t检验、方差分析和相关性分析[16-17]。本研究通过综合使用此3种评价方法,并重点从一致性检验的角度,科学地分析出新生牛血清为最佳的替代稀释介质。
三、3种替代稀释介质优劣的原因分析
李洋等[6]比较了低值血清、生理盐水作为替代稀释介质与S0标准稀释液之间的差异,认为低值血清属于较好的替代稀释介质。但以往研究中使用的人低值混合血清,只是经过简单的标本筛选,并没有进行各项理化性质(脂质、纤维蛋白、血黏度及血药浓度等)的平衡和防腐处理,且血液成分复杂,个体差异大,来自不同个体的血清混合后,对检测结果的影响更加不可预测,因此在本研究的结果中发现,低值血清的偏差要大于新生牛血清,不建议作为首选的替代稀释介质。此外,虽然目前有标准化的商品E2/孕酮稀释液,但本研究发现,因不同品牌的仪器间反应原理不同,基质效应差异大,与S0标准稀释液相比偏差较大,提示不同品牌稀释液间不能随意混用。因生理盐水的基质效应较大[7],结果偏差明显,故本研究中没有对生理盐水进行比较分析。
新生牛血清作为细胞培养液已为大家所熟知,本研究第一次发现其作为替代稀释介质具有很好的潜能。化学发光免疫法的影响因素很多,包括血清中类风湿因子、补体、异嗜性抗体、医源性诱导的抗鼠Ig(s)抗体及其他自身抗体、交叉反应物、药物等[18]。近年来,各种干扰因素引起的检验结果假阴性和假阳性的报道[19-20],越来越受到临床和相关卫生部门的重视。异嗜性抗体是影响免疫测定结果的重要因素之一[21],正常人群中有3%~15%体内含有异嗜性抗体 ,而新生牛血清中的动物源性免疫球蛋白可以起到封闭异嗜性抗体的作用[18,22]。牛血清中总蛋白、白蛋白和胆固醇含量的参考范围与人大致相同[23],且血清的生产工艺严格,不含杂质蛋白,低血红蛋白含量,抗体和补体量少,防腐措施得当[24]。再加上,新生牛血清价格低廉且性能稳定,在替代稀释介质中值得被广泛推广使用。
总之,在多种替代稀释介质中,新生牛血清在高浓度E2标本稀释中检测结果最佳,且稳定性好、成本较低、可减小异嗜性抗体的影响,可作为化学发光免疫法测定高浓度E2标本时的替代稀释介质。

