硫酸脱氢表雄酮抑制3T3-L1前脂肪细胞分化的分子机制研究
瞿茹怡,徐玉梅,蒋 英,郑 洁*
(1上海交通大学医学院附属第九人民医院分子诊断科,上海 200011;2上海市第四人民医院老年医学科;*通讯作者,E-mail:zjshiyifenyuan@163.com)
脂肪组织不仅是能量储存器官,也是体内最大的内分泌腺,通过分泌一系列脂肪因子,如瘦素(leptin)、脂联素(adiponectin)、抵抗素(resistin)和网膜素(omentin)等参与多种体内病理生理过程,如能量平衡、食欲调节、胰岛素敏感性的调节、局部类固醇激素的代谢等,调节内分泌、代谢与生殖等众多生理过程。能量过剩导致体脂增加和分布异常(主要是腹型肥胖),脂肪源性的炎症因子分泌增加,是体内代谢性炎症发生发展的重要组成部分。与之直接相关的胰岛素抵抗增加,成为糖尿病、冠状动脉粥样硬化型心脏病、高血压、脂肪肝和女性多囊卵巢综合征等代谢紊乱相关性疾病的主要高危因素。
脱氢表雄酮(DHEA)及其硫酸盐(DHEA-S)是人体循环中最丰富的类固醇激素。临床和基础研究发现它有多种生理功能,如调节免疫、增加胰岛素敏感性、抗动脉粥样硬化、增加老年人的认知能力、减轻肥胖患者体重和改善老年人骨质疏松等[1,2]。此外,补充DHEA-S还有助于改善动脉粥样硬化、女性不育和衰老相关的认知能力下降[3,4]。对脂肪的研究发现,25-75 μmol/L DHEA抑制大鼠和猪原代前脂肪细胞的分化和增殖,抑制C/EBP-α的表达[5]。Kajita等[6]发现DHEA显著抑制OLTF大鼠脂肪PPARγ和C/EBPα的表达。在对人源性的原代脂肪细胞或脂肪细胞株的研究发现,DHEA抑制人SVF细胞的增殖,但增加人前脂肪细胞的分化[7];McNelis等[8]发现DHEA显著抑制人皮下脂肪细胞株Chub-S7的增殖、分化和11HSDB1的表达。Rice等[9]进一步研究发现,DHEA除了抑制3T3-L1前脂肪细胞的增殖,还抑制人网膜脂肪细胞的脂质形成。相对于DHEA,DHEA-S对脂肪细胞的分化研究较少。本研究以3T3-L1前脂肪细胞株作为研究对象,观察DHEA-S对3T3-L1细胞分化的影响,并观察调节脂肪细胞分化关键基因:过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor gamma,PPARγ)、固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein 1 c,SREBP1-c)即脂肪细胞定向分化因子1(adipocyte determination and differentiation-dependent factor 1,ADD1)、CCAAT增强子结合蛋白α、β、δ(CCAAT-enhancer-binding proteins α、β、δ,C/EBP-α、β、δ)、11β-羟类固醇脱氢酶1(11β-hydroxysteroid dehydrogenase type 1,11HSDB1)、激素敏感性脂肪酶(hormone-sensitive lipase,HSL)、脂蛋白酯酶(lipoprotein lipase,LPL)mRNA表达的变化。
1 材料和方法
1.1 主要试剂
DHEA-S购于美国International Labotory公司(IL,USA);DMEM培养基、胎牛血清(FBS)、青链霉素、0.25%胰蛋白酶购于Gibco(Grand Island,USA);逆转录试剂盒和real time-PCR试剂盒(TaKaRa,Japan);TRIzol试剂(Invitrogen, USA)。G3PDH检测试剂盒购于逸峰生物。常规型胰岛素(Lily,USA)。二甲基亚砜(DMSO)、3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松和油红“O”均购于美国SIGMA公司。引物合成由上海生工生物工程有限公司合成。
1.2 细胞培养与诱导分化
3T3-L1前脂肪细胞由上海交通大学医学院附属仁济医院刘伟课题组惠赠。3T3-L1前脂肪细胞以5×105/ml的密度接种于含有10%胎牛血清的DMEM培养液的培养皿中,在37 ℃和5% CO2的培养箱中培养。细胞贴壁生长,根据细胞生长情况,每2 d换液1次,待细胞长满80%-90%皿底,用0.15%的胰蛋白酶消化,传代培养。3T3-L1前脂肪细胞向成熟脂肪细胞的诱导:细胞长满培养皿底部至细胞融合2 d,去除普通培液,换用细胞诱导液(IBMX+地塞米松+胰岛素)诱导分化48 h。此后,换用普通培液,隔天更换培养液。
1.3 real time-PCR检测3T3-L1细胞mRNA的表达
分别于诱导前、诱导后第1,2,4,6,10,14天收集细胞,总RNA提取采用Trizol法,参考Trizol说明书操作提取总RNA。紫外分光光度仪测定OD260 nm/OD280 nm比值和总RNA浓度,取1 μg总RNA,逆转录为cDNA(20 μl体系),-20 ℃保存。逆转录条件为:37 ℃ 15 min;85 ℃ 5 s;4 ℃维持。以β-actin为内参,用real time-PCR法观察目的基因:PPARγ、ADD1/SREBP1-c、C/EBP-α、C/EBP-β、C/EBP-δ、11HSDB1、LPL和HSL mRNA表达的变化。PCR扩增条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。PCR扩增引物序列见表1。
表1 荧光定量PCR引物序列
Table 1 Sequences of primer for real time-PCR

基因 上游引物(5′-3′) 下游引物(5′-3′) β-actinGGGTCACTGGCGAGACAATGGCTAATAAGTCAAGACACCAGPPARγGGAGAAGTTACTGCGGTGTATAGATAAGCTGGGACCAGCCSREBP1cGCACCTGAAGCTGGACAACTCCTCGATCACAAGGTGAATGC/EBPαCCGAGAATGGGAAGCTTGTCAAGCACCAACGAGAGGAGAAC/EBPβCCTTTAGACCCATGGAAGTGGGAGAGGAAGTCGTGGTGCC/EBPδCACGACTCCTGCCATGTACGCCGGCCGCTTTGTGGTT11HSDB1ACTGGGGCCAGCAAAGGGAAGTCCGCCCATGAGCTTTCCHSLTGCTGCAGGAATCTGGTACCGGAGATGGCTTCCTGTTGATLPLAGCTGAGGACACTTGTCATCCGATACAACCAGTCTACTACA
1.4 前脂肪细胞分化和分化率的测定
用油红“O”染色,鉴定成熟脂肪细胞:将诱导后第8-10天的3T3-L1细胞从培箱中取出,用4 ℃预冷的PBS缓冲液洗3次。10%甲醛溶液固定细胞15 min,PBS洗3次,将细胞放于通风处晾干,加入事先配好的油红“O”工作液,染色30 min,用60%异丙醇溶液洗2次,去除多余染料后用双蒸水洗去残余异丙醇,镜下观察并拍照。在200倍显微镜视野下计数总细胞数和成熟脂肪细胞数(内含脂滴,染成红色)。前脂肪细胞分化率计算公式为:成熟脂肪细胞数/总细胞数×100%。G3PDH活性检测均按试剂盒说明书操作。
1.5 统计学分析
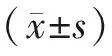
2 结果
2.1 获取DHEA-S的最佳干预浓度
用100 mmol/L的DHEAS储存液(含10%FBS培养液),用培养液稀释为300 μmol/L的工作液。再用培养液进行梯度稀释:0.41,1.23,3.7,11.1,33.3,100,300 μmol/L。常规诱导后用上述浓度梯度的DHEAS干预。CCK-8检测24 h、48 h和72 h细胞活力的变化(见图1)。结合这一实际结果,在DHEA-S浓度超过50 μmol/L(细胞活力<30%)时,细胞活力开始下降,100 μmol/L时3T3-L1细胞的死亡率近80%。故后续实验选择DHEA-S的刺激浓度为50 μmol/L。

图1 不同药物浓度对细胞死亡率的影响Figure 1 Effect of different concentrations of DHEAS on cell death rate
2.2 油红O染色观察诱导后不同时间点3T3-L1脂肪细胞内脂滴沉积的变化
对照组前体脂肪细胞在分化培养基中逐渐分化为成熟的脂肪细胞,细胞质内有脂质滴聚集,被油红O特异性染成红色。两组间比较可见,DHEA-S干预组油红染色后比对照组显著减少(见图2)。
2.3 脂肪细胞分化率的比较
诱导后随着时间点的延长,脂肪分化率呈明显上升趋势,DHEA-S组的细胞脂肪分化率均低于同期对照组(P<0.01,见图3),表明DHEA-S抑制脂肪分化。
2.4 细胞的G3PDH活性检测
甘油醛-3-磷酸脱氢酶(G3PDH)为脂肪细胞特异表达的酶类,诱导分化前无活性,诱导后活性增加。诱导后第4天G3PDH活性增加,第10天活性进一步增加。DHEA-S组的G3PDH活性比对照组的活性低,差异具有统计学意义(P<0.01,见图4)。

图2 不同诱导阶段两组的油红染色对比Figure 2 Comparison of oil red staining between two groups at different induction stages

与对照组比较,**P<0.01图3 不同时间点两组细胞脂肪分化率的比较Figure 3 Comparison of adipocyte differentiation rates between the two groups at different induction days

与对照组比较,**P<0.01图4 不同时间点两组细胞G3PDH活性的比较Figure 4 Comparison of G3PDH activities between two groups at different induction days
2.5 目的基因在不同分化时间点的水平变化
与诱导分化前(d0)相比,对照组的C/EBP-α的表达诱导后显著增加,而DHEA-S全程显著抑制C/EBP-α的表达(见图5)。对照组C/EBP-β和C/EBP-δ诱导后第1,2天即显著升高,而后逐渐下降;DHEA-S处理后,C/EBP-β和C/EBP-δ的表达与对照组相比,均显著下降;其中DHEA-S也全程抑制C/EBP-β的表达(见图5);而C/EBP-δ在DHEA-S作用下,诱导后1-6 d间的表达显著低于对照组,至第10和14天,组间差异消失(见图5)。可见,同为一个家族的脂肪细胞分化的关键转录因子,DHEA-S对C/EBP-α的抑制最为显著。DHEAS对ADD1/SREBP-1c的作用与C/EBP-β相近,但第10,14天时仍有抑制作用,组间差异具有显著性(见图5)。DHEA-S对诱导后LPL、HSL和PPARγ表达的抑制作用和C/EBP-α的变化一致(见图5)。对照组HSL诱导后,第4天表达增加达显著性,第6天后表达进一步明显上调;而DHEA-S组第10天虽然较前有上调,但仍显著低于对照组(见图5)。

与CON组比较,*P<0.05图5 两组间基因表达水平的变化Figure 5 Gene relative expression levels between two groups after induction
3 讨论
DHEA-S是人体内含量最丰富的类固醇激素,循环浓度达μmol级(1-10 μmol/L),而DHEA和大多类固醇激素一样,为pmol至nmol级(2-30 nmol/L)[10]。人体分泌的DHEA很快由硫酸转移酶2A1(sulfotransferase 2A1,SULT2A1)生成DHEAS存储于体内。在表达类固醇硫酸酯酶(steroid sulfatase,STS)的组织中,重新生成DHEA,再经3β-羟类固醇脱氢酶(3β-HSDs)的催化下生成雄激素。因此,DHEA-S多被认为是DHEA的储存形式或性激素合成的前体,而忽视了其本身的生理作用。研究发现DHEA-S可以调节体脂分布,改善胰岛素敏感性、降低骨质疏松和心血管风险等[11-13]。
体脂含量和脂肪分布与脂肪细胞的分化、增殖密切相关。脂肪细胞的分化大致经历以下几个阶段:①中胚层的间充质干细胞向脂肪细胞的定向分化,形成一种无脂滴沉积的梭形成脂肪干细胞;②成脂肪细胞经过生长抑制、克隆增殖,形成前脂肪细胞,并开始出现脂滴形成;③随着脂质在细胞中的沉积增加,逐步形成一个充满脂滴的成熟的脂肪细胞。脂肪细胞分化的不同时期有不同的分子标志,如LPL为早期的分子标志,HSL为晚期分化标志。此外脂肪细胞的分化成熟过程受一系列转录因子和酶的有序调节。其中最关键的转录因子有:①C/EBP转录因子家族。在分化早期,C/EBPβ和C/EBPδ表达短暂增加,再激活PPARγ和C/EBPα基因的表达,促进细胞分化。其中C/EBPα在脂肪细胞分化的后阶段通过上调PPARγ的表达,保持分化细胞表型等方面发挥重要作用。②PPAR转录因子家族。该家族含3个亚型:PPARα、PPARδ和PPARγ。其中PPARγ对脂肪细胞的分化起重要作用,如诱导小脂肪细胞的形成,调控乙酰辅酶A合成酶(ACS)、脂肪酸合成酶(FAS)和LPL等的表达。LPL的表达是脂肪细胞分化的早期特征,在控制脂质积聚中起重要作用。随着新合成的脂肪增多,脂肪细胞开始获得对胰岛素的敏感性,在胰岛素的作用下,脂肪细胞进一步增加脂质沉积并成熟。在体外诱导脂肪细胞分化时,地塞米松和胰岛素是最常用的诱导剂。糖皮质激素诱导C/EBP-δ的表达,可能促使C/EBP-δ/C/EBP-β异二聚体的形成,C/EBP家族有一个碱性转录激活区和一个亮氨酸拉链模体,可形成同源或异源二聚体,通过DNA结合区结合于靶基因的调控元件,如PPAR启动区的调节元件,调节PPAR的表达。PPARs结合配体后和视黄酸类受体(RXR)形成异二聚体,然后与其靶基因启动子上的过氧化物酶体增殖物反应元件(PPRE)结合调控目的基因的转录,如LPL、乙酰辅酶-A合成酶、脂肪酸合成酶等,诱导小脂肪细胞的形成,分化和成熟。
之前的研究多数集中于DHEA对脂肪细胞分化的影响,而DHEA-S的研究相对较少。本实验发现DHEA-S(50 μmol/L)抑制脂肪细胞的分化,并抑制脂肪细胞分化率和抑制G3PDH的活性。在关键基因的表达方面,DHEA-S显著抑制PPARγ、ADD1/SREBP1-c、C/EBP-α、C/EBP-β、C/EBP-δ和LPL mRNA的表达。前脂肪细胞的增殖和分化均需要糖皮质激素诱导C/EBP-δ和PPAR-γ的表达。脂肪组织有丰富的11β-HSD1表达,催化皮质酮形成活性皮质醇,是局部糖皮质激素活化的关键酶。DHEA-S通过抑制11β-HSD1的表达,减少局部活性皮质醇的水平,也是DHEA-S抑制脂肪细胞分化的可能机制之一。
综上所述,脂肪细胞的分化受众多转录因子和激素的调节。DHEA-S通过抑制11β-HSD1的表达,减少局部活性皮质醇;直接或间接抑制前脂肪细胞关键转录因子C/EBP转录因子家族和PPARγ的表达,进而抑制前脂肪细胞的分化,参与体脂平衡和分布的调节。但我们的实验仅是体外研究的结果,DHEA-S对机体脂质含量和分布的作用,需要进一步在体内实验中明确。

