离体外翻肠囊法研究白及提取物中6种成分的肠吸收特性
孙慧园,王昌权,夏 涛,梅朝叶,李月婷,潘 洁,黄 勇*
1贵州医科大学 贵州省药物制剂重点实验室/药用植物功效与利用国家重点实验室;2贵州医科大学 民族药与中药开发应用教育部工程研究中心;3贵州医科大学药学院,贵阳 550004
中药多是口服给药,需要在体内吸收后才能发挥药效,而胃肠道是吸收的主要场所,药物能否通过胃肠道的生化屏障和理化屏障取决于胃肠道的外排系统对药物的处置和药物的理化性质(如分子大小、亲脂性、极性及剂型等),了解药物的胃肠道吸收机制和吸收部位,对于确定药物的剂型,指导临床合理用药具有重要意义[1]。目前有在体肠循环法、离体外翻肠囊法、在体单向肠灌流法等常用的药物肠吸收研究方法。其中离体外翻肠囊法是由 Wilson 和 Wiseman 于 1954 年创建,最早用于研究葡萄糖和氨基酸在肠道的代谢与转运,后经改进,现已成为最常用的体外肠道吸收生物模型,具有操作简便、影响因素少、快速、重复性好等优点[2,3]。
白及为兰科植物白及Bletillastriat(Thunb.)Reichb.f.的干燥块茎,是《中国药典》收载的常用药材,其具有收敛止血,消肿生肌作用,临床主治咯血、吐血、肺结核咳血、外伤出血等症[4-6]。前期研究将白及药材用4倍量95%乙醇回流提取,提取物通过D101大孔吸附树脂,用80%乙醇洗脱,浓缩后经微波真空干燥得到白及提取物,通过对其进行药效学初步研究,结果表明白及提取物具有良好的止血功效,可通过促进血小板聚集和凝血而发挥止血作用[7,8]。通过高分辨质谱对白及提取物进行分析,发现2-异丁基苹果酸(B6)、4-(葡萄糖氧基)-肉桂酸葡萄糖氧基苄酯(B12)、1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(B14)、1-[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(B17)、二氢菲1(B19)和1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯-2-[4-O-肉桂酰基-6-O-乙酰基]葡萄糖苷(B23)这6种化合物含量相对较大[9-11]。但白及基础研究薄弱,其吸收机制尚未明确,这限制了白及相关制剂的开发和应用。鉴于因此,本实验采用离体外翻肠囊法研究不同浓度、不同肠段对白及提取物中6种成分的肠吸收的影响,阐明白及提取物的吸收特性,以期为白及提取物的剂型开发及临床合理用药提供实验参考和依据。
1 材料和仪器
1.1 材料
B6、B12、B14、B17、B19、B23对照品均为实验室自制(纯度≥95%);白及提取物(自制,批号:20160718);葛根素对照品(购自中国食品药品检定研究院,批号为110752-201512,纯度≥ 98%);乙腈、甲醇为色谱纯(德国Merck);实验用水为超纯水;其余试剂均为分析纯。
1.2 仪器
Acquity UPLC 超高压液相-三重四级杆质谱联用仪,配备AcquityTM UPLC-TQD系统(自动进样器、二元梯高压梯度泵、柱温箱、真空脱气机等)、Masslynx 4.1质谱工作站(美国Waters公司);EL204型电子天平(上海梅特勒-托利多仪器有限公司);ZH-2涡旋混合器(天津药典标准仪器厂);Allegra 64R型低温高速离心机(美国Beckman Coulter公司);CQ 250A-TS超声波清洗机(上海跃进医用光学器械厂);MTN-2800D型氮吹仪(天津奥特塞恩斯仪器公司);DK-98-ⅡA型恒温水浴锅(天津泰斯特仪器有限公司);自制麦氏浴管;混合气体(95% O2,5% CO2)。
1.3 实验动物
健康SD大鼠,雌雄兼用,体重为250±20 g,购自重庆腾鑫生物技术有限公司,为清洁级动物,动物生产许可证号:SCXK(渝)2015-0001。
2 方法
2.1 溶液的制备
2.1.1 Tyrode液的配制[11]
称取KCl 0.2 g、NaCl 8.0 g、NaH2PO40.05 g、NaHCO31.0 g及MgCl20.1 g、葡萄糖1.0 g,加蒸馏水溶解后与已溶解好的 CaCl20.2 g混匀,蒸馏水定容至1 L。
2.1.2 对照品溶液的制备
精密称取B6、B12、B14、B17、B19和B23适量,加甲醇溶解。摇匀,配制成浓度分别为B6(2.9 mg/mL),B12(1.4 mg/mL),B14(1.5 mg/mL),B17(1.1 mg/mL),B19(1.3 mg/mL),B23(2.0 mg/mL)的单一成分储备液。置冰箱(-20 ℃)保存,备用。分别精密量取上述各对照品储备液适量于塑料离心管中,37 °C条件下氮气下吹干,用Tyrode液溶解并稀释成所需浓度,得系列混合对照品溶液。
2.1.3 内标溶液的制备
精密称取葛根素(10.12 mg),用甲醇定容至25 mL。获得葛根素(0.405 mg/mL)的储备液。取葛根素内标储备液适量10 mL容量瓶中,用甲醇定容至刻度,得20 μg/mL的葛根素内标溶液,置冰箱(-20 ℃)保存,备用。
2.1.4 白及提取物供试液的制备
分别精密称定白及提取物0.25、0.5、1 g,用15 mL无水乙醇溶解,取1 mL逐滴加入到5 mL 10%吐温80水溶液中,混匀后用 Tyrode液稀释定容至100 mL(终浓度中有机溶剂含量为1%,吐温80含量为0.5%),超声10 min,5 000 rpm离心10 min,取上清液备用,获得166.7、333.3、666.7 μg/mL的白及提取物供试液。
2.2 色谱条件
色谱柱为Waters BEH C18柱(2.1 mm × 50 mm,1.7 μm);流动相0.1%甲酸乙腈溶液(A)-0.1%甲酸水溶液(B),梯度洗脱(0~1.0 min,10%~30%A;1.1~2.0 min,30%~35%A;2.1~3.0 min,35%~38%A;3.1~4.0 min,38%~90%A;4.1~5.0 min,90%~10%A);流速0.35 mL/min;柱温45 ℃;进样体积3 μL。
2.3 质谱条件
采用多反应离子监测(MRM),正负模式同时扫描,电喷雾离子源(ESI),离子源温度120 ℃,毛细管电压3 KV,去溶剂气温度350 ℃,去溶剂气(氮气) 650 L/h,碰撞气(氩气) 0.18 mL/min;离子对为B6m/z(-)189.0~129.0, B12m/z(-)593.2~431.1, B14m/z(-)725.3~457.2,B17m/z(-)457.2~285.1,B19m/z(-)347.1~332.1,B23m/z(-)1 059.3~793.1,葛根素(内标)m/z(+)417.0~267.0;碰撞能量分别为15、15、20、15、25、25、30 eV;锥孔电压分别为30、35、40、35、50、45、40 V。
2.4 样品处理方法
取样品100 μL,置1.5 mL塑料离心管中,加20 μg/mL 内标溶液40 μL,加入1%的甲酸水溶液100 μL,用正丁醇200 μL连续萃取3次,合并上层溶液置于离心管中,37 °C条件下氮气吹干,残留物用50%甲醇水溶液复溶,超声混合5 min,13 000 rpm离心10 min,取上清液进超高效液相色谱-三重四极杆串联质谱联用仪(UPLC-MS/MS)分析。
2.5 大鼠外翻肠囊实验[12,13]
实验前,大鼠禁食不禁水12 h。处死,沿腹中线打开大鼠腹腔,剪下各部位肠管,放入0 ℃ Tyrode液中洗净。将肠管小心的插入自制硅胶套管中,外翻肠段,用37 ℃ Tyrode液冲洗肠段表面的残留物,结扎另一端。将结扎好的肠段插入10 mL 37 ℃ Tyrode液的麦氏浴管中。并引入含95%O2和5% CO2混合气体。在肠管内注入2 mL 空白Tyrode液平衡5 min,然后将空白Tyrode液改变为不同浓度(166.7、333.3、666.7 μg/mL)的白及提取物供试液,分别在不同时间点(15、30、45、60、75、90、105、120 min)取样300 μL,同时补充等体积37 ℃ Tyrode液。样品储存于冰箱(-20 ℃)至分析。实验完成后,将各肠段从试管中取出,测量被考察肠段的长度和宽度,记录吸收面积(S)。
2.6 统计方法[11]
2.6.1 药物累积吸收量(Q)的计算
Q(μg)为药物各时间的累积吸收量,V平衡(mL)为平衡前肠囊中加入的Tyrode液体积,Cn(μg/mL)为各时间点取样的实际检测浓度,V取样(mL)为每次取样的体积。
2.6.2 吸收速率常数(Ka)的计算
吸收速率常数(Ka,μg/h·cm2)药物的累积吸收量对时间作相关回归分析,得出的斜率(L,μg/h) 除吸收表面积(S,cm2)之比,求得吸收速率常数(Ka)。
利用统计学软件 SPSS 18.0 进行数据分析,实验结果用Mean ± SD表示,用单因素方差分析进行组间比较,P<0.05表示差异具有统计学意义。
3 结果
3.1 Tyrode液中白及提取物的方法学考察
3.1.1 专属性
将空白肠吸收液、空白肠吸收液加混合对照品溶液和内标溶液及含白及提取物的实测样品在上述UPLC-MS/MS条件下进样分析,分别得到色谱图A、色谱图B和色谱图C。结果如图1所示:各成分的分离度良好,内源性物质对各峰无干扰,葛根素以及6种成分的保留时间(tR)分别为1.30、1.49、1.56、1.70、1.81、2.98、3.11 min。
3.1.2 标准曲线与定量下限(LLOD)
取“2.1.2”项下系列混合对照品溶液各100 μL,按“2.4”项下操作,取3 μL进样分析,记录峰面积。以测得待测物峰面积与内标峰面积之比 (A/Ai)为纵坐标,各待测物浓度 (C)为横坐标进行线性回归,权重系数为1/X,获得回归方程。最低定量限(LLOQ)定义为S/N = 10。各成分回归方程见表1。各成分在其线性范围内线性关系良好(R≥0.999),LLOD分别为0.11、0.17、0.13、0.99、0.02、0.08 μg/mL。

图1 各成分的UPLC-MS/MS色谱图Fig.1 UPLC-MS/MS chromatogram of all compounds注:A:空白肠吸收液;B:空白肠吸收液加混合标准品溶液和内标液;C:实测样品;1:葛根素;2:B12;3:B6;4:B17;5:B14;6:B19;7:B23。Note: A:Blank solution;B:Blank solution spiked with standands;C:Real sample;1:Puerarin;2:blestroside (B12);3: α-Isobutylmalic acid (B6);4:gymnosides I (B17);5:militarine (B14);6:dihydrophenanthrenes 1 (B19);7:gymnoside IX (B23).

表1 各待测物的回归方程
3.1.3 回收率和精密度试验
按 “3.1.2”项下操作,制备 6种成分的低、中、高浓度的混合质控(QC)样品,各浓度平行制备5份。取QC样品各100 μL,按“2.4”项下操作,取3 μL进样分析。将测得的各成分的峰面积之比代入标准曲线方程,以测得量与加入量之比计算方法回收率。同法配制低、中、高浓度QC样品,平行制备5份,按“2.4”项下操作,取3 μL进样,考察日内精密度;连续测定5天,考察日间精密度。结果表明6种成分回收率在87.35%和106.78%之间,日内和日间精密度RSD值均小于9.36%。符合生物样品测定要求。
3.1.4 稳定性试验
按“2.4”项下方法处理同一份肠吸收液样品,分别于0、2、4、6、8、12 h取样,按“2.4”项下操作,取3 μL进样,6种成分的RSD值均小于6.19%。表明样品在12 h内稳定。
3.1.5 基质效应
按 “3.1.2”项下操作,制备 6种成分的低、中、高浓度的混合质控(QC)样品,各浓度平行制备5份。取QC样品各100 μL,按“2.4”项下操作,取3 μL进样分析,获得峰面积(A);另取对应上述低、中、高浓度的对照溶液,37 ℃条件下N2下吹干,残留物以100 μL初始流动相溶解,各浓度平行制备5份,按“2.4”项下操作,获得峰面积(B),用A与B比值计算基质效应。结果表明6个成分的基质效应均在86.97%~101.66%之间,表明均基质效应不影响待测物的测定。
3.2 白及提取物的肠吸收特性研究
3.2.1 白及提取物在37 ℃ Tyrode液中的稳定性试验
取浓度为333.3 μg/mL的白及提取物 供试液1份,37 ℃条件下恒温水浴,分别于0、0.5、1、1.5、2、3 h取样,测定6种成分的含量变化,考察其在Tyrode液中的稳定性。结果表明6个成分在37 ℃条件下Tyrode液中稳定较好,RSD值均小于8.28%。
3.2.2 不同浓度白及提取物中各指标成分在大鼠肠段不同部位的吸收特征及累积吸收量比较
剪取大鼠十二指肠、回肠、空肠和结肠各肠段,分别置于浓度为166.7、333.3、666.7 μg/mL 的白及提取物溶液中,考察不同浓度白及提取物在各肠段的吸收情况。对不同浓度白及提取物在各肠段的经时累计吸收量Q(μg)对时间t(min)作图,并进行回归分析。各成分结果分别见图2~图7。结果表

图2 白及提取物不同浓度中B12由粘膜侧向浆膜侧转运情况Fig.2 Cumulative absorption of B12 across everted gut of

图3 白及提取物不同浓度中B6由粘膜侧向浆膜侧转运情况Fig.3 Cumulative absorption of B6 across everted gut of

图4 白及提取物不同浓度中B17由粘膜侧向浆膜侧转运情况Fig.4 Cumulative absorption of B17 acid across everted gut of

图5 白及提取物不同浓度中B14由粘膜侧向浆膜侧转运情况Fig.5 Cumulative absorption of B14 across everted gut of rat
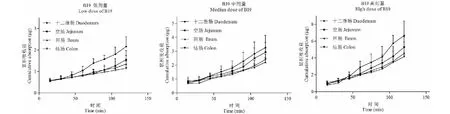
图6 白及提取物不同浓度中B19由粘膜侧向浆膜侧转运情况Fig.6 Cumulative absorption of B19 across everted gut of rat
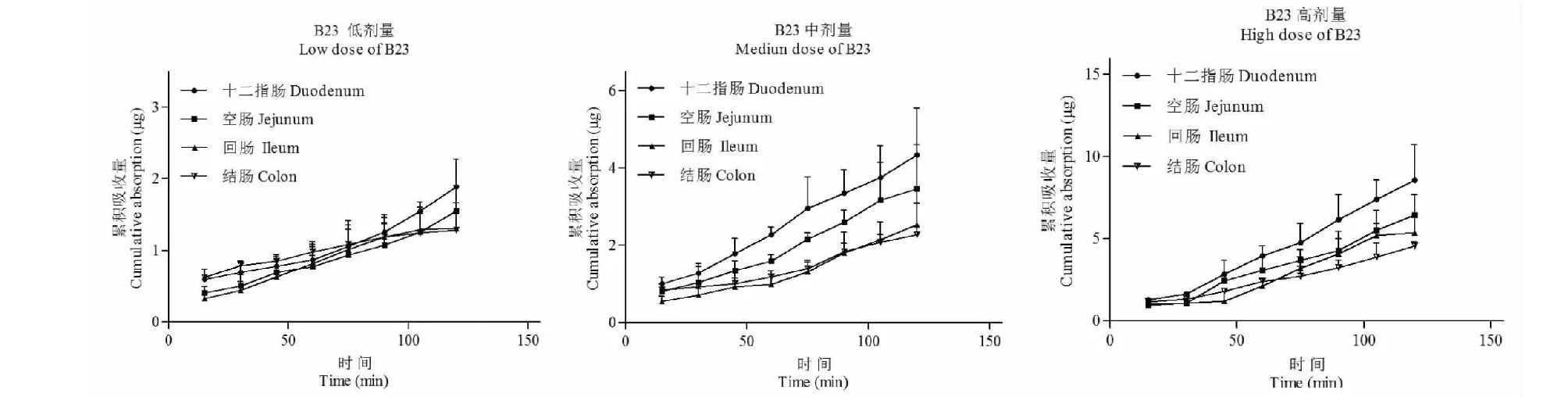
图7 白及提取物不同浓度中B23由粘膜侧向浆膜侧转运情况Fig.7 Cumulative absorption of B23 across everted gut of

表2 白及提取物在大鼠肠道不同部位的吸收速率常数(Ka)和120 min的累积吸收量
注:Ka:*P<0.05vs十二指肠,#P<0.05vs结肠;Q:**P<0.05vs十二指肠,##P<0.05vs结肠。
Note:Ka:*P<0.05vsduodenum,#P<0.05vscolon;Q:**P<0.05vsduodenum,##P<0.05vscolon.
明白及提取物中6种成分在不同浓度时均可吸收进入肠囊,除B6成分的低浓度外,各成分的累计吸收-时间曲线均为上升趋势,无饱和现象。说明6个成分在120 min时吸收未达到饱和状态。通过回归分析,除B6成分的低浓度外,各成分在不同浓度、不同肠段下均表现为线性吸收,其回归相关系数(R)均达到0.9以上,符合一级吸收速率。
3.2.3 不同浓度白及提取物中6 种成分在不同肠段中的吸收速率常数(Ka)和120 min的累积吸收量(Q)比较
对不同浓度(166.7、333.3、666.7 μg/mL)白及提取物供试品溶液中6种成分在不同肠段中的吸收速率常数Ka 进行统计学分析,结果见表2。结果显示,白及提取物中6种成分在不同肠段的Ka随着浓度的增加而增加,表明肠囊对各成分的吸收具有浓度依赖性。
综合分析累积吸收量Q和吸收速率常数Ka,可知B6在不同肠段的总体吸收趋势为十二指肠>空肠、回肠>结肠;B12在不同肠段的总体吸收趋势为十二指肠、回肠、结肠>空肠;B14在不同肠段的总体吸收趋势为十二指肠>回肠>空肠、结肠;B17在不同肠段的总体吸收趋势为十二指肠>空肠、回肠、结肠;B19在不同肠段的总体吸收趋势为十二指肠>空肠、回肠>结肠;B23在不同肠段的总体吸收趋势为十二指肠>空肠>回肠>结肠。由此可以看出不同肠段对白及提取物的各成分的吸收存在不同程度的差异。对同一肠段不同成分的吸收速率常数Ka进行分析,从总体来看在十二指肠、空肠、回肠和结肠中B14的Ka最大,B6的Ka次之;B12、B19、B23的Ka较小。说明各肠段对B14和B6的吸收相对较好。
4 结论
离体外翻肠囊法是在体外培养小肠肠环技术和刷状缘膜囊技术的基础上发展而来的,是指在动物麻醉无痛或屠宰状态下立即分离小肠,去掉肠系膜,用生理盐水或缓冲液冲洗干净,然后根据试验目的将所需肠段分割为若干小段,外翻使肠黏膜向外,结扎一端形成肠囊状,灌注人工培养液后结扎另一端,置于添加有被测物质的培养液中,通入95%氧气和5%二氧化碳的混合气体,培养一定时间后,根据囊内外被测物质的变化来反应肠道对物质吸收状况的一种生理学试验方法[14]。该方法保留了肠囊组织的完整性,能避免肠道吸收或者水分对于灌流夜的影响,数据处理较简单,能够更直观的展示药物从粘膜侧向浆膜侧转运的情况,更加便于了解药物在不同浓度,不同吸收部位的吸收特征。
本研究建立了UPLC-MS/MS 法同时测定白及提取物肠吸收液中的6种成分,并对该法进行方法学考察,结果表明该法专属性强,分析效率高,重复性好,适用于大批量生物样品的高通量分析。实验结果显示,白及提取物中4-(葡萄糖氧基)-肉桂酸葡萄糖氧基苄酯(B12)、2-异丁基苹果酸(B6)、1-[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(B17)、1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(B14)、二氢菲1(B19)和1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯-2-[4-O-肉桂酰基-6-O-乙酰基]葡萄糖苷(B23)等 6种成分在各肠段中均有吸收,且在不同肠段有不同的吸收特点。在同一浓度下,各成分总体吸收趋势为十二指肠要大于回肠、结肠和空肠。除B6成分的低浓度外,各成分在不同浓度、不同肠段下均表现为线性吸收,其回归相关系数(R)均达到0.9以上,符合一级吸收速率,且6种成分在不同肠段的Ka随着浓度的增加而增加,表明肠囊对各成分的吸收具有浓度依赖性,这与文献[15]报导一致,提示各成分的吸收可能为被动吸收。B6在低浓度时,空肠、回肠和结肠的累计吸收量随时间的增加而增加,但回归相关系数(R)小于0.9,提示在低浓度时,空肠、回肠和结肠对B6的吸收可能存在主动转运,这可能是由于中药富含多种成分,各成分间相互影响以及药物浓度的变化。研究结果表明小肠对各成分的吸收具有选择性,同一种成分可能同时存在主、被动的吸收方式。对同一肠段不同成分的吸收速率常数Ka进行分析,表明各肠段对B14和B6的吸收较好;这可能是由于B14的结构中含有两个酯键,酯键极易水解断裂;B6为有机酸类化合物,分子量较小,易透过生物膜,所以这两种物质的吸收速率相对较好。
本研究通过离体外翻肠囊法在一定程度上阐明了白及提取物的吸收机制,可大致推测白及经口服后可能的入血成分,这为白及提取物的药物临床开发,提高生物利用度,确定药物剂型方面提供了一定的理论依据。

